23 量热分析
火电企业入厂入炉煤热值差的分析和对策

火电企业入厂入炉煤热值差的分析和对策入厂煤发热量是火电厂购煤结算的主要依据,入炉煤发热量是火电厂发电煤耗计算的主要依据,二者发热量构成火电厂燃煤购与用的对比:即入厂入炉煤热值差,其差值越小越好,这是火电厂燃煤管理主要指标和发电运行的重要指标的比较。
我国标准规定入厂入炉煤热值差不得超过 0.502MJ/KG,当前仍有不少的火电企业在其入厂入炉煤热值差的控制上没能达标或者稳定在标准范围内。
控制好入厂入炉煤热值差,减少可避免的损失,这是火电企业长期不懈奋斗的目标,也是火电企业生存和发展的根本问题。
本文旨在通过对火电企业入厂煤与入炉煤热值差产生的原因进行分析,提出缩小热值差的一些见解。
笔者所在火电厂装机2×300MW机组,企业推行全面预算管理,把入厂入炉煤热值差的指标分为0.585 MJ/KG、0.418MJ/KG和0.334MJ/KG三档,进行部门考核。
在确保入厂入炉热差值数据的真实、准确和可靠的条件下,把其与相关部门收益挂钩起来,严格执行。
真正意义上促进企业各部门对入厂入炉热值差控制管理的规范化。
1 产生热值差的主要原因①煤炭质量的不均匀性。
②入炉煤煤样的采取与入炉煤的制备不规范。
③存煤堆放过多及时间过久,导致煤自燃等煤场损耗增大。
④入厂入炉煤全水分未调整统一。
⑤统计数据和分析存在影响。
2 应采取的对应措施2.1 建立完善的动力煤采购机制。
煤炭在生产、运输、销售的过程中,掺杂了很多外来因素。
正常的原煤、筛选煤,按GB/T19494《煤炭机械化采样》和GB475《商品煤样人工采取方法》, GB474《煤样的制备方法》,GB18666-2002《商品煤质量抽查和验收方法》,规范地进行采样、制备和检验,一般能达到煤炭交易双方公平贸易。
但现阶段不完善的市场经济环境下,在市场采购电煤的火电厂不得不面对各种小矿的混煤、故意掺假包裹造假的煤、企图蒙混入厂得利的问题。
所以企业要选好煤炭供应商,通过诚信、公平、有效地合作,建立起互利互惠的供销关系;对那些严重掺假的来煤,通知供方到厂处理,或按合同条款执行拒收;对屡次掺假作假,投机取巧的供方列入黑名单,停止其供煤,直至注销合同。
热分析实验报告(二)2024

热分析实验报告(二)引言概述:本文旨在对热分析实验进行详细的报告,旨在介绍实验的目的、方法、结果和讨论。
通过热分析实验,我们可以了解样品的热性能以及固态化学反应的热效应。
本次实验采用差示扫描量热法(DSC)和热重分析法(TGA)来分析样品的热性质和热分解行为。
正文:1. 实验目的1.1 熟悉差示扫描量热法和热重分析法的原理和操作方法1.2 分析样品的热性能,探究可能的相变和热效应1.3 研究样品的热分解行为,了解其稳定性和热稳定性2. 实验方法2.1 样品的制备和处理2.1.1 样品的选择和准备2.1.2 样品的称量和粉碎2.1.3 样品的处理和预处理2.2 差示扫描量热法(DSC)的操作步骤2.2.1 DSC仪器的准备和参数设置2.2.2 样品的装填和测量2.2.3 实验过程的记录和数据处理2.3 热重分析法(TGA)的操作步骤2.3.1 TGA仪器的准备和参数设置 2.3.2 样品的装填和测量2.3.3 实验过程的记录和数据处理3. 实验结果3.1 DSC曲线分析结果3.1.1 样品在升温过程中的热峰分析 3.1.2 样品在降温过程中的热峰分析 3.2 TGA曲线分析结果3.2.1 样品的失重过程分析3.2.2 样品的热分解过程分析3.3 结果的数值分析和对比4. 讨论4.1 样品的热性能分析4.1.1 样品的相变行为和热效应4.1.2 样品的热容量和热传导性能 4.2 样品的热分解行为分析4.2.1 样品的失重过程的解释和分析 4.2.2 样品的热分解动力学分析4.3 结果与理论的对比和讨论5. 结论5.1 通过DSC和TGA分析,我们获得了样品的热性能和热分解行为的有用信息5.2 样品的相变行为和热效应与其化学成分和结构密切相关5.3 样品的热分解行为显示了其热稳定性和可能的降解途径5.4 本实验为今后的相关研究和工业应用提供了有价值的参考依据总结:本文对热分析实验进行了详细的报告,介绍了实验的目的、方法、结果以及讨论。
煤炭化验中各种基的换算

煤炭化验中各种基的换算
分析基(空气干燥基)(ad):进行煤质分析化验时,煤样所处的状态为空气干燥状态。
干燥基(d):进行煤质分析化验时,煤样所处的状态为无水分状态。
收到基(ar):进行煤质分析化验时,煤样所处的状态为收到该批煤所处的状态
含义
M水分-- Mar:收到基水分(全水分);Mad:空气干燥基水分)
V 挥发份 Ahs 灰分
S硫 H 氢
以上成分收到基=空气干燥基*(100-Mar)\(100-Mad)
Qgr 高位发热量 Qnet 低位发热量
高位发热量中水分及氢氧化生成的水为液态水
收到基高位发热量=空气干燥基高位发热量*(100-Mar)\(100-Mad) 低位发热量中水为气态扣除水的气化热
空干基高位发热量转换成收到基低位发热量
Qnet,ar=( Qgr,v,ad-206Had)x(100-Mar)/(100-Mad)-23M
验算:用收到基的高位发热量转换成收到基的低位发热量收到基的低位发热量=收到基的高位发热量-水的气化热Qnet,ar=Qgr,ar-206Har-23M ar
煤的高位发热量(Qgr煤的高位发热量,即煤在空气中大气压条件下燃烧后所产生的热量。
实际上是由实验室中测得的煤的弹筒发热量减去硫酸和硝酸生成热后得到的热量。
煤的低位发热量,是指煤在空气中大气压条件下燃烧后产生的热量,扣除煤中水分(煤中有机质中的氢燃烧后生成的氧化水,以及煤中的游离水和化合水)的汽化热(蒸发热),剩下的实际可以使用的热量。
热分析实验报告

热分析实验报告实验目的热分析实验是用于研究物质在升温或降温过程中的物理和化学性质变化的实验方法。
本实验的目的是通过热分析技术,研究样品在升温过程中的热行为,并分析其热性质。
实验原理热分析涉及到一系列技术方法,主要包括差热分析(Differential Thermal Analysis,DTA)、热重分析(Thermogravimetric Analysis,TGA)和热差式量热计(Differential Scanning Calorimetry,DSC)。
在本实验中,我们将主要使用差热分析和热重分析来研究样品的热性质。
差热分析是利用样品与参比样品之间在温度升高或降低过程中吸放热量的差别,来研究样品的物理和化学性质变化。
当样品发生物理或化学变化时,其吸放热量的差别会引起差热曲线的偏移。
通过分析差热曲线的形态和峰的位置,我们可以了解样品的热反应性质。
热重分析则是通过记录样品在升温过程中质量的变化来研究样品的热分解和失水性质。
当样品发生热分解或失水时,其质量会发生变化。
通过分析热重曲线,我们可以确定样品的热分解温度和相应的质量损失。
实验步骤1.准备样品和参比样品。
样品应为已知组成和纯度的物质,参比样品应为不发生物理或化学变化的物质。
2.使用差热分析仪器,将样品和参比样品装入样品盒和参比盒中,并将其放置在差热分析仪中。
3.设置差热分析仪的升温程序和扫描速率。
升温程序应根据样品的性质来选择,扫描速率则应根据实验要求来确定。
4.开始差热分析实验,记录差热曲线。
实验过程中,温度将逐渐升高或降低,样品和参比样品的吸放热量差别将被记录下来。
5.使用热工分析仪器,将样品和参比样品装入热重分析仪器中,并将其放置在恒温器中。
6.设置热重分析仪器的升温程序和扫描速率。
升温程序应根据样品的性质来选择,扫描速率则应根据实验要求来确定。
7.开始热重分析实验,记录热重曲线。
实验过程中,样品和参比样品的质量变化将被记录下来。
实验结果与分析通过对差热曲线和热重曲线的分析,我们可以得到样品的热性质信息。
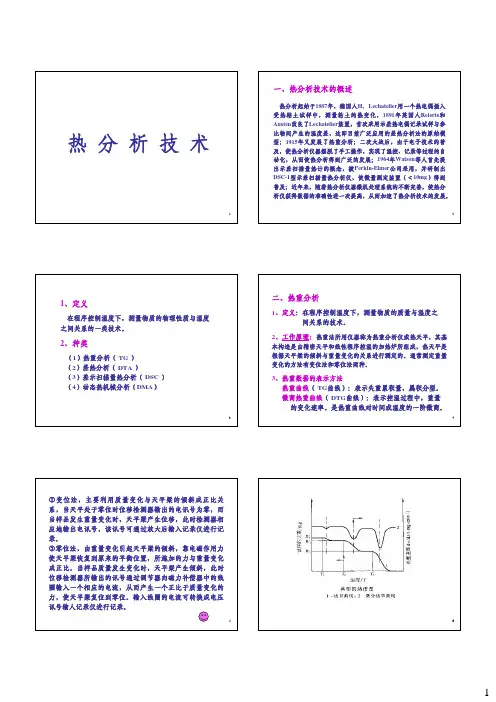
热分析
b. 样品粒度的影响 以采用小颗粒样品为好,应磨细过筛并在坩埚中装填
均匀。 c. 样品热历史的影响 许多材料往往由于热历史的不同而产生不同的晶型 或相态(包括亚稳态),以致对DTA曲线有较大的影响。 19
20
(2)
材料相态结构的变化
b. 高硅氧玻璃的差热分析
a. 引入CaF2的Na2O-CaO-SiO2系统试样的差热分析
21
22
3、基本原理
四、差示扫描量热分析法( DSC )
1、定义 在程序控制温度下,测量输入到试样和参比物的功率 差与温度之间关系的一种技术。 2、主要特点 使用的温度范围比较宽,分辨能力高和灵敏度高, 除了不能测量腐蚀性材料之外,涵盖了 DTA 的一般功 能,而且还可定量地测定各种热力学参数(如热焓、 熵和比热等),所以在材料应用科学和理论研究中获 得广泛应用。
3
E dm (2) ln k ln ln A n ln m RT dt
有几种方法可用来测定指前因子A、反应级数 n 和活化能E
13 14
通过该式可求出其他温度下的失重10%的寿命值。
(1)示差法
用这种方法求动力学参数的优点是只需要一条TG曲线,而且可以在 一个完整的温度范围内连续研究动力学。此法中,将两个不同温度的 实验值代入 (2) 式,把得到的两式相减,即可得到以差值形式表示的方 程:
1 2
1、定义
在程序控制温度下,测量物质的物理性质与温度 之间关系的一类技术。
二、热重分析
1、定义:在程序控制温度下,测量物质的质量与温度之 间关系的技术。 2、工作原理:热重法所用仪器称为热重分析仪或热天平,其基
本构造是由精密天平和线性程序控温的加热炉所组成,热天平是 根据天平梁的倾斜与重量变化的关系进行测定的。通常测定重量 变化的方法有变位法和零位法两种。
煤炭指标计算器

Qnet,ar
MJ/kg cal/g
空干基氢含量
Had CRC
% /
焦渣特征
化验结果只对本样品负责。 改复印无效。
量计算: ,ad-aQb,ad 量计算: -Mt)/(100-Mad)-23Mad 卡: 焦耳=0.239卡
氢含量
空干基氢含量 焦渣特征
备注
本化验结果只对本样品负责 涂改复印无效。
煤炭检验报告单
0 送检日期 N0:2012D030 2012.02.18 分析日期 2012.02.21 自采 检验结果 22.7 7.75 6.55 31.27 36.49 0.53 54.43 26788 26695 6380 21.13 5049 4.17 2
受检单位 样品种类 样品编号 原煤
煤炭检验
N0:2012D030 化验项目名称 全水分
,a=0.0012;Qb,ad>25100J/g ,a=0.0016; 水分
分析基水分
J/g 21127 26695 4.17 7.75 22.7
cal/g 5049
灰分
空干基灰分 空干基挥发分
挥发分 干燥无灰基挥发分 全硫 空干基全硫 固定碳 空干基弹筒发热量 空干基高位发热量 发热量 空干基低位发热量
受检单位样品序号 符号 Mt Mad Aad Vad Vdaf Sad Fcad Qb,ad Qgr,ad 计量单位 % % % % % % % J/g J/g 干基灰分 空干基挥发分 干燥无灰基挥发分 空干基全硫
固定碳 空干基弹筒发热量 空干基高位发热量
空干基低位发热量
煤的高位发热量计算: Qgr,ad=Qb,ad-95Sb,ad-aQb,ad 煤的低位发热量计算: Qnet,ad=(Qgr,ad-206Had)(100-Mt)/(100-Mad)-23M 焦耳换算大卡: 1卡=4.184焦耳;1焦耳=0.239卡
第三章 热分析法
9
热分析特点
一、应用的广泛性 从热分析文摘( TAA )近年的索引可以看出,热分 析广泛应用于无机、有机、高分子化合物、冶金与 地质、电器及电子用品、生物及医学、石油化工、 轻工等领域。 热分析与应用化学、材料科学、生物及医学的迅速 发展有密切的关系。
10
热分析装置的利用领域
熱分析の木
•电子材料 •木材・纸 •建材 •公害 •工业废弃物
应用最广泛的方法是热重( TG )和差热分析
(DTA),其次是差示扫描量热法(DSC),这 三者构成了热分析的三大支柱,占到热分析总应
用的75%以上。
12
热 分 析
加热 热量变化 重量变化 长度变化 物 质 粘弹性变化 DTA TG DSC DTG
TMA 热机械分析
DMA 动态机械分析
气体发生
冷却 热传导
⑦ 峰顶温度( Tp ):吸、放热峰的峰形顶部的温 度,该点瞬间 d(ΔT)/dt=0; ⑧ 峰高:是指内插基线与峰顶之间的距离; ⑨ 峰面积:是指峰形与内插基线所围面积; ⑩ 外推起始点:是指峰的起始边钭率最大处所作 切线与外推基线的交点,其对应的温度称为外推起 始温度(Teo);根据ICTA共同试样的测定结果, 以外推起始温度( Teo )最为接近热力学平衡温度。
2) 图表法 3) 单矿物标准法 4) 面积比法
第一节 热分析的定义及发展概况
热分析,thermal analysis:顾名思义,可以解释为以热进 行分析的一种方法。 1977年在日本京都召开的国际热分析协会(ICTA)第七次 会议上,给热分析下了如下定义:即热分析是在程序控制 温度下,测量物质的物理性质与温度的关系的一类技术。
1
热分析的数学表达式为:P=f(T)
第六章 热分析法
2018/10/12~ 15
2018/10/12~ 16
2018/10/12~ 17
6.1 差热分析法(DTA)
6.1.3 DTA曲线
横坐标:时间或温度 纵坐标:温度差ΔT 基线:ΔT 近似等于0 的区段 峰:吸热峰↓,放热峰↑ 外延始点:峰的起始边陡峭部 分的切线与外延基线的交点, 如F。
6.1.5 影响DTA曲线的主要因素
6.1 差热分析法(DTA)
仪器因素:炉子的结构与尺寸、坩埚材料与形状、热电偶性
能等。 操作因素: a 、试样的结晶度、纯度、颗粒度、用量及装填密度:影响峰 形和峰值
2018/10/12~ 25
6.1.5 影响DTA曲线的主要因素
操作因素:
b、参比物与样品的对称性:包括用量、密度、粒度、比热容 及热传导等,两者都应尽可能一致,否则可能出现基线偏移、 弯曲,甚至造成缓慢变化的假峰; c、炉内气氛: 静态气氛,一般为封闭系统,随着反应的进行,样品分 解出来的气体逐渐增加,使反应速度减慢,反应温度向 高温方向偏移。 动态气氛,气氛流经试样和参比物,分解产物所产生的 气体不断被动态气氛带走,控制好气体的流量就能获得 重现性好的实验结果。 d、记录纸速:不同的纸速使DTA峰形不同。 e、升温速率:影响峰形与峰位。
2018/10/12~ 39
6.2.3 DSC的应用
5、共聚物结构的研究
双酚A型聚砜-聚氧化丙烯多嵌段共聚物的差示扫描量热曲线
各样品软段相转变温度均高于软段预聚的转变温度(206℃)。
2018/10/12~Hale Waihona Puke 406.3 热重分析(TG)
热重分析(Thermogravimetry,TG或TGA)是在程序控制
热分析技术及在材料物理研究中的应用
2021/2/4
2
1.1 历史回顾
一、历史、一些基本定义与概念
五行相生相克的原理
相生
相克
木生火:木燃烧可以产生火 金克木:金属的斧头可以砍倒
火生土:火燃烧完木头后,产
树木
生灰烬化为尘土
木克土:树木吸取土里的养分,
土生金:从土里面可以挖掘出
使土变贫脊
金子
土克水:土可以阻挡水,或改
金生水:金子融化后变成液状
热重分析仪需要一台热天平来连续、自动地记录试 样质量随温度变化的曲线。
可以用来分析金属络合物的降解,煤的组份,物质的 脱水、分解等。
2021/2/4
16
常用的三种热重测量模式: 等温法(isothermal TG) 准等温法(quasi-isothermal TG) 动态法(dynamic TG)
2021/2/4
图示热重法的三种模式(陈道达p.13)
17
热重法测定的被测物质的质量随温度变化的关系曲线基本特
性(陈道达p.14)
2021/2/4
18
2.1.2 影响热重曲线的主要因素
1 仪器(热天平)因素 炉子的加热速度 样品器与炉子的几何形状 炉子的气氛 记录结构的灵敏度 试样容器的组成 2 试样的特性 样品的分量 逸出气体在试样中的溶解度 试样颗粒的大小 反应热 试样的填装方法 试样的性质 试样的热导率
测量物质任何物理性质参数与温度关系的一类相 关技术的总称 (A general term covering a group of related techniques whereby the dependence of the parameters of any physical property of a substance on temperature is measured.)
中考物理重点难点专练23热学实验探究含解析
专项六实验探究重难点23热学实验探究【知识梳理】一、探究固体(晶体)的熔化规律1.常见实验装置图2。
常考点(1)实验装置的顺序:先下后上。
(2)加热方法:水浴法(目的是使固体受热均匀)(3)温度计的读数。
(4)熔化图像的绘制与分析。
(5)固体是细小的颗粒好,还是大块的好:细小的颗粒好,这样便于测温和受热均匀。
(6)熔化过程不明显的原因分析:固体质量太小或者加热功率过大。
(7)晶体熔化的特点:只吸热,不升温。
二、液体(主要是水)的沸腾规律探究1.常见实验装置2。
常考点(1)绘制沸腾时的图像或者对图像进行分析。
(2)加快水沸腾的方法:减少水的质量;加盖;加大火力等。
(3)气泡大小的变化:沸腾前,由大到小;沸腾时,由小到大。
(4)装置组装顺序:由下到上。
(5)水的沸点低于100℃的原因分析:此地气压低于一个标准大气压。
(6)液体沸腾的特点:只吸热,不升温。
三、探究物质吸热能力与物质种类的关系1.常见实验装置图2。
常考点(1)实验方法:控制变量法和转换法(将物质吸热的多少转化为加热时间的长短)。
(2)对结果的比较与分析:初温相同,吸收相同的热量(加热相等的时间),比较末温的高低,末温高的,比热容小;吸收相同的热量(加热相等的时间),比较温度的改变量,改变量越大的,比热容小。
(3)水和煤油需要取等质量(控制变量),不能取等体积. (4)在探究比热容的实验中,取“等体积”的水与煤油。
【易混淆点】1.实验装置的组装顺序颠倒。
2.液体沸腾前后气泡大小的变化分析。
3.温度计读数错误.4.对图像中每段的含义、所处物态分析混乱.5.晶体处于熔点温度时,三种状态:固态、液态、固液共存均有可能。
【典例分析】【例1】(2020青岛16)探究固体熔化时温度的变化规律:如图甲所示,用“水浴法”给试管中某固态物质加热,得到该物质温度随时间变化的图象如图乙所示。
(1)采用“水浴法"加热的优点是______.(2)由图象可知,该固体是______(选填“晶体”或“非晶体”),图象中的______(选填“AB”“BC"或“CD”)段表示它的熔化过程,该物质在AB段的比热容______(选填“大于”“等于”或“小于")CD段的比热容.【答案】(1)使固态可以均匀受热且固态缓慢吸热,容易观察实现现象(2)晶体BC 小于【分析】(1)水沸腾时温度不变,且完全包围试管,好处为:使固态可以均匀受热且固态缓慢吸热,容易观察实现现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G H - TS
在恒温下
(2-6)
dG = dH – TdS
(2-7)
在恒温和恒压的平衡/非平衡条件下
dG 0
(2-8)
即在恒温恒压的自发过程中,体系将向降低Gibbs 自由能的方向进行。 (5) 热焓H
H U + pV
(2-9)
(6) 热力学基本关系式 组成恒定、不作非膨胀功的封闭体系的热力学基本方程 dU TdS PdV
在量热分析中,我们所研究的样品对象为体系,因 此,定义所有加入到体系中的量为正值,而从体系 中失去的量为负值。如体系在相变过程中吸收的热 量Q为正,而放出的热量Q为负。
2) 热力学函数
描述体系的状态函数: 可测量的状态函数: 总能量U 温度T 体积V 压力P 物质的量N 质量m
其中T、P为强度状态函数,不具加和性,即不 随物质的量增加或减少而变 U、V、N、m为量度状体函数,具有加和性,即 与物质的量成正比 当体系处于平衡态时,状态函数间的相互关系是 由平衡热力学确定的
炉温
理想的温度和差热对时间 的曲线
实际的DTA曲线
通常规定DTA曲线的T 向上为正,表示试样放热; T 向下为负,表示试样吸热。
DTA曲线中最感兴趣的就是试样在发生热效应时的情况,从 中可以确定试样的转变温度Ti 和吸(放)热量Q。 设 dQS / dt, dQR / dt 分别是试样和参比物接受热量的 速率(基热流),则
从热力学可得:
dQS dTS d CS H dt dt dt dQR dTR CR dt dt
(2-12)
CS -试样及其支架的总热容量; H -试样发生热效应时的焓变; -试样已转变部分,称为反应度; CR -参比物及其支架的总热容量。
在炉子的设计较理想条件下,取K=KS=KR,a=aS=aR,并 令热阻R=1/(K+2s+a),升温速率=dTR/dt,TS=T+ TR,依据上几式则有:
3) 热力学的四个定律 (1) 能量和熵 热力学的两个中心概念是能量和熵,其他用得 最多的概念是温度和压力。实际上温度和压力 可以用能量和熵来表达(定义)。能量和熵是 物理体系的性能,但各自具有不同特性。能量 是守恒的,既不能产生,也不能毁灭,只能从 一种形式变化到另一种形式。
(2) 可逆与不可逆过程 可逆过程:一个过程,如果每一步都可在相反的方向 进行而不引起外界的其它任何变化,则称此过程为可 逆过程 (reversible process)。或者说,如果一个过 程发生后,系统和外界都可以重新恢复到它们的初始 状态,这种过程称为可逆过程。 不可逆过程:一个过程,如果用任何方法都不可能使 系统和外界完全复原,则称此过程为不可逆过程 (irreversible process)。或者说,如果一个过程一旦 发生,无论通过如何曲折复杂的途径,都不可能使系 统和外界都恢复到它们的初始状态,这种过程又称不 可逆过程。通常,不可逆过程是自发和快速发生的, 会产生“流”和“摩擦”效应。
1/ V V / P T ,N 为体积压缩系数
物质在熔化时G的变化G为0,熔化热Hf 和熔化熵Sf 及熔化温度Tm有如下关系:
Tm = Hf /Sf
(2-10)
6) 热力学转变与热力学函数 (1) 一级转变 G是T和P的连续函数,在转变温度T1处有转折。G的一阶 导数的函数在通过转变时发生不连续:
2G C p / T 2 T 2G V P / T 2G V 2 P
2.3.2 量热原理与仪器
1) 量热类型与原理
(1) 差热分析法 (Differential Thermal Analysis, DTA) 在相同加热或冷却条件下,测量试样和参比物的温 差T的一种技术 在DTA测量中,T 是试样热量变化QS的反应,应与 QS成正比: T = R QS (比例系数R是体系的热阻) (2) 差示扫描量热法 (Differential Scanning Calorimetry, DSC) 在程序温度控制下测量物质与参比物之间单位时间的能 量差(或功率差)随温度变化的一种技术。 DSC分为热流式或热通量、功率补偿式三种。究其实质 看,前两种是属DTA原理。它们是使用在不同温度下 DTA曲线峰面积与试样焓变的校正曲线来定量量热的差 热分析法,但因结构上与传统的DTA有别,故并不称它 们为定量DTA。
(2)式还表明,温度越高则熵变数值越小。从较低温度 T1到较高温度T2,熵变不可能为负值,即下式不成立:
Q Q S 0 T2 T1
(热不可能自发从 低温传到高温)
仅就孤立体系而言,熵变应遵从dS 0。对于开放体系 和封闭体系,在dS中必须包括环境变化,但不便计算。
(2) 玻兹曼(Boltzman)熵定理
G H G T T P G S T P G V P T
G的二阶导数,如 CP T (2G / T 2 ) P 相应地出现 无穷大(实际上出现的是一转变峰)
(2) 二级转变
G是及其一阶导数均是T和p的连续函数,但在转变 温度T2处一阶导数有转折。因此,如下的G的二阶导 数呈现不连续:
dQS K S (TW TS ) s (TR TS ) a S (TO TS ) dt (2-11) dQR K R (TW TR ) s (TS TR ) a R (TO TR ) dt
KS、KR 加热炉壁对试样与参比物的传热系数; aS、aR 分别为试样与参比物的热损失系数(热偶等传到外部); s 为试样与参比物之间的传热系数 o表示环境
吉布斯自由能与温度的关系: Gibbs-Helmholtz公式
S CV T T V S CP T T P
G / T H T2 T P
5) 热力学分析常用到的状态函数 热分析的基本状态函数(无化学变化或相变)是热容,一般假 定体系是封闭的,组成恒定,仅可交换热量和功。 热容的一般表达为:
C = Q/T
(2-10)
状态函数的第一定律表达式在有热膨胀做功的情况下, 内能的变化为
dU = dQ - PdV
而定容比热为
dQ / dT (U / T )V ,N CV
热分析通常是在常压下进行,而体系的体积相当小,因 此热焓H与内能U之差不大,则有
U V dQ H CP CV P dT T P , N T T , N T P , N
热流式差示扫描量热仪(heat flow DSC):
用炉子控制环境温度,测量通 过康铜片流向试样和参比物的 热流之差。
热流型DSC是属于热交换型的 量热计,与环境的热量交换是 通过热阻进行测量,测量的信 号是温差,其值表示交换的强 度,并与热流速率 (=dQ/dt) 成正比。
热通量式差示扫描量热仪(heat flux DSC):
dH TdS VdP dF SdT PdV dG SdT VdP
麦克斯韦 ( Maxwell )关系 热容与T、S、P、V的关系
S P V T T V S V P T T P
d d T RH T R CS CR RCS dt dt
(2-13)
用图示表示(3-3)时中的几项:
d d T RH T R CS CR RCS dt dt
由定压实验测得的热容与温度的关系, 计算出任意温度的热焓:
H (T ) H (T0 ) CP dT
T0
T
CP S (T ) S (T0 ) dT T0 T
T
Cp 与 CV的近一步关系:
CP CV TV 2 /
其中 1/ V TV / P, N 为热膨胀系数
2.3 量热分析 2.3.1 热力学基础 1) 体系与环境 热分析是对物质进行宏观描述的一种实验技术, 所给出的量具有统计性质。 任何一个体系都可以 分为下述三种之一: 开放体系 封闭体系 孤立体系 体系 体系边界
环境
例子:
热重法是观测敞开体系的一种仪器 量热法是属于封闭体系的一种测量方法 弹式量热计的整体可以看着为一个孤立体系
它把试样焓变的 热通量几乎没有 什么损失地被多 重热电偶所测得。
Calvet热通量DSC是在试样支架和参比物支架附近的薄壁氧 化铝管壁上安放几十对乃至几百对互相串联着的热电偶,其 一端紧贴着管壁,另一端则紧贴着银均热块,然后将试样侧 多重热电偶与参比物侧多重热电偶反接串联。
Mettler DSC822 FRS5 差热传感器特点: 可更换的传感器, 比更换整个 测量炉费用低! 具有56对热电偶堆的第五代传 感器 基线稳定高 (不受不对称因素的影响) 数字分辨率高 (DSC822e: 16 00万点) 时间常数 1.6 s (20 mg Al 坩埚, He 气) 高强度抗化学腐蚀性 灵敏度高 0.04uw
在普通DSC的程序控制加热的基础上,是在线性升、 降温的基础上叠加一个正弦振荡温度程序,产生与 之相应的循环热流。按此种方式,不仅可以测定总 热流,并可将其分解成可逆成分与不可逆成分两部 分。总热流是传统DSC的热流信号,可逆热流是热 流的热容成分。
(3) 差热分析的基本原理 试样在加热或冷却过 程中应物理或化学变 化产生热效应。从而 引起试样温度的变化, 对这个温度的变化以 差示法进行测定,这 就是DTA的基本原理。 DTA的基本装置 Ts-试样的温度,Tr-参比物的温度 温度差T=Ts-Tr 作为温度或时间的函数记录下来,得到 的曲线就是DTA曲线。或表示为: T=F(T或t)
功率补偿型差示扫描量热仪(power compensation DSC): 按试样相变(或反应)而0.01 K。 功率补偿型DSC是属热补偿型量热计,待测的热量几乎 全部是由电能来补偿的。 温度调制型差示扫描量热仪(Temperature Modulated DSC, TMDSC):
