[推荐学习]中考化学黄金知识点系列专题13元素元素周期表
初三化学元素周期表(完整版)

初三化学元素周期表顺口溜:氢(qīng) 氦(hài)锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi)n) 硫(liú)氯(lǜ) 氩(yà)钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lí钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù)氪(kè)铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān)铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng)钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún)镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(tè) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì)镥(lǔ)锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo)附化学元素周期表口诀青害李皮朋,探丹阳付奶。
初中化学元素周期表知识点归纳总结

初中化学元素周期表知识点归纳总结元素周期表是化学研究中的重要工具,通过对元素的排列和分类,能够直观地展示元素的性质和规律。
初中化学学习时,我们会接触到一些基本的元素周期表知识点,本文将对这些知识点进行归纳总结。
1. 元素周期表的基本结构元素周期表按照元素的原子序数(即元素的核中质子的数量)从小到大排列,每个元素都是通过其原子核中的质子数唯一确定的。
周期表分为水平行(周期)和垂直列(族),周期号从1开始增加,族号从1开始增加。
周期表的左侧为金属性元素,右侧为非金属性元素,中间是过渡性元素。
2. 元素周期表中的主要区域根据元素周期表的结构,我们可以将其分为四个主要区域:主族元素区、过渡元素区、稀土元素区和超铀元素区。
- 主族元素区:包括周期表的第1A、2A和3A到8A族,这些元素的化学性质较为相似,且易于形成离子化合物。
- 过渡元素区:周期表的第3B到12B族,这些元素的化学性质处于主族元素和稀土元素之间,常常能够形成多种价态。
- 稀土元素区:包括两行14个元素,周期表的最后一行和最后一列出现。
稀土元素具有相似的电子排布和化学性质,很多稀土元素具有重要的应用价值。
- 超铀元素区:周期表的第7周期和第8周期,这些元素的原子序数大于铀元素(92),尚未在自然界中发现,只能通过人工合成。
3. 元素周期表中的重要性质和规律在元素周期表中,每个元素都有一些重要的性质和规律,下面是其中几个比较重要的:- 原子半径:从左至右逐渐减小,从上至下逐渐增大。
主族元素中,原子半径随着周期号的增加而增大。
- 电离能:从左至右逐渐增大,从上至下逐渐减小。
主族元素中,第一离化能随着周期号的增加而减小。
- 电子亲和能:从左至右逐渐增大,从上至下逐渐减小。
主族元素中,电子亲和能随着周期号的增加而减小。
- 金属性和非金属性:元素周期表左侧为金属性元素,右侧为非金属性元素。
金属性元素具有良好的导电性和导热性,非金属性元素主要为气体、半导体和非金属固体。
中考-初中化学必过-元素周期表-知识点全掌握

中考-初中化学必过-元素周期表-知识点全掌握1. 元素周期表共有7个横行,18个纵行.每一个横行叫做一个周期,每一个纵行叫一个族。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子序数依次增加,原子半径递减(零族元素除外),失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
2. 元素在元素周期表中的信息:中间是汉字,左上角数字是原子序数,也就是元素原子的质子数,右上角是元素符号,汉字下面是相对原子质量。
3. 原子结构示意图中,小圆圈表示原子核,圈内正数表示原子的核电荷数,弧线表示电子层,电子层数等于周期数,弧线上的数字表示该电子层上的电子数.原子结构示意图可以确定元素种类、原子的质子数、元素的化学性质,不能确定相对原子质量。
金属元素的最外层电子数一般少于4,非金属元素的最外层电子数一般多于4,最外层电子数小于4的原子容易失去电子。
原子结构示意图不能确定中子数。
4.原子是由居于原子中心带正电的原子核和核外带负电的电子构成。
原子是化学变化中的最小粒子,化学反应前后,原子的种类和数目不变。
分子的保持物质化学性质的一种粒子。
原子的质量主要集中在原子核上,得失电子不影响其质量,故其质量几乎相等。
原子和离子具有相同的质子数,相同的核电荷数。
5. 质子数决定元素的种类;元素的化学性质跟它的原子的最外层电子数关系非常密切,原子的质量主要集中在原子核上.质子数相同,而核外电子数不同的两种粒子,是同一种元素或性质不同的两种粒子,性质不同的两种粒子不一定就是阳离子和阴离子,也可能是原子和离子。
6. 质子数=核电荷数=核外电子数=原子序数;质子数+中子数≈相对原子质量。
“质子数一定等于电子数”,这种说法不正确,原因是在离子中质子数不等于电子数.7. 化合价写在元素符号正上方;元素符号右上角的数字表示离子所带电荷数;元素符号右下角数字表示物质的一个分子里含该原子的个数;元素符号前面的数字表示微粒的个数(分子、原子、离子)。
初中化学元素周期表知识点归纳

初中化学元素周期表知识点归纳元素周期表是化学领域中最为重要的工具之一,它对于我们理解和研究化学元素之间的关系至关重要。
初中化学学习过程中,我们也接触了一些基础的元素周期表知识点。
本文将对初中化学元素周期表的知识点进行归纳和总结。
1. 元素周期表的构造元素周期表是由化学元素按照一定规律排列组成的表格。
元素周期表分为若干水平行和垂直列。
水平行称为周期,垂直列称为族。
周期数代表元素的电子层数,族数代表元素的化学性质。
元素周期表的左上角是最轻的元素氢(H),右下角是最重的元素奥尔金(Og)。
2. 元素周期表中的元素信息每个元素周期表中的元素都通过原子序数(Z)进行编号,并且按照原子序数从小到大排列。
原子序数代表元素原子核中的质子数或电子数,也是元素的特征性质之一。
元素周期表中的元素以元素符号和元素名称表示,元素符号是拉丁文中的元素首字母大写或首字母和次字母组成,元素名称则是元素的俗称。
3. 元素的周期性性质元素周期表将化学元素以一定的规律排列,这种排列方式反映了元素性质的周期性变化。
主要的周期性性质包括原子半径、电离能、电子亲和能、电负性等。
- 原子半径:在同一周期内,原子半径随着原子序数的增加而减小。
在同一族内,原子半径随着原子序数的增加而增大。
- 电离能:元素的电离能是指从一个原子中,移去一个外层电子所需的能量。
一般来说,在同一周期内,元素的电离能随着原子序数的增加而增加。
在同一族内,元素的电离能随着原子序数的增加而减小。
- 电子亲和能:元素的电子亲和能是指一个原子接受一个外层电子所释放出的能量。
在同一周期内,元素的电子亲和能随着原子序数的增加而增加。
在同一族内,元素的电子亲和能随着原子序数的增加而减小。
- 电负性:元素的电负性是指原子吸引共享电子对的能力。
在元素周期表中,电负性随着从左到右的增加而增加,从上到下的减小。
4. 元素的族特性元素周期表中的族数代表着元素的化学性质。
以下是几个常见的元素族特性:- 碱金属元素:位于元素周期表第一族,最明显的代表是钠(Na)和钾(K)。
初三化学元素周期表(完整版)讲解学习
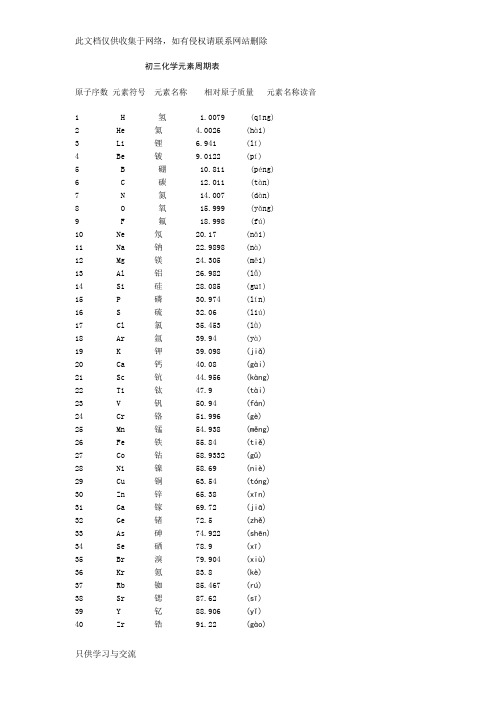
初三化学元素周期表原子序数元素符号元素名称相对原子质量元素名称读音1 H 氢 1.0079 (qīng)2 He 氦 4.0026 (hài)3 Li 锂 6.941 (lǐ)4 Be 铍 9.0122 (pí)5 B 硼 10.811 (péng)6 C 碳 12.011 (tàn)7 N 氮 14.007 (dàn)8 O 氧 15.999 (yǎng)9 F 氟 18.998 (fú)10 Ne 氖 20.17 (nǎi)11 Na 钠 22.9898 (nà)12 Mg 镁 24.305 (měi)13 Al 铝 26.982 (lǚ)14 Si 硅 28.085 (guī)15 P 磷 30.974 (lín)16 S 硫 32.06 (liú)17 Cl 氯 35.453 (lǜ)18 Ar 氩 39.94 (yà)19 K 钾 39.098 (jiǎ)20 Ca 钙 40.08 (gài)21 Sc 钪 44.956 (kàng)22 Ti 钛 47.9 (tài)23 V 钒 50.94 (fán)24 Cr 铬 51.996 (gè)25 Mn 锰 54.938 (měng)26 Fe 铁 55.84 (tiě)27 Co 钴 58.9332 (gǔ)28 Ni 镍 58.69 (niè)29 Cu 铜 63.54 (tóng)30 Zn 锌 65.38 (xīn)31 Ga 镓 69.72 (jiā)32 Ge 锗 72.5 (zhě)33 As 砷 74.922 (shēn)34 Se 硒 78.9 (xī)35 Br 溴 79.904 (xiù)36 Kr 氪 83.8 (kè)37 Rb 铷 85.467 (rú)38 Sr 锶 87.62 (sī)39 Y 钇 88.906 (yǐ)40 Zr 锆 91.22 (gào)42 Mo 钼 95.94 (mù)43 Tc 锝 (99) (dé)44 Ru 钌 161.0 (liǎo)45 Rh 铑 102.906 (lǎo)46 Pd 钯 106.42 (bǎ)47 Ag 银 107.868 (yín)48 Cd 镉 112.41 (gé)49 In 铟 114.82 (yīn)50 Sn 锡 118.6 (xī)51 Sb 锑 121.7 (tī)52 Te 碲 127.6 (dì)53 I 碘 126.905 (diǎn)54 Xe 氙 131.3 (xiān)55 Cs 铯 132.905 (sè)56 Ba 钡 137.33 (bèi) 57-71 La-Lu 镧系57 La 镧 138.9 (lán)58 Ce 铈 140.1 (shì)59 Pr 镨 140.9 (pǔ)60 Nd 钕 144.2 (nǚ)61 Pm 钷 (147) (pǒ)62 Sm 钐 150.3 (shān)63 Eu 铕 151.96 (yǒu)64 Gd 钆 157.25 (gá)65 Tb 铽 158.9 (tè)66 Dy 镝 162.5 (dī)67 Ho 钬 164.9 (huǒ)68 Er 铒 167.2 (ěr)69 Tm 铥 168.9 (diū)70 Yb 镱 173.04 (yì)71 Lu 镥 174.967 (lǔ)72 Hf 铪 178.4 (hā)73 Ta 钽 180.947 (tǎn)74 W 钨 183.8 (wū)75 Re 铼 186.207 (lái)76 Os 锇 190.2 (é)77 Ir 铱 192.2 (yī)78 Pt 铂 195.08 (bó)79 Au 金 196.967 (jīn)80 Hg 汞 200.5 (gǒng)81 Tl 铊 204.3 (tā)82 Pb 铅 207.2 (qiān)83 Bi 铋 208.98 (bì)85 At 砹 (201) (ài)86 Rn 氡 (222) (dōng)87 Fr 钫 (223) (fāng)88 Ra 镭 226.03 (léi)89-103 Ac-Lr 锕系89 Ac 锕 (227) (ā)90 Th 钍 232.0 (tǔ)91 Pa 镤 231.0 (pú)92 U 铀 238.0 (yóu)93 Np 镎 (237) (ná)94 Pu 钚 (244) (bù)95 Am 镅 (243) (méi)96 Cm 锔 (247) (jú)97 Bk 锫 (247) (péi)98 Cf 锎 (251) (kāi)99 Es 锿 (252) (āi)100 Fm 镄 (257) (fèi)101 Md 钔 (258) (mén)102 No 锘 (259) (nuò)103 Lr 铹 (262) (láo)104 Rf 钅卢 (257) (lú)105 Db 钅杜 (261) (dù)106 Sg 钅喜 (262) (xǐ)107 Bh 钅波 (263) (bō)108 Hs 钅黑 (262) (hēi)109 Mt 钅麦 (265) (mài)110 Uun (281)111 Uuu (272)112 Uub (285)114 Uuq (289)(加括号的数据为该放射性元素半衰期最长同位素的质量数。
人教版初中化学必背元素周期表

人教版初中化学必背元素周期表
该元素周期表收录了人教版初中化学教材中必须要掌握的所有元素信息,包括元素符号、原子序数、原子量等。
了解和熟记元素周期表是初中化学研究的基础,对深入研究和理解化学原理非常重要。
下面是人教版初中化学必背元素周期表的完整版:
请根据教材要求,认真研究和掌握这份完整的元素周期表,加深对各种元素的理解和认知,为进一步研究化学打下良好的基础。
请注意,这只是一个示例文档,没有实际数据来支持它的准确性。
请使用合适的数据源来创建准确和可靠的元素周期表文档。
初中化学元素周期表汇总

初中化学元素周期表汇总化学元素周期表是化学中非常重要的工具,它是有序地排列了所有已知的化学元素,根据元素的原子序数和化学性质,使得我们能够更好地理解和研究各种化学现象。
在初中化学学习中,理解元素周期表的相关知识是非常重要的。
本文将对元素周期表的结构、元素特性以及一些重要元素进行汇总和介绍。
元素周期表的结构和排列元素周期表的结构非常有序,它由一系列的水平行和垂直列组成。
水平行被称为周期,每个周期代表了一个新的能级,从左到右,电子壳层数依次增加。
垂直列被称为族,元素周期表中的每一族都有相似的化学性质。
元素周期表可分为四个区域:主族元素区、过渡元素区、稀土元素区和超铀元素区。
化学元素的特性和分类元素周期表中的化学元素具有不同的性质,我们可以根据这些性质对元素进行分类。
1. 金属元素:位于元素周期表的左侧和中部,具有良好的导电性、导热性和延展性。
金属元素在化学反应中容易失去电子,形成阳离子。
2. 非金属元素:位于元素周期表的右侧,大多数是气体或者脆性固体。
非金属元素在化学反应中容易获得电子,形成阴离子。
3. 半金属元素:位于元素周期表的中间地带,具有金属和非金属的一些性质,也被称为“类金属”。
4. 稀有气体元素:位于元素周期表的第18族,它们是非常稳定的、较为惰性的元素,几乎不参与化学反应。
5. 过渡元素:位于元素周期表的4至7周期之间,它们通常具有较高的密度和熔点,是许多合金的重要成分。
常见元素和其性质以下是几种在初中化学中常见的元素和它们的一些性质:1. 氢(H):位于元素周期表的第1个位置,是最轻的元素。
它是宇宙中最丰富的元素之一。
氢气是一种气体,能与氧气反应生成水。
2. 氧(O):位于元素周期表的第16个位置,是空气中最常见的元素之一。
氧气对生物是必需的,支持燃烧和呼吸。
3. 碳(C):位于元素周期表的第14个位置,是生命中的主要构成元素。
碳可以形成长链,构成有机物。
4. 铁(Fe):位于元素周期表的第26个位置,是一种常见的金属元素。
初三化学元素周期表完整版

初三化学元素周期表完整版元素周期表是一张按照原子序数分组排列的表格,其中包含了所有已知元素。
这张表格是化学中最基本的工具之一,它可以帮助人们更深入地了解元素的性质及其在化学反应中的作用。
元素周期表中的每一个元素都有其独特的原子结构和化学性质。
在元素周期表中,元素按照其原子序数的增加而排列。
原子序数指的是元素原子中所含的质子数,同时也是这个元素在元素周期表中的位置。
在同一周期(横行)中的元素,它们的电子外层壳层的最大数量相同,这个数量也就是该周期的周期数。
同时,在同一族(竖列)中的元素,它们的电子外层壳层的电子数相同,因此它们的化学性质也相似。
元素周期表中的第一周期中只有两个元素,它们是氢和氦。
氢是宇宙中最常见的元素之一,它也是化学元素中最轻的元素。
它的原子结构只包含一个质子和一个电子。
氮气是一种惰性气体,在自然状态下不会参与任何化学反应。
而氦则是一种质量较大的惰性气体,并且也不会参与任何化学反应。
第二周期包含了八个元素,其中包括了一些非常有用且普及的元素,如锂、铍、硼、碳、氮、氧、氟以及氖。
除氖之外,这些元素都是金属元素,它们在自然状态下都可以和其他元素形成化合物。
其中,碳被认为是最重要的元素之一,它的存在使得地球上的所有生命都能够得以维持。
第三周期包含了八个元素,其中比较重要的有钠、镁、铝、硅、磷、硫、氯以及氩。
钠和镁都是常见的金属元素,它们在化学反应中都可以释放出电子。
铝是一种轻质而稳定的金属,它们在现代工业和建筑方面都有着广泛的应用。
硅是一种电子元素,在现代电子工业中有着非常重要的作用。
第四周期包含了18个元素,其中比较有名的元素有钾、钙、钪、铁、铜、锌、银以及氩等元素。
这些元素在生活中都有着广泛的应用。
比如,钙和铁是人体中必需的元素,锌则是一种非常重要的工业材料。
氩是一种惰性气体,在现代科学研究中有着广泛的应用。
第五周期包含了18个元素,其中比较有名的元素有硒、钒、钼、铬、锰、铁、镍、铜、锌以及氩等元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点十三:元素聚焦考点☆温习理解一、原子的构成1、原子的结构(1)原子结构的认识(2)在原子中由于原子核带正电,原子核带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性。
因此,对于原子: 核电荷数=质子数=核外电子数(3)原子的质量主要集中在原子核上注意:①原子中质子数不一定等于中子数②并不是所有原子的原子核中都有中子。
例如:氢原子核中无中子2、相对原子质量(A r ):(1)(2)相对原子质量与原子核内微粒的关系:相对原子质量≈质子数+中子数3、原子核外核外电子的排布(1)、核外电子排布的规律:①第一层最多容纳2个电子;②第二层最多容纳8个电子;③最外层最多容纳8个电子(若第一层为最外层时,最多容纳2个电子)相对原子质量=质子数(2)、原子结构图各部分的含义:①圆圈内的数字:表示原子的质子数②+:表示原子核的电性③弧线:表示电子层④弧线上的数字:表示该电子层上的电子数(3)、元素最外层电子数与元素性质的关系金属元素:一般最外层电子数<4 容易失电子,形成阳离子非金属元素:一般最外层电子数≥4 容易得电子,形成阴离子稀有气体元素:最外层电子数为8(He为2)不易得失电子最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构因此元素的化学性质主要和由原子的最外层电子数有关。
二、元素1元素(1)含义:具有相同质子数(或核电荷数)的一类原子的总称。
注意:元素是一类原子的总称;这类原子的质子数相同因此:元素的种类由原子的质子数决定,质子数不同,元素种类就不同。
(2)、元素的分类:元素分为金属元素、非金属元素和稀有气体元素(3)、元素的分布:①地壳中含量前四位的元素:O、Si、Al、Fe ②空气中前二位的元素:N、O2、元素符号(1)、书写原则:第一个字母大写,第二个字母小写。
(2)、表示的意义:①表示某种元素②表示某种元素的一个原子。
(3)、原子个数的表示方法:在元素符号前面加系数。
因此当元素符号前面有了系数后,这个符号就只能表示原子的个数。
例如:“2H”只表示2个氢原子。
(4)、元素符号前面的数字的含义;表示原子的个数。
例如:6N:6表示6个氮原子。
三、元素周期表1、发现者:俄国科学家门捷列夫2、结构:7个周期16个族(7个横行18个纵行)3、元素周期表中每一方格提供的信息:对于原子:原子序数=质子数=核电荷数=电名师点睛☆典例分类类型一、原子结构及原子结构示意图【例1】【2016年四川省乐山市】下列粒子结构示意图中,属于阴离子是()A. B. C. D.【答案】B【点睛】在微粒结构示意图中核电荷数=质子数=核外电子数为原子;核电荷数=质子数<核外电子数为阴离子;核电荷数=质子数>核外电子数为阳离子;其实质是原子得失电子变为离子。
类型二、元素【例2】【2016年山东省泰安市】下列关于四种粒子的结构示意图的说法中正确的是()A.①③是不同种元素 B.②表示的元素在化合物中通常显+1价C.②③的化学性质相似 D.①④表示的是离子【答案】B【解析】A、同种元素质子数一定相同,①③的质子数都是17,所以两者属于同种元素;B、该原子最外层电子数是1,化学反应中易失掉这个电子而形成带一个单位正电荷的阳离子,所以②表示的元素在化合物中通常显+1价;C、因为元素的性质和最外层电子数关系密切,所以最外层电子数相同则化学性质相似,②③的最外层电子数分别是1、7,故性质不会相似;D、由于离子中质子数与核外电子数不等,而①中质子数小于电子数是阴离子,④中质子数等于电子数是原子;故选:B【点睛】有元素的定义可知质子数(或核电荷数)决定了元素种类,也就是说质子数相同的原子和离子属于同种元素。
类型三、元素周期表的应用【例3】【2016年山东省青岛市】青岛是一座美丽的海滨城市,海洋资源非常丰富。
下图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是A .氯是一种非金属元素B .钠元素的相对原子质量是22.99C .钠原子的中子数为11D .氯元素的原子序数为17【答案】C【点睛】在元素周期表中的一格能获取的信息为元素名称、原子序数、元素的种类、元素符号及原子的相对原子质量.课时作业☆能力提升1.【2016年内蒙古呼和浩特市】地壳中含量最多的金属元素是( )A .OB .SiC .AlD .Fe【答案】C【解析】地壳中含量最多的金属元素是铝元素,故答案选择C2.【2016年湖北省襄阳市】地壳中含量最多的元素是( )A .AlB .FeC .OD .Si【答案】C【解析】地壳中各元素及含量由多到少的顺序是氧、硅、铝、铁、钙、钠、钾、镁、氢;所以含量最多的元素为氧元素,选项C 正确3.【2016年山东省临沂市】与元素的化学性质关系最密切的是( )A.原子的最外层电子数 B.元素的相对原子质量C.元素的核电荷数 D.原子的核外电子数【答案】A4.【2016年山东省临沂市】某元素原子得到2个电子后形成具有与Ne相同核外电子排布的粒子,下列说法正确的是()A.该粒子为阳离子 B.该粒子原子序数为10C.该粒子可表示为O2﹣D.该元素位于元素周期表第一周期【答案】C【解析】氖的核电荷数是10,根据原子中:核电荷数=质子数=核外电子数,可以知道氖原子核外有10个电子,又由于该元素原子得到2个电子后形成的粒子与Ne有相同的核外电子数,可知该元素的原子核外电子数为8个电子,则其核电荷数也为8。
A、该元素的原子得到2个电子后形成的离子带负电荷,故为阴离子。
B、由分析可知,该粒子原子序数为8;C、由分析可知,该粒子可表示为O2﹣;D、该元素核电荷数为12,核外有3个电子层,位于周期表第三周期;故选:C5.【2016年江苏省苏州市】下列化学用语中,既能表示一种元素,又能表示一种物质的是()A.H2 B.Cu C.CO2 D.HCl【答案】B【解析】元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了三层意义。
A、该符号是氢气的化学式,不是元素符号,故选项不符合题意。
B、Cu属于金属元素,可表示铜元素,还能表示铜这一纯净物,故选项符合题意。
C、该符号是二氧化碳的化学式,不是元素符号,故选项不符合题意。
D、该符号是氯化氢的化学式,不是元素符号,故选项不符合题意。
故选:B6.【2016年江苏省南京市】在元素周期表中硅元素的某些信息如图所示,下列有关硅的说法错误的是()A.属于金属元素 B.元素符号为“Si”C.原子序数为“14” D.相对原子质量为“28.09”【答案】A7.【2016年江苏省南京市】下列粒子结构示意图中,表示阳离子的是()A. B. C. D.【答案】D【解析】A、质子数等于核外电子数为原子,错误;B、质子数小于核外电子数为阴离子,错误;C、质子数小于核外电子数为阴离子,错误;D、质子数大于核外电子数为阳离子,正确;故选D。
8.【2016年湖南省永州市】铈(Ce)是一种常见的稀土元素,已知铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为()A.24 B.58 C.82 D.140【答案】B【解析】在原子中,原子序数=质子数=核电荷数=核外电子数,已知一种铈原子,原子核内有58个质子,因此该铈原子的核外电子数为58。
故选:B。
9.【2016年江苏省连云港市】目前世界上最精准的钟是以锶做钟摆的钟。
锶的原子结构示意图及在元素周期表中某些信息如右图所示,下列说法正确的是()A.x的值为8 B.锶属于非金属元素C.锶的相对原子质量为87.62g D.锶原子的化学反应中易失去电子【答案】D【解析】元素周期表中某方格中的信息:原子序数、元素符号、元素名称、相对原子质量;A、原子中,质子数=核外电子数,故x的值=38-2-2-8-8=18,错误,B、锶的偏旁部首是“金字旁”,属于金属元素,,错误,C、相对原子质量是一个比值,单位不是g,错误,D、锶原子的最外层电子数为2<4,故在化学反应中易失去电子,正确,故选D10.【2016年湖南省邵阳市】下列符号中,既可以表示一种元素,又可以表示一个原子,还可以表示一种物质的是()A.N B.2H C.O2 D.Fe【答案】D11.【2016年广东省】钒被誉为“合金中的维生素”。
钒元素的部分信息如图所示。
请回答下列问题:(1)钒原子的质子数为___________,x=___________。
(2)钒属于___________(填“金属”或“非金属”)元素;钒的相对原子质量为___________。
【答案】(1)23 , 2 (2)金属, 50.94【解析】(1)在原子中,质子数=核电荷数=核外电子数=原子序数,故钒原子的质子数为23,x=23-21=2;(2)由元素的名称可知,钒属于金属元素;元素名称下面的数字表示的是相对原子质量,故钒的相对原子质量为50.94 。
12.【2016年江西省】南昌大学研发的“硅衬底高光效GaN基蓝色发光二极管技术”获得2015年国家技术发明一等奖。
请回答下列问题:(1)右图是镓在元素周期表中的信息以及原子结构示意图。
镓的相对原子质量为;下列原子结构示意图所对应的元素与镓元素的化学性质相似的是(填序号);(2)氮化镓(GaN)中镓元素的化合价为+3价,则氮元素的化合价为价;(3)传统制备氮化镓的化学原理是:GaCl3+NH3一定条件GaN+3X ,其中X的化学式为。
【答案】(1)69.72;B;(2)-3 (3)HCl13.【2016年山东省青岛市】元素的性质与原子结构密切相关。
请填空:(1)氟元素(F)的原子结构示意图如右图所示,据图可判断出x的数值为;氟原子在化学反应中易电子(填“得”或“失”),所以氟元素在化合物中的化合价通常为价。
(2)氢元素与氟元素形成的化合物为氟化氢,其化学式为;常温下,氟气(F2)是一种气体,能与水反应生成氟化氢和氧气,此反应的化学方程式为。
【答案】(1)9 得 -1 (2)HF 2F2+2H2O=4HF+O2【解析】(1)原子内质子数等于核外电子数x=2+7=9 最外层是8个电子的结构是稳定结构,故氟原子容易得到一个电子,使最外层达到8个电子的稳定结构原子得到一个电子则在化合物中该元素的化合价是-1价(2)在化合物中氢元素显+1价,氟元素显-1价,化合物中各元素化合价的代数和为零,故氟化氢的化学式为HF据题意反应物是氟气和水,生成物是氟化氢和氧气,故化学方程式为: 2F2+2H2O=4HF+O2。
