武汉理工大学物理化学期末考试试卷
物化试卷(B)

武汉理工大学考试试题纸(B 卷)备注:学生不得在试题纸上答题(含填空题、选择题等客观题一、单项选择题(1.5分×12题)1.某气体要其液化,则温度、压力必须满足:A.T >T c p >p c B.T >T c p <p c C.T <T c p >p c D.T <T c p <p c2.苯在一个刚性的绝热容器中燃烧,C 6H 6(l)+(15/2)O 2(g)=6CO 2(g)+3H 2O (g),则A.∆U =0,∆H <0,Q =0B.Q =0,∆U =0,∆H =0C.∆U =0,∆H >0,W =0D.Q =0,∆U ≠0,∆H ≠03.对于1mol 理想气体其等于()TVS∂∂A.R B.R /V C.0 D.-R /p4.液态水在25℃,p =23.76mmHg (25℃时水的饱和蒸气压)下蒸发为水蒸气(假定为理想气体)则A.ΔU =0 B.ΔH =0 C.ΔG =0 D.ΔS =05.B 物质在α相中浓度大于在β相中的浓度,当两相接触时:A.B 由α相向β相扩散 B.B 由β相向α相扩散 C.B 在两相中处于扩散平衡 D.无法确定6.放热反应2NO(g)+O 2(g)=2NO 2(g)达平衡后,若分别采取措施,能使平衡向产物方向移动的是:①增加压力;②减少NO 2的分压;③增加O 2分压;④升高温度;⑤加入催化剂A.①②③ B.②③④ C.③④⑤ D.①②⑤7.在下列体系中自由度F =2的体系是:A.298K 时,H 2O(l)、H 2O(g)共存 B.C 2H 5OH(l)与H 2O(l)的混合物C.S(s)、S(l)、S(g)共存 D.PCl 5(g)分解平衡时:PCl 5(g)=PCl 3(g)+Cl 2(g)8.下列电解质溶液的浓度都为0.01mol kg -1。
离子平均活度系数最小的是:A.ZnSO 4 B.CaCl 2 C.KCl D.H 2SO 49.电池Hg |Zn(a 1)|ZnSO 4(a 2)|Zn(a 3)|Hg 的电动势A.仅与a 1,a 3有关,与a 2无关 B.仅与a 1,a 2有关,与a 3无关C.仅与a 2,a 3有关,与a 1无关 D.与a 1,a 2,a 3均无关10.如图在毛细管中有一段液体柱,当毛细管左端加热时,管内液体A.向左移动 B.向右移动 C.不动 D.来回振荡11.今有反应CaCO 3(s)=CaO(s)+CO 2(g)在一定温度下达到平衡,现在不改变温度和CO 2的分压力,也不改变CaO(s)颗粒的大小,只降低CaCO 3(s)颗粒的直径,增加分散度,则平衡将A.向左移动 B.向右移动 C.不发生移动 D.无法判断12.某反应的等容反应的摩尔热力学能变∆U m =100kJ ·mol -1,则该反应的活化能A.必定等于或小于100kJ ·mol -1 B.必定等于或大于100kJ ·mol -1C.可以大于或小于100kJ ·mol -1 D.只能小于100kJ •mol -1课程名称物理化学专业班级题号一二三四五六七八九十总分题分183016131211100二、填空题(2分×15空)1.已知反应2H 2(g)+O 2(g)→2H 2O (l)在298K 时恒容反应热Q V =-564kJ/mol ,则H 2(g)在298K 时的标准摩尔燃烧焓∆c H m =()kJ/mol 。
大学化学专业《大学物理(上册)》期末考试试卷 含答案

大学化学专业《大学物理(上册)》期末考试试卷含答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、反映电磁场基本性质和规律的积分形式的麦克斯韦方程组为:()。
①②③④试判断下列结论是包含于或等效于哪一个麦克斯韦方程式的.将你确定的方程式用代号填在相应结论后的空白处。
(1) 变化的磁场一定伴随有电场;__________________(2) 磁感线是无头无尾的;________________________(3) 电荷总伴随有电场.__________________________2、动量定理的内容是__________,其数学表达式可写__________,动量守恒的条件是__________。
3、一个半径为、面密度为的均匀带电圆盘,以角速度绕过圆心且垂直盘面的轴线旋转;今将其放入磁感应强度为的均匀外磁场中,的方向垂直于轴线。
在距盘心为处取一宽度为的圆环,则该带电圆环相当的电流为________,该电流所受磁力矩的大小为________ ,圆________盘所受合力矩的大小为________。
4、图示曲线为处于同一温度T时氦(原子量4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
其中曲线(a)是________气分子的速率分布曲线;曲线(c)是________气分子的速率分布曲线。
5、质量为M的物体A静止于水平面上,它与平面之间的滑动摩擦系数为μ,另一质量为的小球B以沿水平方向向右的速度与物体A发生完全非弹性碰撞.则碰后它们在水平方向滑过的距离L=__________。
6、一质点作半径为0.1m的圆周运动,其角位置的运动学方程为:,则其切向加速度大小为=__________第1秒末法向加速度的大小为=__________。
物理化学期末考试试题库 (附答案与解析)

第一章热力学第一定律选择题1.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
2.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
3.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
4.下面的说法符合热力学第一定律的是()(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关(C)封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关答案:C。
因绝热时ΔU=Q+W=W。
(A)中无热交换、无体积功故ΔU=Q+W=0。
(B)在无功过程中ΔU=Q,说明始末态相同热有定值,并不说明内能的变化与过程有关。
(D)中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。
这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。
5.关于节流膨胀, 下列说法正确的是(A)节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔塞两边的压力不断变化答案:B6.在实际气体的节流膨胀过程中,哪一组描述是正确的:(A)Q >0, H=0, p < 0 (B)Q=0, H <0, p >0 (C)Q=0, H =0, p <0 (D)Q <0, H =0, p <0答案:C。
(完整版)各大高校物理化学期末考试试题及答案合集考试必备突击必取,推荐文档

5 倍,压力与外压相同,计算此过程的 Q、W、ΔU、ΔH、ΔS、ΔA 及 ΔG。(已知理想 气体的定容摩尔热容为 12.471J.mol-1.K-1)(12 分)
4. 某药物分解 30%即为失效。若放置在 3℃的冰箱中保存期为两年,某人购回此新药 物,因故在室温(25℃)下搁置了两周,试通过计算说明此药物是否已经失效?已知该药物分 解为一级反应,且分解活化能 Ea 为 130.0 kJ. mol-1。(12 分)
C. S(气)=S(液)=S(固) D. S(液)>S(气)>S(固)
8. 101325Pa,373.15K 下,水蒸发为水气,这过程系统哪一种热力学函数变化为零。 ______________ 。
A. ΔU B ΔH
C ΔS
D ΔG
9. 温度T时某一级反应A--→B,为了使A的浓度改变1/5, 需时4s, 则反应的半衰期为
2. 液固相图的实验测定方法通常有(蒸气压法、热分析法)______________和(测折
光率法、测溶解度法)______________ 。(2分)
3. ΔG作为过程方向与限度判据的条件是(
)。(2分)
4. 在温度为T时反应C(s)+O2 (g) = CO2(g)、C(s)+(1/2)O2 (g) = CO(g) 的平衡常数分别为
kA>kB,则当 A 和 B 压力相同时,在该溶剂中所溶解的量是( )
A. A 的量大于 B 的量
B. A 的量小于 B 的量
C. A 的量等于 B 的量
C. A 的量与 B 的量无法比较
5. NH4HS(s) 和任意量的 NH3(g) 及 H2S(g) 达平衡时有( )
物理化学(全一册)期末试卷(A)

)
) ) )
4. 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。 ( 5. 理想稀溶液中的溶剂遵从亨利定律,而溶质遵从拉乌尔定律。 ( 6. 等温等压条件下,电池反应的 r H m 不等于其反应热 QP。 ( 7. 反应速率常数 k 与反应物的浓度有关。 ( ) 8. 温度升高,液体的表面张力增大。 ( ) 9. 电解质溶液浓度越大,其摩尔电导率越小。 ( 10.克拉珀龙方程适用纯物质的任何两相平衡。 ( 二、选择题(10 分) 1.理想气体定温自由膨胀过程为( ) )
3
B T (K )
)
的 HAc 溶液的 Λ m 为 5 .2 0 1 1 0 S m m o l ,求 HAc 在该浓度下
2
4
1
的电离度 及电离平衡常数 K 。已知 H 离子和 A c 离子的 m 分别为 3 4 9 .8 2 1 0 S m m o l 和
2
-1
3.已知某一级反应 A=B+C, A 的初始浓度减少一半时,须花 120s,则该反应的速率常数为( ) 。 4.空气中漂浮一肥皂泡,其内外压之差等于( ) 。 5.某一液体不能润湿玻璃,当用一玻璃毛细管插入该液体时,毛细管中液体呈( )面。 四.计算题(40 分) 3 3 3 1.3mol 单原子理想气体从始态 100kPa,75dm 先恒温可逆压缩使体积缩小至 50dm ,再恒压加热至 100dm , 求整个过程的 Q,W,△U,△H 和△S。 分) (10 2.已知水在 77℃时的饱和蒸气压为 41.891kPa,水在 101.325kPa 下的正常沸点为 100℃,求 (1)表示水的蒸气压与温度关系的方程式中 A 和 B 的值。 ln ( p / P a )= A ( (2)水的摩尔蒸发焓。 (假定在一定温度范围为一常数) (10 分) 3.25℃时测得浓度为 0 .1 0 0 0 m o l d m
武汉理工大学2013-2014(2)物理化学C(A)卷
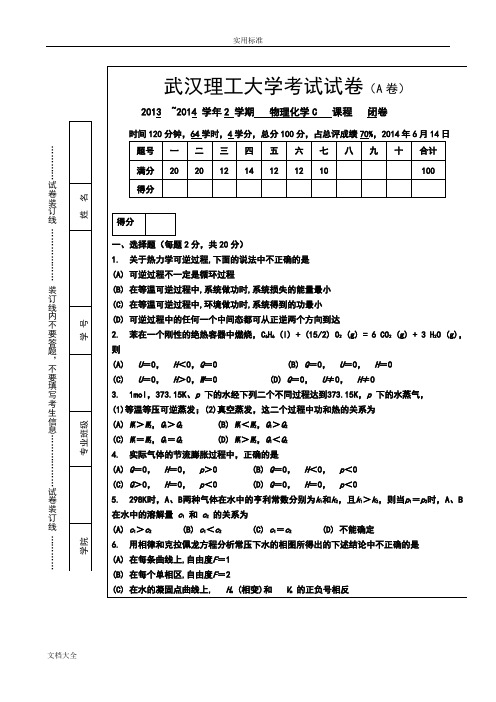
…………试卷装订线………………装订线内不要答题,不要填写考生信息………………试卷装订线…………武汉理工大学考试试卷(A卷)2013 ~2014 学年2 学期物理化学C 课程闭卷时间120分钟,64学时,4学分,总分100分,占总评成绩70%,2014年6月14日题号一二三四五六七八九十合计满分20 20 12 14 12 12 10 100得分得分一、选择题(每题2分,共20分)1. 关于热力学可逆过程,下面的说法中不正确的是(A) 可逆过程不一定是循环过程(B) 在等温可逆过程中,系统做功时,系统损失的能量最小(C) 在等温可逆过程中,环境做功时,系统得到的功最小(D) 可逆过程中的任何一个中间态都可从正逆两个方向到达2. 苯在一个刚性的绝热容器中燃烧,C6H6 (l) + (15/2) O2 (g) = 6 CO2 (g) + 3 H2O (g),则(A) U=0,H<0,Q=0 (B) Q=0,U=0,H=0(C) U=0,H>0,W=0 (D) Q=0,U≠0,H≠03. 1mol,373.15K、p下的水经下列二个不同过程达到373.15K,p下的水蒸气,(1)等温等压可逆蒸发;(2)真空蒸发,这二个过程中功和热的关系为(A) W1>W2,Q1>Q2 (B) W1<W2,Q1>Q2(C) W1=W2,Q1=Q2(D) W1>W2,Q1<Q24. 实际气体的节流膨胀过程中,正确的是(A) Q=0,H=0,p>0 (B) Q=0,H<0,p<0(C) Q>0,H=0,p<0 (D) Q=0,H=0,p<05. 298K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当p1=p2时,A、B 在水中的溶解量c1和c2的关系为(A) c1>c2(B) c1<c2(C) c1=c2(D) 不能确定6. 用相律和克拉佩龙方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上,自由度F=1(B) 在每个单相区,自由度F=2(C) 在水的凝固点曲线上, H m (相变)和V m的正负号相反7. 为求AgCl 的活度积,应设计电池为: (A) Ag , AgCl | HCl (aq) | Cl 2 (p ) | Pt (B) Pt | Cl 2 (p ) | HCl (aq) ¦¦ AgNO 3 (aq) | Ag(C) Ag | AgNO 3 (aq) ¦¦ HCl (aq) | AgCl , Ag(D) Ag , AgCl | HCl (aq) |AgCl , Ag8. 一根毛细管插入水中,液面上升的高度为 h ,当在水中加入少量的 NaCl ,这时毛细管中液面的高度为: (A) 等于h (B) 大于h (C) 小于h (D) 无法确定 9. 某反应的反应物消耗掉3/4的时间是其半衰期的2倍,则该反应的级数为 (A) 零级(B) 一级(C) 二级(D) 三级10. 对ζ 电势的阐述,正确的是:(A) ζ 电势与溶剂化层中离子浓度有关 (B) ζ 电势在无外电场作用下也可表示出来 (C) | ζ |电势越大,溶胶越不稳定 (D) | ζ |电势越大,扩散层中反号离子越少答案:题号 1 2 3 4 5 6 7 8 9 10 答案得分二、填空题(每空2分,共20分) 1. 已知H 2 (g)在298K 时的标准摩尔燃烧焓 cH m =-285.8 kJ/mol , 则反应2 H 2 (g) + O 2 (g) → 2 H 2O (l) 在298K 时恒容反应热 Q V =( )kJ/mol 。
武汉理工大学物理化学下-期末考试试卷(1)
武汉理工大学考试试题纸( A 卷)课程名称:物理化学A4(下) 专业班级:题号 一 二 三 四 五 六 七 八 九 十 总分 题分 342012141010100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一、填空题(每空2分,共34分)1.已知298K 时,∞m λ(HCl)= 0.042615S •m 2•mol -1,∞m λ(NaAc) = 0.009101 S •m 2•mol -1,∞m λ(NaCl)= 0.012645 S •m 2•mol -1,则∞m λ(HAc) = S •m 2•mol -1;在此温度测得50mol •m -3的HAc 的电导率为3.68×10-2 S •m -1,则该溶液的摩尔电导率m λ= S •m 2•mol -1,解离度α= 。
2.已知CO 分子的转动惯量I = 1.449×10-46kg •m 2,振动频率ν= 65.05×1012s -1,普朗克常数h = 6.626×10-34 J •s ,玻尔兹曼常数k = 1.38×10-23 J •K -1,则CO 分子的转动特征温度r Θ= K ,振动特征温度v Θ= K 。
3.在体积为V 的立方容器中有极大数目的三维平动子,其平动能级的能量与三个平动量子数的关系为kT n n n z y x )(1.0222t ++=ε,则该系统在平衡时,17)(222=++z y x n n n 时平动能级的简并度为 ,该能级上粒子的分布数与基态能级上粒子的分布数之比0/n n 为 。
4.物理吸附的吸附力是 ,吸附分子层是 层。
5.溶液的表面张力随溶质的浓度增加而增加,则溶液的表面吸附使得溶质的在表面层的浓度c B (表面)与溶质的在本体的浓度c B (本体)的关系为c B (表面) c B (本体)。
(选填 “>”,“<”,“=”)6.恒温下,微小晶体的溶解度 普通晶体的溶解度。
武汉理工大学物理化学下 期末考试试卷
武汉理工大学考试试题纸( A 卷)课程名称 物理化学( 下) 专业班级题号 一 二三 四 五 六 七 八 九 十 总分 题分12 4012121212100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一.选择题(12分,每题2分)1. 如图:, 在毛细管中装入水,如果在左端加热, 毛细管中的水将( )A. 保持不变B. 向左移动C. 来回移动D. 向右移动2. 将2 滴 K 2[Fe(CN)4]水溶液滴入过量的CuCl 2水溶液中形成亚铁氰化铜正溶液,下列三种电解质聚沉值最大的是A. KBrB. K 2SO 4C. K 4[Fe(CN)6] D . Na 3PO 43. 298K 时,电池反应H 2(g) +21O 2(g) ===H 2O(l) 所对应的电池标准电动势E 1,反应 2 H 2O(l) === 2 H 2(g) + O 2(g) 所对应的电池标准电动势E 2,E 1和E 2的关系为 A. E 2= -2 E 1 B. E 2=2 E 1 C. E 2= - E 1 D. E 2= E 14. 在统计热力学中,若按组成子能否被分辨来对系统分类,那么A. 气体与晶体均属定域子系统B. 气体与晶体均属离域子系统C. 气体属定域子系统,而晶体属离域子系统D.气体属离域子系统,而晶体属定域子系统5. 一定量纯理想气体等温变压时,在分子运动的各配分函数中与压力有关的是: A. 电子运动的配分函数 B. 平动配分函数 C. 转动配分函数 D. 振动配分函数6. 对于任意给定的化学反应A +B −→−2Y ,则在动力学研究中:( )A. 表明它为二级反应B. 表明了它是双分子反应C. 表明了反应物与产物分子间的计量关系D. 表明它为基元反应二.填空题(40分,每空2分)1. 含有0.3 mol ·kg -1KNO 3及0.2 mol ·kg-1的K 2SO 4水溶液的离子强度I =⎽⎽⎽⎽⎽⎽⎽⎽。
武汉理工大学期末考试试卷-大学物理
武汉理工大学期末考试试卷2019-2020学年 1 学期 大学物理B 期末 闭卷一、 选择题(把正确的选项填入括号中,每题3分,共27分)1.如图所示一轻绳跨过一个定滑轮两端个系一质量分布为12,m m ,且12,m m >滑轮质量及轴上摩擦均不计,此时重物的加速度大小为a ,现在用一竖直向下的恒力f,代替质量为m1的物体可得质量为m2的物体的加速度为a1()())()()111 A a a B a a C a a D =><不能确定2.在狭义相对论中,下列说法正确的是()(1) 一切运动物体相对于观察者的速度都不能大于真空中的光速(2) 质量,长度时间的测量都是随物体与观察者的相对运动状态而改变的 (3)同时发生的(4) 一正方形相对于某惯性系S 沿一边长方向运动,则静止在S 系中的观察者测的面积减小(A )1,2,4 (B)1,3,4 (C )1,2,3 (D)2,3,4 3.如图半径为r 的金属球与地连接,在与星球相距为d=2R 处一电量为q 的点电荷,设地面电势为0,则球上的感应电荷为多少()(A )0 (B)q/2 (C)-q/2 (D)-q4.在一固定的无限长载流直导线的旁边放置一个可以自由移动和转动的圆形钢性线圈,线圈中通有电流如图,若线圈平面与直导线垂直,直导线电流垂直纸面流出,则圆线圈将()A .转动,同时靠近导线 B. 转动,同时离开导线C.不转动,只靠近导线D. 不转动,只离开导线强度(设电场强度方向向右为正,向左为负)随位置坐标变化的关系曲线()6.如图,有两个半径相同的圆形回路12,L L ,圆周内有电流12,I I 其分布相同,且均在真空中,但图中2L 回路外有电流2I 12,P P 分布为两回路对应的点则()()()()()1212121212121212,,,,p p L L p p L L p p L L p p L L A B dl B dl B B B B dl B dl B B C B dl B dl B B D B dl B dl B B ==≠==≠≠≠⎰⎰⎰⎰⎰⎰⎰⎰7.已知基态氢原子的能量为电子的轨道半径将增加到波尔半径的几倍() A .3 B.6 C.9 D.128.绝对黑体是这样一种物体()A .不能吸收,也不能发射任何电磁辐射B .不能反射,也不能发射任何电磁辐射 C. 不能发射,但能全部吸收任何电磁辐射 D. 不能反射,但能全部吸收任何电磁辐射9.静止质量不为0的微观粒子做高速运动,这时粒子物质波的波长与速度()1. . ..A v B C D v λλλλ∝∝∝∝二、填空题(每题3分,共24分)1.一物体运动的22ct S bt =−式中b 为大于0的常数,且2b Rc <当切向加速度与法向加速度相同时,t 为_________.2.已知一个质量为m 的质点,所受摩擦力f 与运动距离平方分之一成k 倍关系设质点在x=A 处速度为0,则在x=A/2处速度为_____________.3.人双手张开,坐在转动旋转椅上,当人的手臂由外向内收拢时,系统的转动惯量_________(填增大或减小),转椅的角速度___________(填增大或减小).4.如图所示,有一圆环环上有一微小的缺口,缺口的宽度远小于圆环的半径,环上均匀带正电总电量为q ,如图所示圆心o 处的电场强度大小为______,场强方向为________.5.将以空气平行板电容器充电到两极板电势差为U 后与电源断开,现在两极板间平行的面插入一块与极板面相同的铜板,则电容器的电容会_________(填增大,减小或不变),板间电场能量________(填增大,减小或不变).6.如图所示,一个小型圆形线圈A 有1N 匝横截面积为S ,将此线圈放在另一个半径为R (R 远大于小圆半径),匝数为2N 的圆形大型线圈B 中心,两者同轴共面,则此二线圈的互感系数为________.7.在散射实验中,若散射光波长是入射光波长的1.2倍,则散射光子能量ε_______.8.3()2xa x a a πφ=−≤≤,则23x a =时的概率密度为____________.三、计算题(共5题,共49分)1.如图所示,一长为2L 的均质细棒可绕棒中点的水平轴o 在竖直面内转动,开始时静止在水平位置,质量为m 的小球,以速度V 垂直下落在棒的端点,设小球与棒做弹性碰撞,棒的质量为小球的9倍,求碰撞后小球的反弹速度及棒的转动角速度各为多少?(已知质量为m ,长度为L 的匀质细棒对通过其中心且与棒垂直的转轴的转动惯量为2112J ML =)测者发现有两个闪电同时击中火车的前后端,问火车上观测者测得闪电击中火车前后的时间间隔是多少?(2)已知静止质量为0m 的粒子,其固有寿命为实验室测得寿命的1/n ,此粒子动能为多少?r有点电荷求:(1)空间电场强度分布 (2)当22QA aπ=时,r=a 处的电势(以无穷远处为电势零点)速度匀速转动,o在AB延长线上,求o点磁感应强度大小5.端点的连线与长直导线垂直半圆环的半径为R,圆心o与导线相距为d,设半圆环高低。
物理化学期末考试习题及答案.doc
(B)>, <(D)>, =(A)33.83kJ mol (B)50.81kJ mol (C)-38.83kJ mol (D)-50.81kJ mo0.015K, 已知水的凝固点降(B) 150g m·ol-1(D)200g ·m ol-1NH HCO (s) =NH (g) + CO (g) + H O(g)(B) A 内压力大于 B 内压力(C) B 内压力大于 A 内压力15. 理想气体反应平衡常数K 与K 的关系是∶(C) K x= K c(RT/p ) (D) K x= k c (V/16. 根据某一反应的G 值,下列何者不能确定?(C)在标准状态下系统所能做的最大非膨胀功(D)提高温度与反应速率的变化趋势17. 理想气体CO(g)+2H2 = CH3OH(g)的G 与温度T 的关系G = -21330+52.92T,若要使反应的平衡常数K >1,则应控制的反应温度:(A)必须低于409.3(C)必须低于409.3K18. PCl5 的分解反应是PCl (g) PCl ( g) Cl ( g) ,在473K 达到平衡时,PCl5-(1) lim a (2) lim a_________ ,自由度数为____ ;在25℃时测得体系达到平衡时的压力为66.66 kPa,若此温度时NH3 的分压为13.33 kPa;要使NH3 和H2S 的混合气体系统中不形成NH HS 固体,则应将H S 的分压控制在知此反应在617℃时的平衡常数K = 0.278。
(2) 欲使10 g A g2S 全部被H2 还原,试问最少需要617℃,1.013×10 Pa知识改变命运19. k B/ p B, k B/ p B23 [答] (1) μ(E)-μ(F)=RTln[p (E)/p (F)]W f,max=△G=n△μ=-5.38kJ(2) 物质B 在溶解前后化学势的变化为μ+RTln[p /p ]- μ= RTln[p /p ]W =△G=n△μ=-16.47kJ25. [答] (1)K = x(H2S)/[1-x(H2S)] = 0.278V = nRT/p = 1.356 1 0×m26. Δr G = (-166 732 + 63.01×873.2) Jm·ol = -111 22 Jmol·。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武汉理工大学考试试题纸( A 卷)课程名称 物 理 化 学 (上) 专业班级 题号 一 二 三 四 五 六 七 八 九 十 总分 题分 263010121012100备注: 学生不得在试题纸上答题(含填空题、选择题等客观题)一、填空题(26分,每空2分)1.已知水在25~100℃之间平均恒压摩尔热容为75.48 J·K -1·mol -1,则在101.3kPa 下,将1kg 水从25℃加热至100℃所需的热为 。
2.某一温度下,反应C(s) + O 2 (g) == CO 2 (g) 的标准平衡常数为K 1,反应 CO (g) + 1/2O 2 (g) == CO 2 ( g) 的标准平衡常数为K 2,则同样温度下反应 2C (s) + O 2 (g ) == 2CO (g) 的标准平衡常数K 3与K 1和K 2的关系是K 3=⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
3.450 ︒C 时,将NH 3(g)与N 2(g)混合,由于NH 3(g)的分解,最终得到NH 3(g)、N 2(g)和H 2(g)平衡共存的系统,求该系统的组分数C = ,自由数F =______。
4.克劳修斯不等式的形式是 ;其大于号适用于 过程。
5.对组成不变的均相封闭系统,(∂S /∂p )T = ;对理想气体,(∂S /∂p )T = 。
6.Cd(s)的蒸气压与温度的关系为:lg(p /Pa) =5693K /T -6.439,Cd(l)的蒸气压与温度的关系为:lg(p /Pa) = 5218K /T -5.772,则Cd 的三相点的温度为 ,压力为_______Pa 。
7.如果在溶剂A 中加入少量非挥发性溶质B 组成溶液,溶液凝固时析出的固体A 中也溶解有B ,则该液态溶液的蒸气压将比纯A 液体的蒸气压_________,沸点 ,凝固点___________。
(填“升高”、“降低”、“不变”)二、选择填空题(30分,每题2分)1.反应PCl 5(g) == PCl 3(g) + Cl 2(g)在473 K 时的离解度为48.5%,而573 K 时的离解度为97 %,则可判断为 A.平衡常数K =2 B.两温度的平衡常数K 相等 C.反应是放热的 D.反应是吸热的3.由A 及B 双组分构成的α和β两相系统,则在一定T ,p 下物质A 由α相自发向β相转移的条件为 A.βA A μμα>B.βA A μμα<C.βαμμA A =D. βαμμB A =3.理想气体等温自由膨胀过程的A.Q > 0B.∆U < 0C.W < 0D.∆H = 0 4.对于只作膨胀功的封闭系统(∂A /∂T )V 的值是 A.大于零 B.小于零 C.等于零 D.不能确定5.在温度为T 时,纯液体组分A 和B 的饱和蒸气压分别为p A *和p B *,且p B *=3 p A *,若组分A 和B形成理想液态混合物,当气液两相平衡时,气相中组分A 和B 的物质的量相等。
则组分A 和B 在液相中的摩尔分数各应是 A.x A =0.5 B.x A =3/4 C.x A =1/4 D.不能确定6.指出关于亨利定律的下列几点说明中,错误的是 A.溶质在气相和在溶剂中的分子状态必须相同 B.溶质必须是非挥发性溶质 C.溶液愈稀,亨利定律愈准确 D.对于混合气体,亨利定律能分别适用于每一种气体 7.等压反应热Q p = ∆H 是指W’= 0,且满足 时,系统与环境交换的热 A.p 2 = p 1 = 定值 B.p (外) = 定值 C.p = p (外) D.p 2 = p 1 = p (外) = 定值 8.若某实际气体的体积小于同温同压同量的理想气体的体积,则其压缩因子Z 应为 A.等于零 B.等于1 C.小于1 D.大于1 9.pV γ = 常数(γ = C p,m /C V ,m )适用的条件是 A.绝热过程 B.理想气体绝热过程 C.理想气体绝热可逆过程 D.绝热可逆过程 10.下列反应的焓变不符合标准摩尔生成焓定义的是A. 3/2H 2(g,p ) +1/2N 2(g,p ) = NH 3(g,p )B. 1/2H 2(g,p ) +1/2Br 2(g,p ) = HBr(g,p )C. 1/2N 2(g,p ) + O 2(g,p ) = NO 2(g,p )D.Na(s,p ) + 1/2Cl 2(g,p ) = NaCl(s,p ) 11.根据克拉佩龙方程随着压力的增大,则H 2O(l)的凝固点将 。
A . 上升 B . 下降 C . 不变 D . 不能确定。
12.实际气体处于下列哪种情况时,其行为与理想气体相近 A.高温高压 B.高温低压 C.低温高压 D.低温低压 13.若气体能借增大压力而被液化,则其对比温度T r 必为 。
A.任意值 B.T r = 1 C.T r ≥1 D.T r ≤1 14.下列说法中正确是A.理想气体等温过程,∆T = 0,故Q = 0B.理想气体等压过程,0=U ∆C.理想气体等容过程,∆H C T p =⎰dD.理想气体绝热过程,pV γ = 常数15.已知气体A 的状态方程式为p (V - nb ) = n R T ,其中b 为常数,若该气体恒温从p 1、V 1膨胀到p 2、V 2,则过程的焓变为 。
A. ∆H = 0 B. ∆H = n R T ln(p 1/p 2) C.∆H =nb (V 2-V 1) D.∆H =nb (p 2-p 1)三、在25℃时,正丁醇的蒸发焓为42.60 kJ •mol -1,正丁醇的蒸气压为953.2Pa ,问若将1 mol 25℃、953.2Pa 的液态正丁醇在25℃下转变为101.3 Pa 的蒸气其熵变为多少?设正丁醇蒸气服从理想气体行为。
(10分)四、将1mol 理想气体在300K 、0.5MPa 下经过下列两个过程恒温膨胀至0.1MPa ,分别计算各过程的W 、Q 、ΔU 、ΔH 、ΔS 、ΔA 及ΔG 。
(12分) (1)可逆过程(2)恒外压(外压为0.1MPa )过程 五、反应 3 CuCl(g) === Cu 3Cl 3(g) 的m r G ∆与T 的关系如下:(10分)m r G ∆/( J·mol -1) = - 528858 - 52.34(T / K)lg(T / K) + 438.2(T / K)求:(1) 2000K 时。
此反应的 m r H ∆、m r S ∆。
(2) 此反应在2000K ,100kPa 下平衡混合物中Cu 3Cl 3的摩尔分数。
(后面还有题)六、某二元凝聚相图如图所示,请回答:(12分)⑴填写下表;相区编号 1 2 3 4稳定相相区编号 5 6 7 8稳定相⑵用式子分别表示出三相线MN、KL线上所进行的过程;⑶作熔体x的冷却曲线。
武汉理工大学教务处试题标准答案及评分标准用纸课程名称: 物理化学(上)一、填空题(26分,每空2分)1.314.5 kJ 2.(K 1/ K 2)2 3.2,2 4.d S ≥δQT 环,不可逆 5.PT V ⎪⎭⎫⎝⎛-∂∂,-nRp6.712.1,35.87.降低,升高,或降低或升高二、选择填空题(30分,每题2分)1.D 2.A 3.D 4.B 5.B 6.B 7.D8.C9。
C10。
B11.B 12.B13.D14.C15.D三、(10分)解:按题意所求的∆S 可设计下列过程来计算。
先恒温蒸发为25℃的饱和蒸气,再等温膨胀为101.3Pa 蒸气。
∆S∆S 1 ∆S 2 (4分)∆∆∆∆S S S n H TnR p p =+=+1212vap mln(4分) ∆S =+=+=---(..ln ..)(..).42600298283149532101314291861615111J K J K J K ··· (2分) 四、(12分)解:(1)ΔU = ΔH = 0W =-nRT ln(p 1/p 2) = -4014.3J Q =-W =4014.3JΔS = nR ln(p 1/p 2) = 13.4J/KΔA = ΔG = -T ΔS = -4014.3J (7分) (2)W =-p e ΔV = -1995.4J (1分)Q =-W =1995.4J (1分)1 mol 正丁醇( g ) 101.3 Pa 25℃ 1 mol 正丁醇( l )953.2 Pa 25℃1 mol 正丁醇( g )953.2 Pa 25℃ΔU = ΔH = 0 (1分) ΔS = nR ln(p 1/p 2) = 13.4J/K (1分)ΔA = ΔG =-T ΔS =-4014.3J (1分)五、(10分)(1)∵m r pm r S T G ∆-=⎪⎪⎭⎫ ⎝⎛∂∆∂ (2分)m r S ∆(2000K) = -(-22.73 – 22.73ln T + 438.2) = - 242.7 J·mol -1·K -1 (2分) m r G ∆(2000K) = - 528858 – 52.34×2000lg2000 + 438.2×2000 = 1.99 kJ·mol -1 m r H ∆(2000K) = m r G ∆(2000K) + T m r S ∆(2000K) = - 483.41 kJ·mol -1 (2分)(2) K (2000K) = exp (- 1990/(8.314×2000)) = 0.887 (2分)3 CuCl(g) === Cu 3Cl 3(g)x 1 - x(1 – x )/x 3 ×(100/100)-2 = 0.8871 – x = 0.302 (2分)六、(12分)解:⑴相区编号 1 2 34 稳定相 l l+α(s) α(s)l+β(s) 相区编号 5 6 78 稳定相l+D(s) β(s)α (s)+ D(s)β(s)+D(s)(4分)⑵MN 线:α(s)+ D(s) → l (加热) 或 l → α(s)+ D(s) (冷却) KL 线:D(s) →β(s) + l (加热) 或 β(s) + l → D(s) (冷却)(4分)⑶(4分)。
