高考有机化学信息题中常给予的陌生信息
浅谈格氏反应与高考命题

浅谈格氏反应与高考命题作者:王永森来源:《化学教学》2014年第02期在高考的有机试题中,往往给出一定的陌生信息,以期考查学生的学习潜力。
而竞赛的要求较高,高考中给定的某些信息反倒成了已知而不再呈现。
纵观近些年的高考试题,格氏反应作为信息反复出现,如2006年的重庆理综、2012年的天津理综和2013年的江苏化学。
格氏试剂在苏教版教材《有机化学基础》中作为“拓展视野”的栏目予以介绍:“它是由法国化学家格利雅于1901年发现的。
通过卤代烃与镁(用醚作溶剂)作用得到烃基卤化镁(RMgX,也称为格氏试剂),烃基卤化镁与其他物质(如卤代烃、醛、二氧化碳等)反应可以实现碳链的增长,得到烃、醇、羧酸、酮、胺等多种有机化合物。
[1]”1 格氏试剂与格氏反应简介1.1 格氏试剂格氏试剂通常是用有机卤素衍生物(卤代烷、活泼卤代芳烃等,其中溴代烷用得最多)与金属镁在绝对乙醚(absolute ether or dry ether)存在下作用而成。
反应方程式如下:(实验中常用一小粒碘和温水浴引发)乙醚(也可四氢呋喃)不仅是生成的有机镁化合物的溶剂,同时也和RMgX结合成络合物,结构如图1。
C-Mg键为共价键,Mg-X键基本上是离子键,即:R-Mg+X-。
C-Mg键的成键原子的电负性不同,C为2.50,Mg为1.23,C的电负性大于Mg,导致成键电子富集于C一方,起碳负离子的作用,使得烃基带部分负电荷,Mg带部分正电荷,C-Mg键是强极性键,即:1.2 格氏反应通常把格氏试剂和醛、酮、酯的加成反应叫做格氏反应,烷基锂也能进行此反应[3]。
格氏试剂的发明将有机合成技术向前推进了一大步,用它可以增长碳链。
它不仅可以用于合成烃类、醇类、醛类和酮类,还可以用于合成羧酸、硫醇、亚磺酸以及金属有机化合物等,如在苏教版教材《有机化学基础》中,还例举了格式试剂在有机合成中的应用[4]:2 醇在高中化学的重要地位在有机化学中,醇是烃的含氧衍生物的开篇,是有机合成中应用极广的一类化合物,不仅用作溶剂,其中的羟基还是有机合成中关键的官能团,它可转变为别的官能团的各族化合物。
有机合成路线总结-学案

《有机合成路线》总结有机合成路线包括官能团的引入、官能团的保护、碳链的增长、碳链的缩短等,它涵盖了有1.官能团的引入:包括引入C=C双键、C≡C叁键、卤素(-X)、羟基(-OH)、醛基(-CHO)、羧基(-COOH)、酯基等。
(1)引入C=C双键醇的消去,如丙醇的消去:。
卤代烃的消去,如溴乙烷的消去:。
炔烃的不完全加成,如乙炔与氯化氢加成:。
(2)引入C≡C叁键邻二醇的消去,如乙二醇的消去:。
邻二卤代烃的消去,如二溴乙烷的消去:。
邻卤代烯烃的消去,如氯乙烯的消去:。
(3)引入卤素(X)烯烃与或的加成:。
苯的取代,如苯的溴代:。
苯的同系物的取代,如甲苯的氯代:。
注意:一般不用烷烃的取代反应来引入卤素原子,因为_________________________________。
(4)引入羟基(-OH)卤代烃的水解,如溴乙烷的水解:。
醛的加成,如乙醛的加成:。
烯烃与水的加成,如乙烯的水化:。
酯的水解,如乙酸乙酯的水解:。
⑤羰基的加成,如丙酮的加成:。
(5)引入醛基(-CHO),如R-CH2OH的氧化:________________________________________。
(6)引入羧基(-COOH)醛的氧化,如丙醛氧化为丙酸:。
酯的水解,如的水解:。
(7)引入酯基:________________________________________。
2.有机合成的原则:(1)合成路线中出现的反应要是书本学过的反应,不能使用考纲外的竞赛知识,更不能臆造不存在的反应。
值得说明的是,有机合成题中给出的陌生的有机反应,在合成路线中往往要运用。
(2)有机合成产物尽可能要有专一选择性,避免产物多样化。
(3)有机合成路线的评价可从科学性(不违反科学规律)、安全性(避免高温高压等反应条件,试剂低毒或无毒)、可行性(操作简单,易于实现),经济性(原料价廉易得,反应能耗低)、环保性(产物无污染)等五个角度评述。
3.有机合成路线常用的表示方式为:A B ∙∙∙∙∙∙目标产物,书写时应注意:(1)尽量选择步骤少的合成路线,高考化学有机合成路线一般为3到5步(2)合成路线中的反应试剂和反应条件要书写明确,不能含糊不清。
高三化学专题复习05陌生信息图像图表题审题与答题思路

高三化学专题复习05·陌生信息图像图表题审题与答题思路 2019-5 一.陌生信息图像图表题高考方向,特点及对策(一)特点从近三年Ⅱ卷对图像的考查看,体现出以下几个特点:1.稳定。
几乎是每年都会出现,特别是温度、时间—产率(转化率)出现频率比较高。
虽然2018年的Ⅰ卷中没出现图像,但在28题中给出了分压与时间的表格,其难度也比较大。
2.创新。
除了常见的图像。
2016年的n(氨)/n(丙烯)—产率;2017年的n(H2)/n(丁烷)—丁烯产率;2018年的温度—积碳量、时间—积碳量,每年都会出现一个新的坐标物理量。
所以掌握图像的数学意义,冷静分析图像蕴藏的化学、物理过程,才可遇变不惊,妥善应答。
(二)方向通过图像图表描述试题信息是高考化学常用的考查方式,在Ⅱ卷中以速率、平衡图像为主,兼顾溶液中,来源常采用生活,化工,科技等实用的问题,打破传统的图像模式,反应体系不再局限于气体间的反应,开始增加溶液中反应的图像。
横纵坐标也不再局限于时间、温度、压强、速率、转化率等常见的物理量,开始引入更多的变量,如物质的量之比、气体分压的负对数等来增加新颖度、陌生度,属于高区分度试题。
这类试题对考生的数理逻辑思维判断有较高的要求。
但任何图像都是函数关系的形象化表达,不管图像的形式多么怪异复杂,最终所表达的还是两个变量的关系。
(三)类型及对策【I】坐标图的特点及解题策略解答时要求首先弄清楚自变量和因变量各代表什么样的化学量,然后根据化学知识分析概念———图象———数量三者之间的关系。
具体步骤可以概括为“一明标”,“二析点”,“三识线”1.首先明确横纵坐标的含义2.在上述基础上分析出图像中起点、终点、拐点的意义,这些往往代表一个反应阶段的结束或条件的改变。
分清直线(水平段居多)、曲线的变化(上升、下降、平缓、转折等),同时对走势有转折变化的曲线,要分段分析,找出各段曲线的变化趋势及其含义,每一段可能发生了不同的反应。
高考高中有机化学中常考的八大问题总结

高考高中有机化学中常考的八大问题总结1、HBr的水溶液密度小于乙醇溶液吗?答:乙醇的密度小于水,而溴水密度大于水(溴单质分子量160),所以HBr的水溶液密度大于乙醇溶液。
另外,高中阶段有两种物质密度比水小,乙醇及其溶液,氨水,且这两种溶液是浓度越大,密度越小。
2、溴苯溶于水吗?答:溴苯不溶于水,与水混合能够分层,但溴苯不是沉淀,是无色油状液体,密度比水大,在水的下层。
高中有机中学到苯与液溴反应后的产物倒入水中,在水底有褐色油状液体,即溶解了溴单质的溴苯,可用氢氧化钠溶液除去其中的溴单质,得到纯净的溴苯。
3、乙醇与溴水反应吗?答:不反应,现象为不褪色,不分层。
常见于物质鉴别的题目。
4、什么叫有机物的氧化?答:有机物在发生反应时失氢或得氧,发生氧化反应。
高中常见有以下几种类型:(1)有机物燃烧,例如:CxHyOz +(4x+y-2z)/4 O2 →x CO2 + y/2H2O(2)催化氧化,例如:乙醇---〉乙醛(3)强氧化剂氧化,乙烯、乙炔、苯的同系物都可以和酸性高锰酸钾溶液发生反应,能被弱氧化剂氧化的物质诸如醛、醇、酚、乙二酸、葡萄糖等当然也能与酸性高锰酸钾溶液发生反应。
但高中阶段不要求写出方程式。
(4)弱氧化剂氧化,例如银镜反应和氢氧化铜悬浊液的反应。
5、葡萄糖的结构简式要求么?答:《考试说明》中写道:以葡萄糖为例掌握糖的结构。
所以还是看看的好。
6、如何鉴别一个物质是卤代烃?答:通过水解反应看是否放出氯离子,但是如果要求书写规范的话,还是有很多要注意的地方的:溴乙烷水解产物乙醇和HBr都溶于水,而溴乙烷不溶于水且密度比水大,因此反应后如果还有溴乙烷剩余,则出现分层现象。
因此要检验溴离子须取上层水溶液。
另外此实验还特别注意,要先用过量硝酸中和上层水溶液中多余的碱,才能用硝酸银溶液检验,否则会使氢氧化银分解,生成棕黑色氧化银而观察不到所要的现象。
7、高中阶段什么东西能够发生水解?答:按照学习的顺序:卤代烃、酯、二糖(蔗糖、麦芽糖),多糖(纤维素、淀粉)、油脂、二肽、多肽、蛋白质。
高考化学有机合成路线专题复习

《有机合成路线》专题复习有机合成路线包括官能团的引入、官能团的保护、碳链的增长、碳链的缩短等,它涵盖了有1.有机合成的原则:(1)尽量选择步骤少的合成路线。
(2)合成路线中出现的反应要是书本学过的反应,不能使用考纲外的竞赛知识,更不能臆造不存在的反应。
值得说明的是,有机合成题中给出的陌生的有机反应,在合成路线中往往要运用。
(3)有机合成产物尽可能要有专一选择性,避免产物多样化。
(4)有机合成路线的评价可从科学性(不违反科学规律)、安全性(避免高温高压等反应条件,试剂低毒或无毒)、可行性(操作简单,易于实现),经济性(原料价廉易得,反应能耗低)、环保性(产物无污染)等五个角度评述。
2.官能团的引入:包括引入C=C双键、C≡C叁键、卤素(-X)、羟基(-OH)、醛基(-CHO)、羧基(-COOH)、酯基等。
(1)引入C=C双键{①醇的消去:___________________________________________________________。
②卤代烃的消去:______________________________________________________。
③炔烃的不完全加成:________________________________________________。
(2)引入C≡C叁键{①邻二醇的消去:______________________________________________________。
②邻二卤代烃的消去:_________________________________________________。
③邻卤代烯烃的消去:________________________________________________。
(3)引入卤素(-X){①烷烃的取代:___________________________________________________________。
高中化学 有机信息给予题的特点和类型 专题辅导

高中化学有机信息给予题的特点和类型专题辅导文/陈宏兆王海富陈一信息给予题又称为材料分析题,此类题目着重考查的是学生的自学能力、单位时间内的思维变通能力以及类推能力等等。
一、有机信息题的特点及解法这类题目直接涉及的化学知识一般是新的,有些甚至在高等学校的教材上也找不到。
这些新知识以信息的形式在题目中给予我们,要求我们通过阅读理解信息,独立思考,分析整理给予的信息,找出规律,学会利用联想、迁移、转换、重组、类推等方法来解决有关问题,使自己已有的能力能在解题中得以充分发挥。
当然,要能接受并掌握给出的信息,必须具备一些有机化学的基础知识。
通过从要求解答的问题来说,并不困难。
所以,有人指出这类试题特点是“起点高,落点低”。
例1请认真阅读以下材料:材料一:瑞典皇家科学院于2001年10月10日宣布,将2001年诺贝尔化学奖授予美国的诺尔斯(William S.Knowles)和夏普莱斯(K.Barry Sharpless)以及日本的野依良治(Ryoji Noyori)等三位科学家,以表彰他们在手性催化反应研究领域取得的成就。
材料二:在有机物中,有一类化合物的化学式相同,原子的连接方式和次序也相同(即结构式相同),但原子在空间排列的方式上不同,因而具有像实物和镜像一样的两种结构,虽然非常相似,但不能重叠,这种异构现象叫对映异构。
这一对映异构之间的关系就像人的左手和右手一样,故这类化合物的分子叫手性分子。
材料三:在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子就叫做手性碳原子或不对称碳原子,含有手性碳原子的分子一般是手性分子,手性分子就可能存在对映异构。
试回答下列问题:(1)下列分子中,不含手性碳原子的是()A. BC. D.(2)2002年国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。
苯丙醇胺的英文缩写为PPA,结构简式为,一个苯丙醇胺分子中有_________个手性碳原子。
2020-2021年新高考化学核心素养下备考策略:有机推断中常见陌生信息应用

第一信息:双烯加成
原理简介: 双烯合成反应,也称为“狄尔斯(Diels)—阿
德尔(Alder)反应” :共轭二烯烃和某些具有 碳碳双键、三键的不饱和化合物进行1,4-加成, 生成环状化合物的反应称为双烯合成反应,是有 机化学合成反应中非常重要的碳碳键形成的手段 之一;“Diels-Alder反应”属于加成反应,原子 利用率100%,符合绿色化学原则。
或是
结束语
有机推断题中陌生信息的提供,除了上面提到 的双烯加成、醛醛(或酮)加成外,还有酯交换、 烯烃的臭氧化生成醛或酮等;陌生信息还可直接 在题干中体现(今年的高考题);其实无论那种 情况,只要同学们能够分析好、利用好信息,就 能快速准确地解决问题,但前提条件一定要会分 析有机物的断键和成键规律,这是破解问题的关 键,今天我们就是通过双烯加成、醛醛(或酮) 加成信息应用,给大家提供一些解题的方法和思 路,我希望我的讲解能够帮助到你们,哪怕是一 点点,谢谢同学们!最后祝大家假期愉快,学有 所成!
有机物G的结构简式为:
(6)写出用环戊烷和2-丁炔为原料制备化合物
的合成路线
(其他试剂任选)。
限时训练2:化合物G是一种具有多种药理学活性的 黄烷酮类药物。实验室由芳香化合物A制备G的合成 路线如图所示:
(节选) (1)写出C的结构简式
(2)写出用环戊烯和正丁醛为原料制备化合物
的合成路线
(其他试剂任选)。
今天我们就通过推断题中常见的双烯加 成与醛醛加成两种信息的应用来探讨一下 推断题或合成题的解题思路和方法,(也 就是合成流程),使同学们能够举一反三, 触类旁通。
学习目标
学习目标
通过典型例题的剖析,归纳总结有关有机 推断中常见陌生信息在解题中的应用方法和技 巧。
信息给予题(有机化学部分)的解析
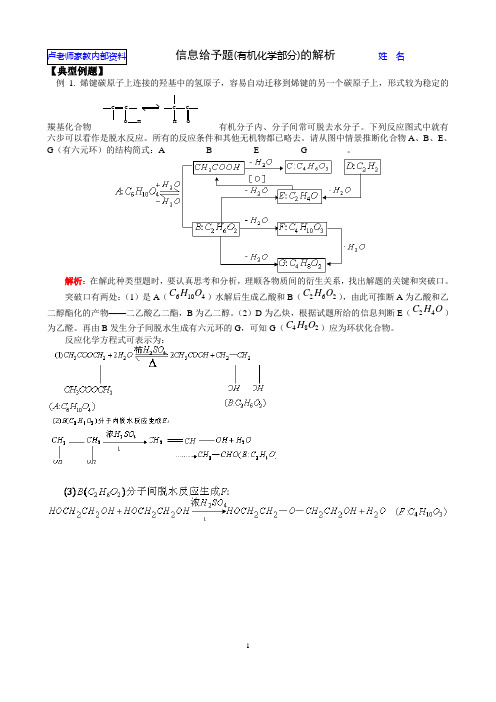
卢老师家教内部资料信息给予题(有机化学部分)的解析姓 名______【典型例题】例1. 烯键碳原子上连接的羟基中的氢原子,容易自动迁移到烯键的另一个碳原子上,形式较为稳定的羰基化合物C CC C O H H O有机分子内、分子间常可脱去水分子。
下列反应图式中就有六步可以看作是脱水反应。
所有的反应条件和其他无机物都已略去。
请从图中情景推断化合物A 、B 、E 、G (有六元环)的结构简式:A_________ B_________ E_________ G_________。
解析:在解此种类型题时,要认真思考和分析,理顺各物质间的衍生关系,找出解题的关键和突破口。
突破口有两处:(1)是A (C H O 6104)水解后生成乙酸和B (C H O 262),由此可推断A 为乙酸和乙二醇酯化的产物——二乙酸乙二酯,B 为乙二醇。
(2)D 为乙炔,根据试题所给的信息判断E (C H O 24)为乙醛。
再由B 发生分子间脱水生成有六元环的G ,可知G (C H O 482)应为环状化合物。
反应化学方程式可表示为:例2. 由IIIA 族元素A 和VIA 族元素B 组成的阴离子结构如下,所带电荷x y z 、、依次为AAAAAAA BBBBBBBBBB BB z-y-x-A. 2,3,4B. 2,3,2C. 5,6,4D. 4,3,2解析:试题给出三种阴离子的结构式,对求离子电荷数来讲,这是一种复杂的表示形式,为解题方便,可将三种阴离子结构式分别变换成下面的简单形式: [][][]A B A B A B x y z 253624---、、因为A 是IIIA 族元素显+3价,B 为VIA 族元素显-2价,根据化合价规则得下面一组关系:答案:D例3. 某期刊封面上有如下一个分子的球棍模型图图中“棍”代表单键或双键或三键。
不同颜色的球代表不同元素的原子,该模型图可代表一种( ) A. 卤代羧酸 B. 酯 C. 氨基酸 D. 醇钠解析:从结构及题目提供的选项看,有四种不同颜色的球,即有四种元素,其中绿球相当于碳原子,白球相当于氢原子,关键是分析红球和蓝球。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考有机化学信息题中常给予的陌生信息一、烯烃1、卤化氢加成(1)CHCH 2R HXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含氢较多的碳上。
(2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
2、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇。
【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO 433M nO OO H O3H 33H 32)热浓酸性高锰酸钾氧化C C R R 21KMnO 4H +CRR 1O +R 2CO3)臭氧氧化C C R R 21CRR 1O +R 2CO1)O 2)Zn/H 2O4)过氧酸氧化C CR R 21ROOOH21CC RR 2121Ag+O 2CH 2RCH 2R 1+催化剂C H 2CH 2RR1【例】OH 22C 6H 5OC 6H 5+C H 2CH 25、共轭二烯烃1)卤化氢加成CH CH 2HXCH 3XCH 23X高温1,4加成为主低温1,2加成为主2)狄尔斯-阿德尔(Diels-Alder )反应(双烯合成)【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】CH 2CH 2+O OO∆O OCH 2CH 2+∆C HO2C H O二、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生开环加成反应,类似碳碳双键。
H /Ni CH 2CH 2CH 2HCH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则 【例】CH 3CH 2CH CH 2CH 3C H CH2Cu 2Cl 2NH 4Cl CH 2CH C CHC H CH3Cu 2Cl 2NH 4ClCH 2CH CHCH 2C H CH3金属羰基化合物C H CH3Ni(CN)2四、芳香烃1.傅-克(Friedel-Crafts )反应①傅-克烷基化反应+RClAlCl 3R【例】CH2Cl 2+2AlClCH 1Cl 3+3AlCl②傅-克酰基化反应+RCl AlCl 3OR+O O RRAlCl 3OR+RCOOH【例】CH3CH2COClAlCl3CH3OZn-HgHCl浓CH3+OOAlCl3COOHO2、苯环上取代反应的定位效应1)第一类定位基,邻对位定位基,常见的有:NR2NH R NH2OH HN ROOR ROOR Ar X(F,C l,Br,I)2)第二类定位基,间位定位基,常见的有:NR3NO2CF3Cl3COOH C OROCN SO3H CH OCOR3、苯的侧链卤代CH3hCH3ClCH3+CH2ClCH3NBSCH2Br4、苯的侧链氧化1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
CHKMnOHCOOH【例】CCH3CH3CH3CH3KMnOHCCH3CH3CH3COOH2)用CrO3+Ac2O为氧化剂时,产物为醛。
【例】CH 32CrO /Ac OCH(OAc)NO 2CHO23)用MnO 2为氧化剂时,产物为醛或酮。
CH 3MnO H 2SO 4CHOCH 2CH 3MnO H 2SO 4CH 3O四、卤代烃 1、取代反应(1)水解 R XOH -ROH RXRSH SH -(2)醇解 R X R O R1R 1ONaR XRSR 1R 1SNa(3)氰解 (4)氨解RX RNH 2NH 3RXNH R 3N(5)与炔钠反应R X+R 1CC-C C RR1(6)卤素交换反应 RXNaI丙酮R I2、与活泼金属反应(1)与金属镁反应RX+Mg无水乙醚RM gX(格式试剂)(2)与金属钠反应 武兹(Wurtz )反应 2RX NaRR五、醇格氏试剂法制醇2Mg +XO -RR 1R 2Mg+X C R 2R 1OH【例】OCH MgCl乙醚H O H +CH 3OH六、酚与甲醛和丙酮反应OH或HCHOH + OH -OHCH 2 OH +OH2OHHHCHO C 6H 5OH酚醛树脂(电木)CH 3O CH 3+OHH +2C CH 3CH 3OHOH七、环氧化合物(1)开环①酸性开环C CH +-CC NuOHCC+②碱性开环C2H 5CC OC 2H 5-HOC H CC OC 2H 5OH(2)环氧的制备①过氧酸氧化CH RRCOOOHOR②银催化氧化(工业)CH 2RORAg/O 2③β-卤代醇CH 2CH 3Br 2/H 2OC H 3H OH -H 3O C3八、醛和酮1、羰基上的加成 (1)加氢氰酸-COH R(H)R 1CN(2)与醇加成①缩醛的生成ORHOR HC OR 1ROH 半缩醛HOR HC OR 1ROR 1缩醛【特点】可用此法在合成中做羰基的保护。
同样的方法也可制备缩酮,机理相同。
【例】OHOCH CH OHH +O OH NiH +O(3)加金属有机化合物OR(H)R 1R 2MgXH O +C R 21OHRC R 21OM gXROC -CHNa +NH 3C ONaCHH O H +C OHCH2、羟醛缩合(1)一般的羟醛缩合①碱催化下的羟醛缩合OH -2CH 3CHOCHCH CC H 3O【注】从反应机理看出,醛要进行羟醛缩合必须有α-H ,否则无法产生碳负离子亲核试剂。
当有一个α-H 一般停留在脱水的前一步,形成α羟基醛。
其实羟醛缩合反应,只要控制温度就可以停留在羟醛产物。
【例】CH 3CH 2CH 2CHOOH -∆2CH 3CH 2CH 2CH2CH 3CHOCH 3CH 2CH 2CHO2OH -6℃~8℃CH CH CH 3CH 2CHO2CH 3OH CH CHO CH 33OH -2CH CH CH 33C CHO3CH 3(2)酮的缩合反应 【例】CH 3CH 3OOH -C CH 2CH 3CCH 3CH 32九、羧酸1、成酰卤RCOOHSOCl 2RCOClRCOOH RCOXPX 3RCOOH RCOXPX 52、成酰胺RCOOH+NH 3∆RCONH23、还原成醇RCOOH1)LiAlH 2)H 2ORCH 2OH4、脱羧反应yCH 2COOH∆yCH 3+CO 2y=ROC O H OCN NO 2Ar ,,,,5、α卤代反应有α氢的羧酸在少量红磷或三溴化磷存在下与溴发生反应,得到α溴代酸。
R C H 2C OOH+Br 2PBr 3R C H BrC OOH。
