甲基红离解平衡常数的测定
甲基红的酸碱离解平衡常数的测定

02 实验材料和设备
甲基红
甲基红是一种常用的酸碱指示剂, 具有酸性和碱性两种离解形式,
用于测定溶液的酸碱度。
甲基红的变色范围为pH4.4-6.2, 颜色变化明显,易于观察。
甲基红的纯度对实验结果的影响 较大,应选择高纯度的甲基红。
缓冲液
01
缓冲液用于维持实验过程中溶液 的pH值稳定,常用的缓冲液有磷 酸盐、醋酸盐等。
要点二
实验可靠性
我们分析了实验过程中可能存在的误差来源,并评估了实 验的可靠性。
误差分析
误差来源
我们分析了实验过程中可能引入误差的 环节,如pH值测量误差、温度波动等。
VS
误差对结果的影响
我们评估了这些误差对实验结果的影响, 并提出了改进措施。
05 结论
主要发现
01 甲基红的离解平衡常数在实验条件下为4.5x10^6。
在调整pH值的过程中,要密切观察指示剂颜色的变化,以便在滴定终点时准确 记录数据。
记录数据
在调整pH值的过程中,要准确记录每 次滴定所用的酸或碱溶液的体积以及 对应的pH值。
记录实验温度,因为温度会影响离解 平衡常数。
数据处理
1
根据实验数据,计算出每次滴定所用的酸或碱溶 液的浓度。
2
使用酸碱离解平衡常数的计算公式,计算出甲基 红的离解平衡常数。
Hale Waihona Puke 02选择适当的缓冲液对于实验结果 的准确性至关重要,应选择与甲 基红离解常数相近的缓冲液。
pH计
pH计用于精确测量溶液的酸碱度,是实验中必不可少的设备 。
应选择精度高、稳定性好的pH计,以保证实验结果的准确性 。
实验容器
实验容器应选择耐酸碱、耐高温的玻 璃或塑料材质,以保证实验过程中的 安全性和准确性。
甲基红酸解离平衡常数的测定

实验十三 甲基红酸解离平衡常数的测定(分光光度法)一、实验目的1、掌握用分光光度法测酸解离常数的方法。
2、学会使用2100型分光光度计和利用酸度计测pH 值的方法。
二、实验原理酸式甲基红:HMR 和碱式甲基红:MR — 有下列平衡存在:HMR (红) ﹦ H + + MR —(黄)其解离平衡常数可表示为:[][][]HMR MR H K -+= ;两边取负对数得:[][]HMR MR pH pK --=lg-------①只要测出溶液的pH 和浓度比〔RM —〕/〔HMR 〕即可。
平衡体系的pH 值可由酸度计直接测出来,而RM —与HMR 在可见区内均有一个强的吸收峰故 〔RM —〕/〔HMR 〕则可通过分光光度法来求的。
物质对光的吸收情况我们要明确下列三点: ①物质对光的吸收符合吸收定律(朗伯—比尔定律)其定义: 0I I T =。
T 为透光度(率)两边取负对数:)(lg 1lglg 0吸光度A II T T ===-。
c l a A =称之吸收定律。
式中l 为溶液的光径长度即比色皿厚度(cm ),C 为溶液的浓度(mol/L ),a 为摩尔吸光系数,a 是与入射光波长0λ、物质种类、温度有关的常数即:0()a f T λ=、物质种类、。
则)(0c l T f A 、、、物质种类、λ=。
②物质对光的吸收是有选择性的。
物质对不同波长的光的吸收能力不同(A 不同),物质对某一波长的光的吸收能力强(A 较大)对另一波长的光的吸收能力弱(A 较小),以0λ→A 作图得到的曲线称吸收曲线(光谱),该曲线上A max 对应的0λ称最大吸收波长m ax λ要测溶液的A 在m ax λ处最灵敏,准确度最高。
③A 具有加和性。
某一溶液中含有i 种物质则溶液的∑=iAA 。
根据c l a A = 要测C HMR 需在)(max A HMR λλ⋅下测HMR 的A ;要测C MR — 需在)(max B MR λλ⋅-下测MR —的A 。
甲基红酸解离平衡常数的测定实验报告

甲基红酸解离平衡常数的测定实验报告实验报告:甲基红酸解离平衡常数的测定一、实验目的:通过测定甲基红酸的酸解离平衡常数,掌握酸解离常数的计算方法,了解红酸与保护试剂的使用方法,加深对化学平衡及其影响因素的认识。
二、实验原理:1.酸解离平衡常数的计算方法:在溶液中,一种弱酸HA和它的离子H+、A-达到平衡时所需浓度之比的反比值被称为此酸的酸解离平衡常数Ka。
Ka=[H+][A-]/[HA]2.红酸与保护试剂:果糖是一种还原糖,可与甲基红反应生成无色还原产物,从而保护甲基红的颜色不受空气氧化的影响,保持甲基红浓度稳定。
三、实验步骤:1.分别称取0.01mol/L的甲基红溶液5ml入一组试管中,称取一定量的pH=1.0的HCl溶液加入其中,并加入适量的果糖溶液,振荡混匀。
2.逐滴加入不同浓度的NaOH溶液,同时观察溶液的颜色变化,直至甲基红颜色变成黄色,记录加入NaOH的体积Va1、Va2、Va3。
3.按照实验原理中的公式,根据实测结果计算得到甲基红的酸解离平衡常数。
四、实验结果与分析:1. NaOH加入体积(mL):Va1=0.20, Va2=0.30, Va3=0.40;2. 计算出实验所测得的酸解离平衡常数Ka分别为:Ka1=3.97×10^-4, Ka2=7.95×10^-4, Ka3=1.19×10^-3。
3. 实验中果糖的加入可保护甲基红的颜色不受空气氧化的影响,实验结果较准确,表明该实验方法可行。
五、实验结论:1. 甲基红的酸解离平衡常数随着pH值的增大而增大;2. 实验中果糖的加入能够保护甲基红的颜色,使其浓度稳定,提高了实验的准确性;3. 本实验方法简单易行,且实验结果较准确,是一种常用的测定酸解离平衡常数的方法。
六、实验注意事项:1.要严格控制HCl浓度,以免影响实验结果;2.实验过程中要保持试管外壁干燥,以免外界环境的水分进入实验体系;3. NaOH的加入应该适量谨慎,以免误差;4. 实验用试剂应该标准化,以保证实验结果的精确度。
甲基红平衡常数
HMR(酸型)
MR-(碱性)+H+
(红色)
(黄色)
Ka
=
[H+ ][MR− ] [HMR]
pK a
=
pH − lg [MR− ] [HMR]
A = A + A total 520
HMR 520
MR − 520
A = A + A total
HMR
MR −
430
430
430
A = K c·l
− A K′ total MR− 430 520
甲基红的离解平衡常数测定
一、实验目的 1、学会用分光光度法测定混合物组分的浓度,由此求出甲基红离解平衡 常数。 2、掌握分光光度计的使用方法。
二、实验原理
1、混合溶液的测定 分光光度法常常可用来进行多组份混合物的测定。如果混 合物中各组份的特征吸收曲线不相重叠,可在波长λ1测定 显著吸收的甲物质,而在波长λ2测定显著吸收的乙物质。 如果混合物中各组份的吸收曲线相互重叠,只要符合朗伯 -比尔定律,可测定其含量。
430
−
[MR− ]
[MR− ] [HMR]
=
A K′ total HMR 430 520
A K′ total MR−
520
430
−
A K′ total HMR 520 430
− A K′ total MR− 430 520
四、实验数据测定
1、 测定纯HMR溶液的最高吸收峰 (p18)(0#-3#)
Atotal 520
=
K′5H2M0 R
[HMR]
+
K ′MR − 520
[MR − ]
甲基红的酸离解平衡常数的测定-2022年学习资料

对一化学反应平衡体系,分光光度计则得的光-密度包括各物质的贡献,根据朗伯一比尔定-律,当c单位为molL,l单位为cm时,a为-摩尔吸光系数。由此回推知甲基红溶液中总-的光密度为:-DA dA.HMr [HMR I aA.Mr-[MR-]l-3-DB dB.HMr[HMR]l a B.Mr-[MR-]l-4-实验中若 用lcm比色皿,即l=1,则由-式得:-[MR]=-DA -CA.HMR [HMR]-5-A.MR-Dep rtment of Chemistry
分-甲基红的酸离解平-鼾常数的测定-实验目的-实验原理-药品仪器-四-实验步骤-五、实验记录-数据处理-七 结果分析与讨论-注意事项-九、思考题-Department of Chemistry
0-实验目的-1.测定甲基红的酸离解平衡常数。-2.掌握分光光度计和酸度计的使用方法。-心-Departm nt of Chemistry
u-实验步骤-调节分光光-测定甲基红酸式HMR和碱-度计-式MR一的最大吸收波长-测定它们在入A入B下-标 酸度计-的摩尔吸光系数-测定在A和B下各溶液的光密度DA-和DB,测各溶液的pH值-Department f Chemistry
1.722型分光光度计的使用-1将灵敏度旋钮调置“1”档,-放大倍率最小;-2开启电源预热20分钟,选择开 置“T”,-波长凋置测-试-用波长;-③打开试样室盖(光门自动关闭,调节“0”旋钮,-使数-字显示为“00 0”;-4放入参比液,调节100%旋钮,-使数字显示为“100.0”;-如不到100.0,适当调整灵敏度的 度,同时重复“3”;-5选择开关置于“A”调节吸光度调零旋钮,数字显示为-0.000,移入被测溶液,显示A 。-6改变测试波长,稍等片刻,-重新调整0和100%后,比-色皿光面通光路。-Department of hemistry
甲基红的酸离解平衡常数的测定

2、摩尔吸光系数的测定
原溶液(A) 0.7倍A液
0.5倍A液 0.2倍A液
用0.01mol.l-1的HCl 稀释至50ml
共8组数据
分别在λA、λB下
测 D值
原溶液(B) 0.7倍A液
0.5倍A液 0.2倍A液
用0.01mol.l-1的 CH3COONa稀释至50ml
分别在λA、λB下
测 D值
3、求不同PH值下MR- 和HMR的相对量和 pK值
三、仪器与试剂
722/7200型分光光度计; PHS-2型PH计; 容量瓶( 100ml、50ml); 移液管(25ml、10mL 、5ml ) ; 标准甲基红溶液 标准缓冲溶液(邻苯二甲酸氢钾溶液,PH=4.00) CH3COONa (0.04M/0.01M) HCl (0.1M/ 0.01M)
甲基红的酸离解 平衡常数的测定
一、实验目的 二、实验原理 三、仪器与试剂 四、实验步骤
五、数据记录和处理
一、实验目的
1.了解甲基红的酸离解平衡常数测定原理; 2.掌握722/7200型分光光度计和PHS-2型 PH计的使用方法。
二、实验原理
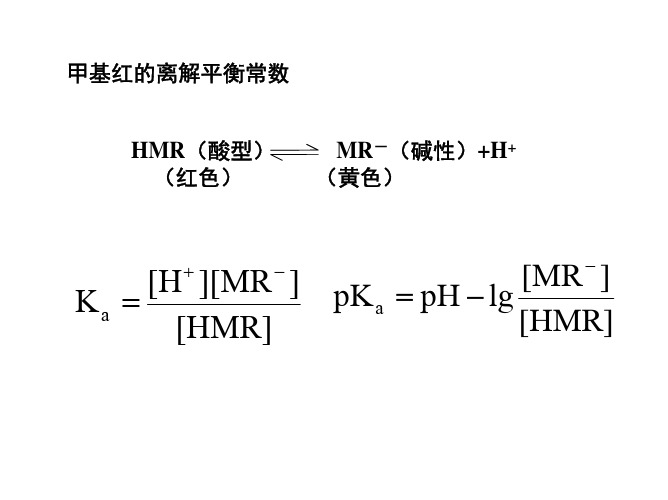
1.离解平衡常数K:
[ H ][MR ] k [ HMR]
五、数据记录和处理
六、思考题
1.在本实验中,温度对实验有何影响?采取什么措施可 以减少这种影响? 2.为什么要用相对浓度?为什么可以用相对浓度? 3.在光密度测定中,应该怎样选择比色皿?
722型分光光度计
PHS-2型pH结构与使用
四、实验步骤
1、测定甲基红酸式(HMR)和碱式(MR-)的最大吸收波长λA 和λB 。
A液:
10ml标准甲基红溶液 + 10ml0.1M的HCl 定容至100ml 480~ 550nm范围内, 每隔10nm测D 找出λA
甲基红的酸离解平衡常数的测定2

仪器和试剂
TU-1810DASPC分光光度计一台(北京普析 通用仪器责任有限公司);PB-10 pH计一台 (德国Sartorius); 100mL容量瓶7个;移液 管;烧杯;量筒。 1、甲基红贮备液 0.5g晶体甲基红溶于450mL95%的乙醇中, 用 蒸馏水稀释至500mL。 2、pH为4.003和6.864的标准缓冲溶液。
所特有的校正功能。由于这两种测光方式的计算方法要求对空白溶液 或溶剂进行校正,因此扫描前或更改扫描参数后,需进行基线校正。
CH3COONa 溶液稀释至250mL, 此溶液的pH值大约为8, 把 甲基红看成完全以碱式存在。
实验步骤
2、测定吸收光谱曲线
(1)取部分A液和B液分别放在2个0.5cm比色槽内,
在350-600nm之间扫描它们相对于水的光密度,找
出最大吸收波长 1 和 2 。
(2别)各求用K0.A1、 01KmoA2l、 LK1 HB1C、lK和B20。.0将1 m取ol 部L1分的ACH液3C和OOBN液a ,稀分释 至它们原来的0.25,0.50, 0.75倍,加上原溶液,
基本原理
根据朗伯-比尔定律,溶液对于单色光的吸收,遵守下 列关系式:
A lg I0 lc
(1)
I
式中A为吸光度;I / I0为透射比;为摩尔吸收系数,它是溶
液的特性常数;l为被测溶液的厚度;c为溶液浓度。 在分光光度分析中,将不同波长的单色光分别地通过
某一溶液,测定溶液对每一种光波的吸收,以吸光度A对 波长λ作图,就可以得到该物质的分光光度曲线或吸收光 谱曲线,如图1所示。由图可以看出,对应于某一波长有 一个最大的吸收峰,用这一波长的入射光通过该溶液就有 着最佳的灵敏度。
数据记录和处理
甲基红的解离平衡常数的测定

1/18/2019
七、思考题
1.实验过程中,温度对测定结果有何影响?采取哪些措 施减少其影响?
2.为什么要用相对浓度?
3.在吸光度测定中,应该怎样选用比色血(吸收池)?
上一内容
下一内容
回主目录
返回
1/18/2019
上一内容 下一内容 回主目录 返回
1/18/2019
三、主要仪器与试剂
• 723PC分光光度计1台,pHS-10A型pH计1台 • 容量瓶(50mL2只,25mL8只) • 移液管(5mL、10mL、25mL各1只)
» 甲基红溶液:0.1g晶体甲基红溶于50mL95%的乙 醇中,用蒸馏水稀释至200mL
“0%”键:用于自动调整0%透射比。仪器开机后自检的过程中已 经将0%的参数保存在微处理器中,一般情况下无需使用此键; 仪器长时间使用,需要调整0%透射比。
上一内容 下一内容 回主目录 返回
1/18/2019
四、仪器操作方法
“功能”键(FUNC):输入已知标准样的浓度值,按功能键一次; 输入已知标准样品K因子,按功能MR-的最大吸收波长处 所测得的总的吸光度;k1,HMR、k1,MR-、k2,HMR、K2,MR-分别 为HMR和MR-在最大波长λ 1、 λ 2处的摩尔吸收系数。 各物质的摩尔吸收系数值可由作图法求得。分别配 制pH=2的各种浓度的甲基红酸性溶液,在波长λ 1分别测 定各浓度的吸光度,然后对浓度作图得到一条通过原点 的直线,由直线的斜率可以计算k1,HMR值,其余各摩尔吸 收系数的求法相似。
上一内容 下一内容 回主目录 返回
1/18/2019
五、实验主要操作步骤
2.检验HMR和MR-是否符合朗伯-比耳定律,并测定它 们在λ1、λ2下的吸收波系数 取五只50ml容量瓶,分别加入甲基红溶液0.10ml, 0.15ml,0.20ml,0.30ml,0.40ml,再加入1ml 0.2mol.L1 HCl溶液。另取五只50ml容量瓶,加入甲基红溶液 0.40ml, 0.60ml,0.80ml,1.00ml,1.20ml,再加入1ml 20%乙酸钠溶液配制一系列待测液,分别稀释至刻度。 在波长λ 1、λ 2下测定这些溶液及原液的吸光度。由 吸光度对浓度作图,计算在λ 1下甲基红酸式(HMR)和 碱式(MR-)的摩尔吸收系数及其他的摩尔吸收系数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二 甲基红离解平衡常数的测定一、实验目的1.学会用分光光度法测定溶液各组分浓度,并由此求出甲基红离解平衡常数。
2.掌握可见分光光度计的原理和使用方法。
二、实验原理1.分光光度法分光光度法是对物质进行定性分析、结构分析和定量分析的一种手段,而且还能测定某些化合物的物化参数,例如摩尔质量,配合物的配合比和稳定常数以及酸碱电力常数等。
测定组分浓度的依据是朗伯-比尔定律:一定浓度的稀溶液对于单色光的吸收遵守下式lgI A klcI == (1)A 为吸光度,I/I 0为透光率T ,k 为摩尔吸光系数(与溶液的性质有关),l 为溶液的厚度,c 为溶液浓度。
在分光光度分析中,将每一种单色光,分别依次通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A 对波长λ作图,就可以得到该物质的分光光度曲线,或吸收光谱曲线,如图1所示。
由图可以看出,对应于某一波长有一个最大的吸收峰,用这一波长的入射光通过该溶液就有着最佳的灵敏度。
图1 分光光度曲线从(1)式可以看出,对于固定长度吸收槽,在对应最大吸收峰的波长(λ)下测定不同浓度c 的吸光度,就可作出线性的A~c 线,这就是光度法的定量分析的基础。
以上讨论是对于单组分溶液的情况。
对含有两种以上组分的溶液,情况就要复杂一些:①若两种被测定组分的吸收曲线彼此不相重合,这种情况很简单,就等于分别测定两种单组分溶液。
②两种被测定组分的吸收曲线相重合,且遵守Lambert-Beer定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。
根据Beer-Lambert定律,假定吸收槽的长度一定(一般为1cm),(2)(3)(4)此处A Aλ1、A Aλ2、A Bλ1、A Bλ2分别代表在λ1及λ2时组分A和B的吸光度。
由(3)式可得:(5)将(5)式代入(4)式得:(6)这些不同的K值均可由纯物质求得。
也就是说,在各纯物质的最大吸收峰的波长λ1、λ2时,测定吸光度A和浓度c的相关,如果在该波长处符合朗伯-比尔定律,那么A~c为直线,直线的斜率为K值。
是混合溶液在λ1、λ2时测得的总吸光度,因此根据(5)、(6)式即可计算混合溶液中组分A和组分B的浓度。
甲基红溶液即为②中所述情况。
其他情况要比①②更复杂一些,本实验暂不作讨论。
2.甲基红离解平衡常数及pK的测定甲基红是一种弱酸型的染料指示剂,具有酸(HMR)和碱(MR-)两种形式。
其分子式为:它在溶液中部分电离,在碱性浴液中呈黄色,酸性溶液中呈红色。
在酸性溶液中它以两种离子形式存在:在波长520nm 处,甲基红酸式HMR 对光有最大吸收,碱式吸收较小;在波长430nm 处,甲基红碱式MR -对光有最大吸收,酸式吸收较小。
故依据(5)、(6)式,可得:[MR -] / [HMR] = (A 总430*K’HMR 530- A 总520*K’HMR 430 )/( A 总520*K’MR-430 - A 总430 *K’MR-520) (7) 由于HMR 和MR 两者在可见光谱范围内具有强的吸收峰,溶液离子强度的变化对它的酸离解平衡常数没有显著影响,而且在简单CH 3COOH-CH 3COONa 缓冲体系中就很容易使颜色在pH =4~6范围内改变,因此比值[MR -]/[HMR]可用分光光度法测定而求得。
甲基红的电离常数][]][[HMR MR H k -+=令-lgK=pK ,则][][lgHMR MR pH pK --= (8) 由(8)式可知,只要测定溶液中[MR -]/[HMR]及溶液的pH 值(用pH 计测得),即可求得甲基红的pK 。
3.可见分光光度计的原理及使用方法 分光光度计的结构一般由五部分组成:本实验使用的是722N型可见分光光度计。
使用此仪器时应注意:按照老师指导的仪器使用方法规范使用;如果仪器发生故障,需报告指导教师,不能自行进行修理;使用分光器前要预热仪器,使电压稳定;比色皿放入样品室前,用镜头纸擦干比色皿外的的溶液,切忌用手触碰比色皿透光面。
三、仪器和试剂1、仪器722型分光光度计,(HANNA instrument)pH211 Microprocessor pH meter,容量瓶100ml11个,烧杯50ml3个,,移液管10ml2支,25ml2支,量筒50ml1个。
2、试剂甲基红(A.R.),95%酒精,0.1mol.L-1 HAc,0.01mol.L-1HCl,0.1mol.L-1HCl,0.01mol.L-1NaAc,0.04mol.L-1NaAc。
四、实验步骤1.甲基红储备溶液的配制用研钵将甲基红研细,称取1g甲基红固体溶解于500ml95%酒精中。
甲基红储备溶液已配好,此步骤略去。
2.甲基红标准溶液的配制由公用滴定管放出5ml甲基红储备液于100ml,用量筒加入50ml 95%酒精溶液,用蒸馏水稀释至刻度,摇匀。
储备溶液呈深红色,稀释成标准溶液后颜色变浅。
3.A溶液(纯酸式)和B溶液(纯碱式)的配制A溶液:取10.00ml甲基红标准溶液,加10.00 0.1 mol.L-1HCl,再加水稀释至100ml,此时溶液PH大约为2,故此时溶液的甲基红以HMR形式存在。
B溶液:取10.00ml甲基红标准溶液,加25.00 0.04 mol.L-1NaAc,再加水稀释至100ml,此时溶液PH大约为8,故此时溶液的甲基红以MR-形式存在。
A溶液呈红色,B溶液呈黄色。
4.最高吸收峰的测定(1)A溶液的最高吸收峰取两个1cm比色皿,分别装入蒸馏水和A溶液,以蒸馏水为参比,从420~600nm波长之间每隔20nm测一次吸光度。
在500~540之间每隔10nm测一次吸光度,以便精确求出最高点之波长。
(2)B溶液的最高吸收峰取两个1cm比色皿,分别装入蒸馏水和B溶液,以蒸馏水为参比,从410~530nm波长之间每隔20nm测一次吸光度。
在410~450之间每隔10nm测一次吸光度,以便精确求出最高点之波长。
操作分光光度计时应注意,每次更换波长都应重新在蒸馏水处调整T档为100%,然后再切换到A档,测定溶液A值。
5.按下表分别配制不同浓度的溶液:配制完后分别测得7种溶液在520nm及430nm处的吸光度A。
6.配制不同pH下的甲基红溶液配制完后分别测得4种溶液在520nm及430nm处的吸光度A。
5、6步骤中在测量溶液的吸光度时,一个比色皿要使用多次,在更换溶液时要清洗干净,再换装溶液。
五、数据记录1.纯酸式甲基红HMR(A溶液)和纯碱式甲基红MR-(B溶液)最高吸收峰的测定测得的纯酸式甲基红HMR(A溶液)和纯碱式甲基红MR-(B溶液)在不2.以酸式为主和以碱式为主的甲基红各溶液吸光度的测定将0#、0‘#、1#~6#溶液在波长520nm、430nm下分别测定吸光度,以蒸馏3.不同[MR-] /[HMR]值的甲基红溶液吸光度的测定将7#~10#溶液在波长520nm、430nm下分别测其吸光度,以蒸馏水为参比溶4.甲基红溶液PH的测定##六、数据处理1.用五、1中的数据作出A溶液和B溶液的A~λ图(1)纯酸式甲基红HMR(A溶液)A~λ图如下,由图中读出其最大吸收波长为520nm(2)纯碱式甲基红MR-(B溶液)A~λ图如下,由图中读出其最大吸收波长为430nm2.求A溶液和B溶液的摩尔消光系数(1)各溶液浓度计算溶液编号0#1#2#3#0'#4#5#6#浓度mol/L 3.713*e-52.785*e-51.856*e-50.928*e-53.713*e-52.785*e-51.856*e-50.928*e-5(2)各溶液浓度与其吸光度曲线将五、2中数据在origin中作图如下:拟合得各直线方程为A-520:Y = A + B * XA=0.019 B=0.26422故摩尔消光系数K’HMR520 =26422L/mol·cm A-430:Y = A + B * XA = -0.005B = 0.02381 故摩尔消光系数K’HMR430 =2381L/mol·cmB-520:Y = A + B * XA = -0.007B = 0.01412 故摩尔消光系数K’MR-520 =1412L/mol·cmB-430:Y = A + B * XA = -0.006B = 0.11293 故摩尔消光系数K’MR-430 =11293L/mol·cm3.甲基红溶液中[MR-]/[HMR]值的计算将2中计算出的摩尔消光系数和五、3中的吸光度,代入式(7),计算出####-4.甲基红溶液离解平衡常数K的计算将五、4中测得的pH和相应的[MR-]/[HMR]代入式(8),计算出7#,8#,9#,10#=4.86计算得pK平均即K=1.38×10-5七、实验讨论1.实验中拟合计算K’MR-430和K’MR-520时,,图中出现明显偏离线性关系的点,分析其原因可能是测量吸光度时没有用蒸馏水标定100%,也有可能是比色皿换装溶液时未洗净。
另外,由于分光光度计的测量精度在0.001,所以吸光度越小,其相对误差越大,这也是配制0#~6#溶液未用蒸馏水稀释的原因。
2.常温下pK为4.95±0.05,最后计算结果为4.86,相对误差为:R=1.8%误差产生的原因除1中原因外,还有可能是溶液配制不标准,也有可能是温度因素影响,随着温度升高,K值会增大,pK会减小,所以实验过程应尽量保持恒温。
3.在使用精密pH计时要用标准的缓冲溶液标定。
本次实验使用的是临苯二甲酸氢钾,pH为4,以及饱和磷酸盐溶液,pH为6.89。
pH计在使用前,先要打开静止30min,使电压稳定。
使用前用标准液校正选择CAL,用上下箭头选定所要标的pH区间,选定后按确定将玻璃电极用蒸馏水冲洗干净后用滤纸吸干,然后插入到标定液中。
然后进行上下限的标定。
在每次测定溶液pH前,当润洗玻璃电极2-3次,使用完毕后,为了保证玻璃电极的使用寿命,要将其置于充满蒸馏水的套中。
八、问答题1.为何要先测出最大吸收波长,然后在最大吸收峰处测定吸光度?答:因为在最大吸收峰处吸光系数K值较大,物质在含量上的微小变化将引起较大的吸光度差异,因此吸光度A随浓度变化的幅度最大,测定最灵敏;另外还可以减少其他物质对测定物质吸光度的干扰,从而减少误差,提高准确性。
2.为何待测液要配成稀溶液?答:因为只有在稀溶液里才能忽略分子间的相互作用关系,这样吸光度才能和浓度存在比例关系,即符合朗伯-比尔定律,当溶液浓度增大后将不再满足这一线性关系。
3.用分光光度法进行测定时,为何要用空白溶液校正零点?答:这样可以消除由于非待测组分对入射光的吸收、散射等;抵消比色皿对入射光的吸收反射。
