选修4原电池 导学案
化学选修4第四章第一节原电池-化学电源导学案
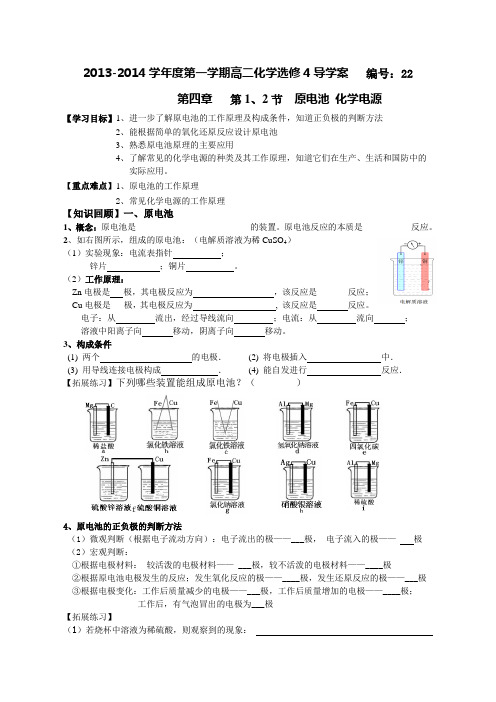
2013-2014学年度第一学期高二化学选修4导学案编号:22第四章第1、2节原电池化学电源【学习目标】1、进一步了解原电池的工作原理及构成条件,知道正负极的判断方法2、能根据简单的氧化还原反应设计原电池3、熟悉原电池原理的主要应用4、了解常见的化学电源的种类及其工作原理,知道它们在生产、生活和国防中的实际应用。
【重点难点】1、原电池的工作原理2、常见化学电源的工作原理【知识回顾】一、原电池1、概念:原电池是__________________________的装置。
原电池反应的本质是___________反应。
2、如右图所示,组成的原电池:(电解质溶液为稀CuSO)(1)实验现象:电流表指针;锌片;铜片。
(2)工作原理:Zn电极是极,其电极反应为_________ _________,该反应是_______反应;Cu电极是___极,其电极反应为_______ _____ , 该反应是____ 反应。
电子:从流出,经过导线流向;电流:从流向;溶液中阳离子向移动,阴离子向移动。
3、构成条件(1) 两个的电极.(2) 将电极插入中.(3) 用导线连接电极构成.(4) 能自发进行反应.【拓展练习】下列哪些装置能组成原电池?()4、原电池的正负极的判断方法(1)微观判断(根据电子流动方向):电子流出的极——___极,电子流入的极——极(2)宏观判断:①根据电极材料:较活泼的电极材料—— ___极,较不活泼的电极材料——____极②根据原电池电极发生的反应;发生氧化反应的极——____极,发生还原反应的极——___极③根据电极变化:工作后质量减少的电极——___极,工作后质量增加的电极——____极;工作后,有气泡冒出的电极为___极【拓展练习】(1)若烧杯中溶液为稀硫酸,则观察到的现象:两极反应式为:正极 ;负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,总反应方程为 。
5、原电池的主要应用:(1)利用原电池原理设计新型化学电池;(2)改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;(3)进行金属活动性强弱比较;(4)电化学保护法,即将金属作为原电池的正极而受到保护。
4.1.2 原电池原理的应用——人教版高中化学选修4导学案

丹凤中学2019届化学学科导学案总计:900 编写人:李海侠审核人:王银伸 N0:2019HXX4—032第2课时原电池原理的应用[学习目标]1、会利用原电池原理比较金属活动性强弱2、能将一个氧化还原反应设计成原电池一、知识记忆与理解[自主预习]自学《新新学案》77页探究升华思考以下问题:1、比较金属活动性强弱的方法有哪些?2、如何判断原电池的正负极?3、设计原电池时如何选择电极?如何选择电解质溶液?[预习检测]1、判断正误,正确的画“√”,错误的画“×”。
(1) 若使反应Fe+2Fe3+===3Fe2+以原电池方式进行,可用锌、铁作电极材料。
( )(2) 原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。
( )(3) 电流从负极流向正极。
( )(4) CaO+H2O===Ca(OH)2可把该反应设计成原电池,把其中的化学能转化为电能。
( )2、依据氧化还原反应:2Ag+(aq) + Zn(s) ==Zn 2+ (aq) + 2Ag (s)设计有盐桥的原电池。
(1)负极发生的电极反应为。
正极发生的电极反应为。
(2)负极电极的材料是;正极电极的材料是;电子由流向。
(3)负极电解质溶液是;正极电解质溶液是;盐桥中阳离子流向。
(4)验过程中取出盐桥,原电池(填“能”或“否”)继续工作。
(5)画出设计图二、思维探究与创新[问题探究]1、在锌与稀硫酸反应时加入少量CuSO4溶液能使产生H2的速率加快,为什么?2、利用原电池原理进行金属防腐,被保护的金属作极。
班级:小组:姓名:第四章第1节所有的胜利,与征服自己的胜利比起来,都是微不足道丹凤中学2019届化学学科导学案总计:900 编写人:李海侠审核人:王银伸 N0:2019HXX4—0323、请根据氧化还原反应 :Cu +2 Fe3+= Cu2++ 2Fe2+设计成原电池。
你有哪些可行方案?负极、正极、电解质溶液分别是什么?若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?试画出原电池的装置简图。
人教版高二化学选修四4.1原电池学案最全版

第一节原电池教案内容解读1.体验化学能与电能互相转变的研究过程2.认识原电池观点、原理、构成及应用。
3. 经过对原电池实验的研究,指引学生从电子转移角度理解化学能向电能转变的实质,以及这类转变的综合利用价值。
【预习纲要】一.原电池工作原理1、原电池定义:将转变成的装置。
2、构成原电池的条件:(1) ____________________________________________________(燃料电池中两极可同选石墨或铂)(2) _____________________________(3) _____________________________(4) _______________________________________________3、电极反响方程式的书写注意:按照三大守恒(电子得失陷恒、质量守恒、电荷守恒)如下图,电极方程式:负极: _______________________正极: _______________________总反响: _______________________4.盐桥的作用(1)使整个装置构成 _______________,取代两溶液直接接触。
(2)均衡电荷。
二.电极名称及其判断:(1)依据电极资料:两种金属(或金属与非金属)构成电极,若它们都与(或都不与)电解质溶液独自能反响,则较开朗的金属作;若只有一种电极与电解质溶液能反响,则能反响的电极作。
( 2)依据电极反响:失电子——反响—极得电子——反响—极( 3)依据电子或电流流动方向(外电路):电子从极流出,流入极,电流从极流出,流入极,( 4)依据离子的定向挪动(内电路):阳离子向挪动阴离子向移动。
【典型例题】【例 1】以下哪些装置能构成原电池?()【例 2】请写出以下原电池电极反响式及总反响式。
Fe-C ( 稀硫酸 )Cu -Ag ( 硝酸银溶液 )Al - Mg ( 氢氧化钠溶液)【例 3】请把 Fe + 2FeCl 3 = 3FeCl 2,设计成原电池,画出装置图。
2022年人教版高中化学选修四 4-1 原电池(导学案)

Cu4-1 原电池【学习目标】1 以铜锌原电池为例,熟悉原电池的工作原理2 会正确判断原电池的正极和负极3 学会原电池电极反响式的书写方法 【学习重难点】学习重点:原电池的工作原理及电极反响式的书写。
学习难点:原电池的工作原理及电极反响式的书写。
【自主预习】一.1氧化复原反响的本质是 2 原电池是将 转化为 的装置。
其本质是 原理的应用。
二.原电池工作原理:1 知识回忆—以 Cu-Zn-硫酸铜原电池为例,如右图锌片: 极,_________ 电子,发生________ 反响。
铜片: 极,_________ 电子,发生________ 反响。
外电路:电子从 极流入 极内电路:________ 向负极移动,______ 向正极移动思考:如果用以上装置作电源,能持续稳定地产生电流吗?怎样进行改良?探究活动—有盐桥的原电池的工作原理:阅读课本ol2Zn-2e-===Zn2+那么上述描述合理的是A.①②③B.③④⑤C.①⑤⑥D.②③④5.1将Al片和Cu片用导线相连,插入稀H2SO4中组成原电池,写出电极名称及电极反响式:Al片_________________________________________________________________,Cu片__________________________________________________________。
2假设将Al片和Cu片用导线相连,插入浓HNO3中能否组成原电池?________填“能〞或“不能〞,假设能组成原电池,写出电极名称及电极反响式:假设不能,此问不用作答Al片_________________________________________________________________,Cu片_________________________________________________________________。
高中化学选修4人教版全册教案导学案第四章第一节 原电池 学案

第四章 电化学基础第一节 原电池课前预习学案一、预习目标预习预习醛的结构以及物理和化学性质初步学会书写相关反应方程式。
二、预习内容温故而知新1:如右图回答问题:1、定义:把 转换为 的装置。
2、写出Zn 片和Cu 片上发生的电极反应和电池总反应负极:正极:总反应:3、图上注明外电路中的电子流向。
内电路:阳离子向_______极移动,阴离子向_______极移动。
4、原电池反应本质: 反应。
温故而知新2:形成原电池的条件: 1、___________________________________________2、___________________________________________3、___________________________________________课内探究学案H 2SO4 CuSO 4ZnSO 4 CuSO 4 酒精CuSO 4一、学习目标1. 掌握构成原电池的条件2. 理解原电池的原理3. 学会原电池的正负极及电极反应式的书写方法学习重难点:原电池的原理二、学习过程一、原电池1、原电池的构成条件实验顺序金属实验现象解释能量的转化关系①Zn、Cu单独插入稀H2SO4溶液Zn片Cu片②Zn、Cu导线连接并连接灵敏电流表后插入稀H2SO4Zn片Cu片电流表(1)原电池的概念:将能转化为能的装置。
(2)写出上面原电池负极和正极的电极反应式和原电池总反应。
负极(Zn):正极(Cu):总反应(离子方程式)探究:以下装置哪些能构成原电池,哪些不能构成原电池,并说明理由。
(3)构成原电池的条件①。
电极名称:极电子流向,发生反应,材料活泼性极电子流向,发生反应,材料活泼性②。
外电路:电子从极流向极,电流从极流向极。
内电路:阴离子移向极,阳离子移向极,电流从极流向极。
③。
电解质溶液作用:。
④。
2、原电池的工作原理反应过程中,极失电子,发生反应,电子经导线流向极,电解质溶液电离出的离子在该极得电子,发生反应。
(选修四)原电池导学案

化学能转化为电能——原电池一、原电池原理1、原电池形成的条件(1)两个活泼性的电极,二者(如相互接触)或相连,插入中。
(2)形成回路。
(3)总反应为能自发发生的反应。
2、正极、负极的判断3、电极反应式的书写和电荷移动方向(1)电极反应式的书写负极:,电极反应式:。
正极:,电极反应式:。
电池反应:。
(2)电荷移动方向电子由释放,经沿导线流入,电解质溶液中的移向正极,在其表面得电子被;活泼负极失电子,形成一个闭合回路。
(3)盐桥的作用:。
二、化学电源1、锌锰干电池酸性锌锰干电池的电极反应:负极:正极:碱性锌锰干电池的电极反应:负极:正极:2、铅蓄电池总电池反应为(可逆反应吗?)放电时为池,电极反应分别为极:极:充电时为池,电极反应分别为极:极:充电时,与直流电源正极连接的蓄电池的极,与直流电源正极连接的蓄电池的极。
3、氢氧燃料电池酸式氢氧燃料电池的电极反应:负极:正极:碱式氢氧燃料电池的电极反应:负极:正极:【重点难点精讲】1、原电池中电极的判断⑴一般,活泼的电极为极,不活泼的电极为极。
⑵根据电流方向或电子流动方向判断。
电流是由极流向极;电子流动方向是由极流向极,溶液中阳离子移向极,阴离子移向极。
⑶在原电池反应中失去电子,化合价,发生氧化反应的一极为极,在电池反应中得到电子,化合价,发生还原反应的一极为极。
(4)由具体电极现象判断。
如:某原电池中变细的一极为极,变粗的一极为极。
2、电极反应的书写:正负极反应之和就是电池的总反应式。
先写比较容易的一个电极反应,再由总的电池反应(应该是离子方程式)减去已经写出的电极反应得到另一电极反应。
对于较复杂的、陌生的反应可用该方法解题并检验。
3、原电池的几种类型:⑴负极和电解质反应类型。
如:(-)Fe|HCl|Cu(+)原电池、(-)Al|NaOH|Mg(+)原电池、(-)Cu|HNO3(浓)|Al原电池等。
⑵负极是活泼电极,但是和电解质不反应,属于吸氧腐蚀类型。
选修4-原电池-学案(公开课)
第四章电化学基础第一节原电池班级:姓名:学习目标:1、体验化学能与电能相互转化的探究过程。
2、使学生进一步了解原电池的工作原理和构成原电池的条件。
3、探究简单原电池的缺点和改进,了解盐桥原电池的功能和价值。
学习重、难点:原电池的工作原理和探究简单原电池的缺点和改进。
学习过程1、原电池:将转变为的装置。
2、组成原电池的条件:a b 、c 、d 、3、原电池反应的实质:4、工作原理:负极反应:_______反应,_______电子;正极反应:_______反应,_______电子注意:①原电池中电子和电流沿导线流向相反。
②形成原电池后反应速率明显加快。
一、根据反应设计原电池负极:材料,电极反应Array正极:材料,电极反应电子流向电流流向外电路:Zn失去电子沿通过电流表进入铜片内电路:离子向着正极移动,离子向着负极移动。
二、体验原电池发现了什么问题?此原电池的缺点是什么?三、改进原电池1、盐桥原电池的组成——两个半电池、盐桥 盐桥:饱和 溶液(以 制作成 )盐桥的作用: ①②2、工作原理外电路:Zn 失去电子沿 通过电流表进入铜片内电路:Zn 原子失去电子成为Zn 2+进入溶液,使ZnSO 4溶液因Zn 2+增加而带正电,盐桥中的 会移向ZnSO 4溶液;同时H +获得电子生成H 2,使H 2SO 4溶液因H +的减少而带负电,盐桥中的 移向H 2SO 4溶液,从而形成闭合回路。
负极:材料 ,电极反应正极:材料 ,电极反应总反应电子流向 电流流向阳离子流向 阴离子流向思考:对比以上两个原电池,有盐桥原电池有什么优点?小结:将原电池反应中的氧化反应与还原反应分开在两个不同区域内进行,再以适当的方式 连接起来,从而获得了稳定持续的电流。
【反馈练习】根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe 2+(aq)=Zn 2+(aq)+ Fe(s)(1) 装置可采用烧杯和盐桥,画出此原电池的装置简图;(2) 注明原电池的正极和负极;(3) 注明外电路中电子的流向;(4) 写出两个电极上的电极反应。
4.1 原电池 学案(人教版选修4)
4.1 原电池学案(人教版选修4)4.1 原电池学案(人教版选修4)[学习目标] 1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.掌握构成原电池的条件。
3.能设计原电池装置。
[重点•难点]电极反应和电池反应方程式的书写。
1.原电池原理(1)概念:利用______________反应原理将________能转化为____能的装置。
(2)原电池工作原理(以锌铜原电池为例)装置示意图现象锌片________________,铜片上有____________,电流表指针发生________电极Zn电极Cu电极电极名称得失电子失电子得电子电子流向反应类型电极反应式总反应式2.原电池形成的条件(1)两个________不同的电极(材料可以是金属或非金属)负极:活泼性____,________电子发生氧化反应。
正极:活泼性____,________电子发生还原反应。
(2)电极均插入________________中。
(3)构成________________。
(4)能自发地发生的________________反应。
3.下列装置中,属于原电池的是()4.关于下图装置的叙述,正确的是()A.铜是阳极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原后生成H25.理论上,能自发进行的氧化还原反应均能设计成原电池。
实际设计时应该注意以下几方面。
(1)外电路负极(________________的物质)――→e-导线正极(2)内电路将两极浸入________________溶液中,使正、负离子作________________。
(3)闭合电路一、原电池的正负极的判断方法1.由组成原电池的两极材料判断较活泼的金属为____极,较不活泼的金属或能导电的非金属为____极。
2.根据电流方向或电子流向判断外电路中,电流由____极流向____极,电子由____极流向____极。
选修4原电池-导学案
原电池教学案【教学目标】重点:进一步了解原电池的工作原理,能够写出电极反应式和电池反应方程式。
难点:由两个半电池组成的原电池的工作原理。
【自学过程】§4.1 原电池1、原电池实验探究【问题探究】(1)3中锌片和铜片上变化的反应式和总的方程式怎样书写?Zn: ;Cu:总反应:(2)电子流动的方向如何一、原电池的概念:将转变为的装置1、正极负极的判断:负极:的一极正极:的一极【判断】上述装置中能形成原电池的是,该原电池工作时,负极发生,电极反应式为;正极发生,电极反应式为;电池总反应式为。
2、原电池的构成条件1)、2)、3)、 4)、3、原电池的原理:负极电子,发生反应。
正极电子,发生反应。
外电路移动形成电流,从极流向极。
内电路移动形成电流,流向,流向。
思考:如何根据氧化还原反应原理来设计原电池呢?例:请将氧化还原反应 2Fe3++ Cu = Cu2+ + 2Fe 2+设计成电池,画出装置图。
(标出电子移动方向,正负极,写出电极方程式和总方程式)4、原电池电极方程式的书写:正极反应:得到电子(反应)负极反应:失去电子(反应)【技巧】较繁电极反应式 = 总反应式 - 简单电极反应式练习练习1、写出下列原电池的电极反应式和原电池总反应式。
练习2、有A、B、C、D四种金属,将A与B用导线联结起来浸入稀H2SO4中,B极产生气泡,将A、D分别浸入等浓度盐酸中,D比A反应剧烈,将Cu浸入B的盐溶液中,无明显变化,如果把铜浸入C的盐溶液中,有金属C析出,据此判断它们的活泼性由强到弱的顺序是()(A)D、C、A、B(B)D、A、B、C(C)D、B、A、C(D)B、A、D、C练习3、如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中心滴入CuSO4溶液. 片刻后可观察到的现象是( )A.铁圈和银圈左右摇摆不定B.保持平衡状态不变C.铁圈向下倾斜D.银圈向下倾斜【新知预习】阅读教科书71—72页,填写下列空格:把氧化反应和还原反应分开在 ,从实验可以看到, 有 存在时电流表指针偏移。
高中化学 原电池教案 新人教版选修4
第四章 电化学基础第一节 原电池(导学案)【学习目标】:1、让学生体验化学能与电能相互转化的探究过程;2、使学生进一步了解原电池的工作原理和构成原电池的条件;3、能够写出电极反应式和电池反应方程式.【学习重点】:进一步了解原电池的工作原理,能够写出电极反应式和原电池反应方程式。
【学习难点】:原电池的工作原理【教学用具】:有关实验用品【学法指导】:比较法 归纳法 推理法【知识衔接】:回顾《必修2》原电池的定义、组成条件的有关知识【学习过程】:【引言】:我国计划在2020年左右实现“嫦娥登月”工程。
这项伟大的工程大家想一想离开了“电力系统”能否实现?如果不能给其提供持续稳定的电流能否顺利完成各项任务?我们在高中新课程标准必修2中已经初步学习了有关化学能与电能之间的相互转换必须通过一定的装置。
装置设计的合理性,对于能量的转换效率至关重要。
今天我们一起来探讨一下如何合理的设计原电池装置。
一、课前复习:(A 级)由练习引导学生复习必修2原电池的定义、组成条件等。
1、原电池定义:2、组成原电池的条件:3、原电池正、负极规律 ①负极——电子 的极。
通常是活泼性 的金属,发生 反应。
②正极——电子 的极。
通常是活泼性 的金属或非金属导体,发生反应。
【练习】:下列哪些装置能组成原电池?( )【实验探究】:请根据反应:Zn + CuSO 4 = ZnSO 4 + Cu设计一个原电池,并进行实验。
二、由实验导入新课:【实验探究】:通过系列探究性实验,以深化对原电池的原理的理解:【实验1】、将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,再同时浸入盛有硫酸铜溶液的烧杯中。
【思考】(指导学生观察现象并分析原理)电流表指针有没有偏转?指针稳定吗?两极上都有什么现象?【实验2】、将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片直接接触,然后浸入盛有硫酸铜溶液的烧杯中。
(指导学生观察现象并分析原理)普通干电池“神七”用 太阳能电池【思考】:上述实验装置构成了原电池吗?如果没有发生原电池反应,铜片表面为什么明显有红色的铜析出?如果发生了原电池,为什么电流表指针没有发生偏转?【设疑】:(B级)如何设计一个能持续产生电流、效率较好的原电池?【实验3】、p71实验4-1(指导学生观察现象并分析原理,点出半电池、盐桥、内电路、外电路等概念)【实验现象】:有盐桥存在时电流计指针发生偏转,即有电流通过电路。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池教学案
【教学目标】
重点:进一步了解原电池的工作原理,能够写出电极反应式和电池反应方程式。
难点:由两个半电池组成的原电池的工作原理。
【自学过程】
§4.1 原电池
1、原电池实验探究
【问题探究】
(1)3中锌片和铜片上变化的反应式和总的方程式怎样书写?
Zn: ;Cu:
总反应:
(2)电子流动的方向如何
一、原电池的概念:将转变为的装置
1、正极负极的判断:
负极:的一极正极:的一极
【判断】
上述装置中能形成原电池的是,该原电池工作时,负极发生,电极反应式为;正极发生,电极反应式为;电池总反应式为。
2、原电池的构成条件
1)、2)、
3)、 4)、
3、原电池的原理:
负极电子,发生反应。
正极电子,发生反应。
外电路移动形成电流,从极流向极。
内电路移动形成电流,流向,流向。
思考:如何根据氧化还原反应原理来设计原电池呢?
例:请将氧化还原反应 2Fe3++ Cu = Cu2+ + 2Fe 2+设计成电池,画出装置图。
(标出电子移动方向,正负极,写出电极方程式和总方程式)
4、原电池电极方程式的书写:
正极反应:得到电子(反应)
负极反应:失去电子(反应)
【技巧】较繁电极反应式 = 总反应式 - 简单电极反应式练习
练习1、写出下列原电池的电极反应式和原电池总反应式。
练习2、有A、B、C、D四种金属,将A与B用导线联结起来浸入稀H2SO4中,B极产生气泡,将A、D分别浸入等浓度盐酸中,D比A反应剧烈,将Cu浸入B的盐溶液中,无明显变化,如果把铜浸入C的盐溶液中,有金属C析出,据此判断它们的活泼性由强到弱的顺序是()(A)D、C、A、B(B)D、A、B、C
(C)D、B、A、C(D)B、A、D、C
练习3、如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中心滴入CuSO4溶液. 片刻后可观察到的现象是( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
【新知预习】阅读教科书71—72页,填写下列空格:
把氧化反应和还原反应分开在 ,从实验可以看到, 有 存在时电流表指针偏移。
盐桥中的盐溶液是 ,通常装有 。
当有盐桥存
在时,随着反应进行,盐桥中的 会移向 , 移向 ,使溶液保持 ,从而使原电池不断产生电流。
上述原电池由两个半电池组成,分别是: , 。
巩固练习:
1、把a,b,c,d4块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a,b 相连时,a 为负极;c,d 相连时,d 上产生大量气泡;a ,c 相连时,电流由c 经导线流向a ;b 、d 相连时, b 的质量不变,则此4种金属的活动性由强到弱的顺序为( )
A.a >b >c >d
B.a >c >d >b
C.c >a >b >d
D.b >d >c >a 2、将锌片和铜片用导线连接置于同一稀H2SO4溶液中,下列各叙述正确的是( ) A.正极四周SO 42-浓度逐渐增大 B.负极四周的SO 42-
浓度逐渐减小 C.负极四周的SO 42-浓度逐渐增大 D.正负极四周的SO 42-浓度基本不变
3、下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是( ) A.Cu 、Ag 、AgNO 3溶液 B.Zn 、Cu 稀H 2SO 4 C.Fe 、Zn 、CuSO 4溶液 D.Fe 、C 、Fe 2(SO 4)3溶液
4、据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池的容量更大,而且没有污染,其总反应式为:2Zn+O 2 2ZnO 所用原料为锌粒、电解液和空气.则下列叙述中,正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-
Zn 2+
C.正极发生氧化反应
D.电解液肯定不是强酸
5、铅蓄电池的两极分别为Pb 、PbO 2,电解液为H 2SO 4,工作时的反应为:Pb+ PbO 2 +2H 2SO 4=2PbSO 4 +2H 2O ,下列结论正确的是( )
A.Pb 为正极被氧化
B.PbO 2为负极被还原
C. SO 42-
只向PbO 2处移动 D.电解液密度不断减小 E.溶液的PH 不断减小 6、下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀H 2SO 4中,铜片表面出现气泡
B.把铜片插入FeCl 3溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴CuCl 2溶液,气泡放出速率加快
D.把铜片和铝片连接一起浸入浓HNO 3中,铝片表面有气泡产生.
思考:1、镁和铝一起用导线相连插入氢氧化钠中
(1)负极: .(2)正极: . 总反应:
2、铁和铜一起用导线相连插入浓硝酸中
(1)负极: .(2)正极: . 总反应:
Cu
ZnSO4
Zn
CuSO4。
