碱金属习题课件
【推选文档】第二章 碱金属习题课PPT

的称呼,所以答案B是不正确的。
(二)离子方程式的考查
题目(2004年全国考理科综合能力测试·山东卷).下列离 子方程式正确的是(D )
A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ === Ca2+ + 2H2O B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑ C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag D.大理石溶于醋酸的反应CaCO3 + 2HAc === Ca2++ AC- +CO2↑+
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该 反应的化学方程式是:2Na2O2+2SO2=2Na2SO3+O2
( 有2N)a2请SO设3。计一种取实白验色方固案体证,明加N稀a硫2O酸2与,产SO生2能反使应晶生红成溶的液白褪色色固的体气体中含 ( 还 白 色有 色 沉3)沉 淀N第a淀 不22S将溶小O解B4组生中,同成反证学。应明认为后有为检的NN验固aa22是体OS否O2溶与4有解生SNO于成a2反2水。S应BOa4除C生了l2成溶生,液成他稀N们a硝2设S酸O计仍3了和有如O部下2分外方白,案:
从近几年的高考看,主要侧重于下列二个方面:
(1)钠及其化合物的性质推断; (2)有关钠及其化合物的计算。后者主要出现在
选择题中。预计今后的考题还是以该族元素化 合物知识为载体考查有关概念、理论、实验和 计算的。赋分值会因涉及的考点的多少而不同, 也有可能以应用性选择题出现。
一、2004年全国高考《碱金属》知识点例析
H2O
分析:
八年级物理《碱金属》课件

实验步骤详解
1. 准备试剂与仪器
与酸反应实验
火焰颜色实验
3. 安全注意事项
与水反应实验
观察碱金属单质的外观和物理性质
准备好所需碱金属元素(如锂、钠、钾等)的单质或其化合物,以及相应的试剂(如酸、碱等)和实验仪器(如试管、烧杯、滴管、电子天平等)。
记录各碱金属单质的颜色、光泽、硬度等物理性质。
分别取少量碱金属单质,加入盛有水的试管中,观察并记录反应现象(如剧烈程度、颜色变化等)。
利用还原剂在高温下将碱金属离子还原为单质,如用金属钙还原氯化钾可得到金属钾。
利用某些有机溶剂对碱金属的选择性溶解作用,将碱金属从混合物中分离出来。
电解法
热还原法
溶剂萃取法
演示电解熔融氯化钠的实验,展示电解过程中产生的现象和产物。
01
演示电解熔融氯化钠的实验,展示Байду номын сангаас解过程中产生的现象和产物。
02
演示电解熔融氯化钠的实验,展示电解过程中产生的现象和产物。
THANK YOU
感谢聆听
演讲人姓名
202X.00.00
碱金属的碳酸盐易溶于水,且稳定性随金属活泼性增强而降低。例如,碳酸钠(Na2CO3)和碳酸钾(K2CO3)是常见的碱金属碳酸盐。
配合物及其性质
配合物的形成
碱金属离子可以与某些阴离子或分子形成配合物。例如,钠离子可以与氯离子形成氯化钠配合物(Na[Cl])。
配合物的性质
配合物通常具有与简单离子不同的物理和化学性质。例如,配合物的颜色、溶解度和稳定性等可能与相应的简单离子有所不同。此外,配合物在化学反应中可能表现出特殊的反应活性。
碱金属在自然界中存在形态及提取方法
第四章
存在形态
碱金属课件 (1)

子核对 最外层电子 的引力逐渐减弱,原子失电子的能力逐
渐 增强 。元素的金属性逐渐 增强,与水和氧气的反应 越来越 剧烈 ,生成的氧化物越来越 复杂。最高价氧化物对
应水化物的碱性越来越 强。
2、元素金属性强弱的判断依据(难点)
• 根据金属单质与水或者与酸反应置换出氢的难易程度。 • 根据金属元素最高价氧化物对应水化物碱性强弱。 • 根据对应阳离子的氧化性强弱判断。 3、碱金属元素物理性质的相似性和递变性
铯 Cs 55 略带金色光 1.879 28.40 678.4
泽,柔软
碱金属的物理性质的比较
Li Na K Rb Cs
相
颜色
均为银白色(Cs略带金色)
硬度 似
柔软
密度
较小
点
熔沸点
较低
导电导热性
强
递 变
密度变化 逐渐增大(K反常)
性 熔沸点变化 单质的熔沸点逐渐降低
重点内容
1、碱金属元素性质的相似性和递变性 相似性:最外层都有1个电子,它们的化学性质相似 递变性:碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着
取一小块钾,擦干表面的
钠在空气中 的燃烧
煤油后放应比较。
钾在空气中 的燃烧
钠、钾化学性质比较
钠
与氧气 在加热的条件下, 反应 钠在空气中燃烧,
火焰呈 黄 色,生 成 淡黄 色的固 体
钾 迅速燃烧,火 焰呈 紫 色
结论:钾比钠更容易燃烧,也就是钾比钠更容易 与氧气化合。
课堂练习:
1、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的
元素,下列预言错误的是: C
A.在碱金属中它具有最大的原子半径 B.它的氢氧化物化学式为FrOH,是一种极强的碱 C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物 D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发
碱金属课堂PPT

生产纯碱的方法: NaCl+NH3+H2O+CO2→NH4Cl+ NaHCO3↓ 应先通氨气,后通二氧化碳。
※碳酸钠与碳酸氢钠是重要的化 工产品。在玻璃制皂﹑造纸﹑纺 织等工业上有广泛的应用。
㈡鉴别碳酸钠与碳酸氢钠
固体:⒈加热,测质量是否变化
⒉看固体的形状 液体:⒈在饱和碳酸钠中,通 CO2是否有沉淀生成(为什么) ⒉通CaCl2,有沉淀生成的是 Na2CO3
化学方程式:Na2CO3(饱和) +H2O+CO2 → 2NaHCO3↓
1摩尔Na2CO3生成2摩尔的 NaHCO3, NaHCO3的溶解度 小于Na2CO3, NaHCO3过饱和, 因此,晶体析出,看到浑浊现 象。
甲基橙:碱性——黄色
中性——橙色
酸性——红色
6.3 碳酸钠和碳酸氢钠
㈠比较 俗名 溶解度 与酸反应 加热 Na2CO3 纯碱苏打 易溶 反应 无现象 NaHCO3 小苏打 可溶
细小白色晶体
物理性质 白色粉末
反应剧烈 受热分解
化学反应:
Na2CO3+2பைடு நூலகம்Cl → 2 NaCl+CO2+H2O NaHCO3+HCl → NaCl+CO2+H2O 2NaHCO3 → Na2CO3+ CO2+H2O NaHCO3+NaOH →Na2CO3 +H2O
㈢酸碱中和滴定
⒈实验仪器:铁架台﹑酸式滴定 管﹑碱式滴定管﹑锥形瓶 酸式滴定管:不能盛放HF与碱 性溶液。
碱式滴定管:不能盛放强氧化 剂与酸式溶液。
⒉指示剂 指示剂 石蕊
酚酞 甲基橙
变色范围 5~8 紫色 8~10 浅红色 3.1~4.4 橙色
第四章碱金属PPT优选课件

3
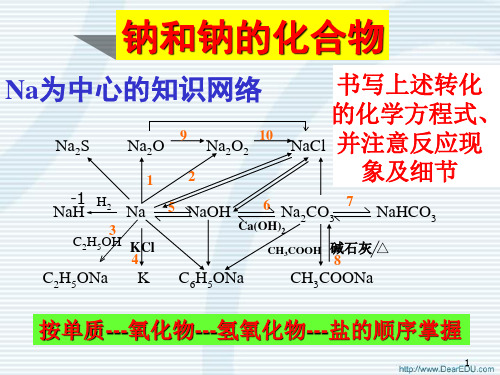
三.钠的化学性质
1.与氧气反应:
2. 常温: +1 -2 3. 4Na+O=2=2Na2O (白色)
氧化钠
点2N燃a:+O点2=燃=N+1a2O-(12 淡黄色)
2020/10/18
过氧化钠
沙头角中学 梁洪明
4
2. 与氯气、硫的反应
点燃
2 Na + Cl2 == 2 NaCl
研磨
2Na + S == Na2S
2020/10/18
沙头角中学 梁洪明
11
[练习]
1.钠在空气中长时间放置最终
将转化为_N__a_2C__O__3_.
有关化学方程式为:
(1)4Na+O2==2Na2O
(2)Na2O+CO2==Na2CO3
(3)2Na+2H2O==2NaOH+H2
(4)2NaOH+CO2==Na2CO3+H2O
2020/10/18
沙头角中学Байду номын сангаас梁洪明
12
2. 将一小块金属钠投入氯化铁 溶液中的化学方程式为:
6N—a+—6—H—2O—+—2—Fe—C—l3—=+—2_6F_—Ne_—(a_OC—_Hl_—+_)3—3_H—_2_— 离子方程式为:
6Na+6H2O+2Fe3+=2Fe(OH)3 ———————————+6—N—a—++—3—H—2 —
2020/10/18
沙头角中学 梁洪明
13
3. 将Na、Zn、Fe和Al四种金属
各0.2mol,分别投入100mL
无机化学第12章--碱金属、碱土金属课件

150.5 109.5 91.5 86.1 79.9 520.1 495.7 418.6 402.9 375.6
△Hh(M)/kJ·mol-1 △H (M) /kJ·mol-1
-514.1 -413.8 -342.8 -321.9 -297.1 163.1 197.3 175.1 165.1 158
ф 0.25 Be(OH)2 0.18 Mg(OH)2 0.15 Ca(OH)2 0.13 Sr(OH)2 0.12 Ba(OH)2
碱金属氢氧化物均为碱性,Be(OH)2为两性, 其它碱土金属氢氧化物为碱性。
12 - 3 盐类 12 - 3 - 1 盐类的共同特点
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐
自学指导(二)
1、作者运用哪几种方法去刻画人物的形象?从文 中找出具体句子进行分析。并说说你是如何看待这 两个人物的。 2、从这个故事中你懂得了什么道理?
陈尧咨(善射)
神态 忿然 笑而遣之
卖油翁(善酌)
睨之
语言 动作
汝亦知射乎 吾射不亦精乎 尔安敢轻吾射
笑而遣之
性格: 自矜(骄傲)
对比
无他,但手熟尔 以我酌油知之 我亦无他,惟手熟尔
氧化物热稳定性总的趋势是,同族从上到下依次降 低,熔点也按此顺序降低。
碱土金属离子半径较小,电荷高,其氧化物的晶格能 大,因而其熔点比碱金属氧化物的熔点高得多。
12 - 2 - 2 氢氧化物
1 氢氧化物性质
碱金属和碱土金属的氢氧化物都是白色固体。 Be(OH)2为两性氢氧化物,LiOH和Be(OH)2为中强 碱,其余氢氧化物都是强碱。 碱金属的氢氧化物都易溶于水,在空气中很容易吸潮, 它们溶解于水时放出大量的热。除氢氧化锂的溶解度稍 小外,其余的碱金属氢氧化物在常温下可以形成很浓的 溶液。
碱金属完整版ppt课件
干燥氢气,防止水分损失.
偏大. 12
思考: 若把钠投入到硫酸铜溶液中,可观察 到有蓝色沉淀生成。 那么钠为什么不能大量置换硫酸铜溶 液中的铜,却产生蓝色沉淀?由此推 测,钠和硫酸铜溶液发生了哪些反应?
13
3、钠与盐溶液反应
把小块金属钠分别投入饱和NaCl溶液、NH4Cl 溶液、CuSO4溶液的烧杯里的现象和反应
• 当过氧化钠遇到还原性物质如:I-、Fe2+、SO2、 SO32-等物质时,表现出氧化性,其还原产物是水 (或碱);当过氧化钠遇到强氧化性的物质如酸 性条件下的高锰酸钾,则过氧化钠体现出还原性, 其氧化产物为氧气。
21
1、过氧化钠的强氧化性
(1) Na2O2与SO3反应: Na2O2+SO3=Na2SO4 (2) Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+, 同时生成Fe(OH)3沉淀 (3) Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液 变浑浊。 (4)Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42(5) Na2O2投入品红溶液中,因其有氧化性,所以有漂 白性,可使品红溶液褪色.
30
Na2O2和NaHCO3两固体混合物于密闭容器中 加热后残留固体的成分判断
当两种固体加热时,NaHCO3先分解,所产生的H2O和 CO2均能被Na2O2吸收,在此可以看成Na2O2先吸收CO2 生成Na2CO3,而后再吸收H2O生成NaOH。同时注意分 解时的温度,若在100℃以上,H2O是以气态形式存在, 但不管是什么温度,产生的气体中总有O2存在。
SiO2 + 2NaOH === Na2SiO3 + H2O 盛装NaOH的试剂瓶不能用玻璃塞。
36
第2章碱金属(第二课时)共16页文档

③在空气中迅速被氧化从锂到铯反应越来越剧烈, 生成物越来越复杂: 锂:氧化物 钠:氧化物;过氧化物 钾、铷、铯:比过氧化物更复杂的氧化物。
铷或铯放入水槽中发生爆炸
练习 [例题]将2.3g钠投入水中,使所得溶液中每9个水分 子中有1个Na+,需要多少克水?
基本反应: NH3+CO2+H2O=NH4++HCO3-
NH3+CO2+H2O=NH4++HCO3-
总反应:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
△ 2NaHCO3
Na2CO3+CO2↑+H2O
补充知识3 钠的其他化合物
化学式
俗名
NaCl
食盐
NaNO3 Na2SiO3
智利硝石 水玻璃
Na2SO4·10H2O Na2S2O3·10H2O
芒硝
大苏打、海 波
用途
调味料、化工原 料 氮肥
去污、耐火材料、 矿物胶 缓泻剂
照相定影剂
HCl或Cl2 HCl
Na2O
O2 O2l
O2
HCl
Na2O2
HCl
CO2
H2O
NaOH CO2 Na2CO3
Ca(OH)2 H2O
②递变性: 电子层数: Li<Na<K<Rb<Cs 原子半径Li<Na<K<Rb<Cs
⑵碱金属的物理性质
①相似性:银白色(铯略带金色);硬度小;密 度小;熔点低;导热、导电
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱金属习题唐荣德一、选择题1.关于氧化钠和过氧化钠的性质比较中,正确的是 ( B )A. 两者均为白色固体B. 过氧化钠比氧化钠稳定C. 过氧化钠可与水及二氧化碳反应,而氧化钠则不能D. 两者都具有漂白性2. 有关过氧化钠的叙述正确的是 ( AD )A. 可使品红溶液褪色B. 白色固体C. 碱性氧化物D. 离子化合物3.质量为1 g 的下列金属,分别与足量的盐酸反应,放出H 2最多的是 ( C )A. ZnB. FeC. AlD. Na4. 碳酸钠和碳酸氢钠各1 mol ,分别强热后,其产物与足量盐酸反应的结果是 ( BD )A. 放出的CO 2的量前者为后者的二分之一B. 放出的CO 2的量前者为后者的二倍C. 消耗盐酸一样多D. 消耗盐酸前者比后者多5. CO 2跟下列物质反应能产生O 2的是 ( C )A. NaOHB. Na 2OC. Na 2O 2D. Na 2CO 36. 下列混合物溶于水,所得溶液中溶质只有一种....的是 ( CD ) A. Na 2O 2和Na 2CO 3 B. Na 和NaCl C. Na 2O 和Na 2O 2 D. NaOH 和Na7.下列各组物质在一定条件下反应,不产生...氧气的是 ( B ) A. Na 2O 2和H 2O B. Na 2O 和H 2O C. KClO 3和MnO 2 D . Na 2O 2和CO 28.常温常压下,下列物质在空气里不发生...变化的是 ( B ) A. Na 2CO 3·10H 2O B. NaHCO 3 C. Na D. NaOH9.过氧化钠与足量NaHCO 3的混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是 ( C )A. Na 2CO 3和Na 2O 2B. Na 2CO 3和NaOHC. Na 2CO 3D. Na 2O 、Na 2O 2和Na 2CO 310.相同物质的量的碳酸钠和碳酸氢钠分别跟过量盐酸反应 ( C )A. 碳酸钠放出CO 2多B. 碳酸氢钠放出CO 2多C. 碳酸钠消耗盐酸多D. 碳酸氢钠消耗盐酸多11.除去混在碳酸钠粉末里的碳酸氢钠,最好的方法是 ( A )A. 加热B. 加盐酸C. 加石灰水D. 加氯化钡溶液12.少量金属钠在空气中长期放置,最终生成的物质是 ( D )A. Na 2OB. Na 2O 2C. NaOHD. Na 2CO 313.碱金属溶于汞可形成良好的还原剂“汞剂”。
取某种碱金属的汞剂4.6 g 投入足量水中产生2.24 L 气体(标准状况),并得到密度为ρ g / mL 的溶液1 L ,则该溶液中溶质的质量分数为 ( C )A . %12.1ρB . %8.0ρC . %48.0ρD . %24.0ρ解析:由反应方程式知,碱金属为0.2 mol ,故只可能是Li 。
14.某种混合气体,可能含有N 2、HCl 、CO , 把混合气体依次通过足量的NaHCO 3溶液和灼热CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积缩小。
最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。
以下对混合气体组成的判断,正确的是( C )A. 一定没有N2;CO和HCl中至少有一种B. 一定有N2、CO和HClC. 一定有N2;CO和HCl中至少有一种D. 一定有N2和HCl;没有CO二、填空题1.简答:①观察钾的焰色反应时,使用蓝色钴玻璃片的作用是。
①滤去黄色的光,避免钠所造成的干扰③NaOH溶液不能用磨口试剂瓶盛装:③2NaOH+SiO2=Na2SiO3+H2O2.(1) 用化学方程式表示:①防毒面具里有时用Na2O2为供氧剂的原因。
_________________________________________________________________。
2. ⑴①2Na2O2+2CO2=2Na2CO3+O23.在防毒面具里,常用过氧化钠作为氧气的主要来源,是因为它能和二氧化碳、水等物质发生反应,试写出反应的化学方程式。
_____________________________________________________,_______________________________________________________。
3. 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O =4NaOH+O2↑4.Na2O2是_______色的固体,它用在呼吸面具上和潜水艇里作为氧气的来源,其有关的化学方程式是_______________________________________________。
4. 淡黄;2Na2O2+2CO2=2Na2CO3+O25.称取一定质量的含不同杂质的纯碱溶于水后与适量盐酸反应,跟同质量不含杂质的纯碱相比(填多或少)⑴若纯碱中含小苏打,则盐酸用量_____,产生气体的量______;⑵若纯碱中含碳酸钾,则盐酸用量_____,产生气体的量______;⑶若纯碱中含氯化钠,则盐酸用量_____,产生气体的量______;⑷若纯碱中含碳酸氢钙,则盐酸用量_____,产生气体的量______。
5.⑴少;多⑵少;少⑶少;少⑷少;多6.世界著名制碱专家,我国化学家侯德榜改进了传统的制碱工艺,不仅制得了纯度高的纯碱,还得到了另一化工产品氯化铵,此法就是著名的侯氏联碱法,其生产流程可表示为:(1) 写出生产过程②和③化学方程式。
(2) 操作②为什么能够进行?说明理由。
(3) 操作①、②的顺序能否颠倒?为什么?6. (1) NaCl+NH3+H2O+CO2 =NH4Cl+NaHCO3↓;2NaHCO3Na2CO3+H2O+CO2↑(2) NH4Cl、NH4HCO3、NaCl、NaHCO3四种物质中,NaHCO3溶解度最小,而溶液中各离子浓度大,NaHCO3大量沉淀,所以能进行(3)不能颠倒;因为CO2溶解度小,先通入CO2溶解量很小,再通入NH3时,由于NH3溶解度很大而生成(NH4)2CO3,且量少不能和NaCl反应。
7.某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
(上海高考97.31)上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。
甲管有刻度(0—50 mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):。
(2)装置C中放入的反应物是和。
(3)装置B的作用是。
装置A的作用是。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意和(填写字母编号)a.视线与液面最低处相平b.等待片刻,待乙管中液面不再上升时,立即读数c.读数时应上下移动乙管,使甲、乙两管液面相平d.读数时不一定使甲、乙两管液面相平7.(1)⑤③④⑥⑦②①⑧(⑥⑦顺序可对调)(2)大理石;盐酸(3)吸收混在O2中未反应的CO2;吸收CO2中混有的HCl (4) a、c8.在长期载人太空飞行的宇航器中,每个宇航员平均需要消耗0.9 kg氧气,呼出1.0 kg 二氧化碳。
为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。
有关反应的化学方程式是①②;将处理后的气体充入座舱时,应注意采取的一项措施是。
方法二;有的科学家根据电化学原理设计了飞船内空气更新实验系统,该系统结构示意图如下:(1) 管道①把飞船座舱中含较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的N 极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为 ,其电极产物吸收二氧化碳的离子方程式为 。
在N 极吸收二氧化碳后形成的离子会通过隔膜进入M 极室,通过M 极室的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的pH 值不变;该电极反应式为 ,二氧化碳逸出的离子方程式为 。
(2) 管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航员呼吸用。
在“电解水系统中”,Y 为 极(填“阴”或“阳”),X 极的电极反应式为 。
(3) 逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。
在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体。
请评价这样处理的重要意义 。
8. (1) 方法一:① 2Na 2O 2+2CO 2=2Na 2CO 3+O 2;② 2Na 2O 2+2H 2O =4NaOH +O 2↑;补充适量的水蒸气 方法二:(1) 2H 2O +O 2+4e =4OH -;CO 2+2OH - =-23CO +H 2O ;2H 2+4OH --4e -=4H 2O ;-23CO +H 2O =2OH -+CO 2↑; (2) 阴;4OH --4e -=2H 2O +O 2↑; (3)生成的甲烷可做飞船的气体燃料,体现了物质的循环使用和充分利用。
9.下图装置中,容器甲内充入0.1 mol NO 气体,干燥管内装有一定量Na 2O 2,从A 处缓慢通入CO 2气体。
恒温下,容器甲中活塞缓慢由B 向左移动,当移至C 处时容器体积缩小至最小,为原体积的109。
随着CO 2的继续通入,活塞又逐渐向右移动。
(1) ① 已知当活塞移至C 处时,干燥管中物质的质量增加了2.24 g 。
此时,通入标准状况下的CO 2气体多少升?容器甲中NO 2转化为N 2O 4的转化率是多少?② 活塞移至C 处后,继续通入a mol CO 2,此时活塞恰好回至B 处。
则a 值必小于0.01,其理由是 。
(2) 若改变干燥管中Na 2O 2的量,可通过调节甲容器的温度及通入CO 2的量,使活塞发生从B 到C ,又从C 到B 的移动。
则Na 2O 2的质量最小值应大于 g 。
9.(1) ① 1.792 L ;25% ② 由于Na 2O 2消耗完毕,通入CO 2活塞向B 移动(气体由0.09 mol 增到0.1 mol )使体积增大,平衡左移,气体物质的量增加,故a <0.01 (2) 1.56 g 解析:(1) 2CO 2+2Na 2O 2=2Na 2CO 3+O 2 ∆n0.08 0.04 2824.2=0.08 molV (CO 2)=0.08 mol ×22.4 L / mol =1.792 L2NO +O 2=2NO 2 2NO 2N 2O 4 ∆n0.08 0.08 0.02 0.02 0.1-0.09=0.01α(NO 2)%=08.002.0×100%=25%(2) 设Na 2O 2的物质的量的最小值为n mol ,假设NO 2全部转化为N 2O 4。
