有机化学习题课
有机化学课件(药学专业)-习题课
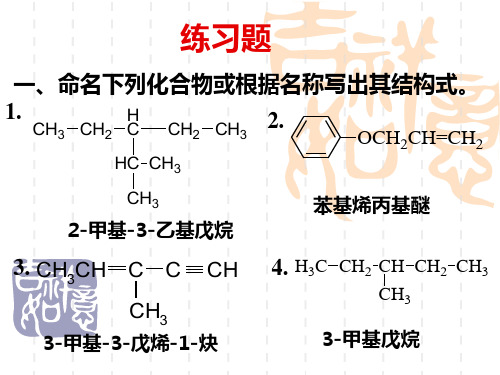
邻苯二甲酸酐
3-乙基-4-硝基苯酚
17.
O
O
O
18.
CH 3 CH =CH CH 2 CH 2 CHO
丁二酸酐
4-己烯醛
19 .
21.
CH 3 CH 2 CH 2 NCH 2 CH 3 CH 3
20.
Br C C Cl
Cl H
甲基乙基丙基胺
CH 3 Br H H Br C2 H5
Z-1,2-氯-1-溴乙烯 22.
28.酰卤和酸酐是常用的酰化剂。 29. 重氮盐的重氮基被取代的反应又叫放氮反应, 偶联反应又叫留氮反应。 30.与HO-NO作用生成致癌物的是叔胺。 31.糖尿病人的尿液能与费林试剂作用,产生砖红 色沉淀。 32. -D-甘露糖和-D-甘露糖既是非对映异构体, 又是端基异构体。 33.呋喃、噻吩、吡咯的亲电取代反应往往需在温 和条件下进行。 34.嘌呤是由咪唑环与嘧啶环稠合而成的有机化合 物。
四、完成下列反应式 1.
CH 2 CHCH 2 CH 3 Cl NaO H,C 2 H 5 O H
2.
NaOH,C 2 H 5 OH
(CH 3 ) 2 CH CHBrCH 3
3.
H 3C H Br
ROOR
4.
O
5.
(CH 3 ) 2 CHO H
H 2 SO 4 65℃
CHO
OCH 3
浓NaOH
6.
CH 2 C OOH
(2R,3S)-2-氯-3-溴戊烷
3-羧基-3-羟基戊二酸
11.
CH O OH
12 .
N CH 2 CH 3 CH 3
2-羟基苯甲醛
N-甲基-N-乙基苯胺
13 .
浙大有机化学复习习题课2-完成反应式

有机化学习题课有机化合物的命名有机化合物的命名。
基本概念与理化性质比较。
完成反应式。
有机化学反应历程。
有机化合物的结构推导有机化合物的合成。
有机化合物的结构推导。
有机化合物的合成完成反应式这是一类覆盖面宽、考核点多样化的试题,解答这类问题应该考虑以下几个方面:问题应该考虑以下几个方面()(1)确定反应类型;(2)确定反应部位;(3)考虑反应的区域选择性;(4)考虑反应的立体化学问题;考虑反应的立体化学问题()(5)考虑反应的终点……等问题。
第4章:碳碳重键的加成1.亲电加成反应(卤素,卤化氢,硫酸和水,加次卤酸)。
水加次卤酸)硼烷加2.乙硼烷加成反应。
3.环加成反应。
4.与氢的加成。
与氢的加成5.氧化反应。
6.小环加成。
7.共轭双烯的反应。
共轭双烯的反应8.炔烃酸性,炔钠的生成,重金属炔化合物的形成。
物的第5章自由基反应1.自由基取代反应。
2.自由基加成反应。
第6章芳香烃1.苯的亲电取代反应(卤化,硝化,磺化,付克反应,氯甲基化)。
2.芳烃的侧链反应。
3.萘的化学反应(卤化,磺化,硝化,氧化)。
第8章卤代烃1.亲核取代反应(水解反应,氰化钠,醇钠,氨,硝酸银,水解反应氰化钠醇钠氨硝酸银卤离子)。
2.消除反应(脱卤化氢,脱卤素,脱水)。
3.格氏反应。
第醇酚醚9章醇、酚、醚1.醇羟基的反应(羟基的取代, 脱水反应, 氧化与脱氢)。
2.邻二醇的氧化。
3.邻二醇的重排。
4.酚的反应(酸性,酚醚生成,酯的生成,与三氯化铁反应,环上取代反应,氧化反应)。
5.醚的反应(盐的生成,醚键断裂,过氧化物生成)。
6.环氧化合物开环反应(酸性,碱性)环氧化合物开环反应(酸性碱性)第10章醛、酮1.亲核加成反应(含碳亲核试剂, 含氧亲核试剂,含硫亲核试剂,,,含氮亲核试剂)。
2.还原反应(金属氢化物, 催化氢化,克莱门森还原, 黄鸣龙, 康尼查罗)。
3.氧化反应(Bayer-Villger)。
4.α-碳上反应(酸性,卤化,卤仿反应,烷基化,缩合反应)。
第二学期有机化学习题课

(CH3)2CHCH CH2 + H
Cl (CH3)2C CHCH3
H
(CH3)2CHCHCH3 Cl
(CH3)2CCH2CH3 Cl
Cl (CH3)2CCH2CH3
第二十一页,共33页。
AlCl3 + CH3CH2CH2Cl
CH CH3 CH3
亲电取代---碳正离子重排
CH3CH2CH2Cl + AlCl3 _ AlCl4 CH3CH2CH2
第三十三页,共33页。
C(CH3)3
(A) CH3CH2CH2 (B) CH3CHCH3 (C) CH3CCH3 (D) CH3
CH3
5、将下列碳正离子按稳定性由大到小排序(BCAD)
6、下列化合物与Br2加成,由快到慢排序 (BCA)
(A) CF3CH CH2 (B) CH3CH CH2 (C) CH2 CH2
第七页,共33页。
7、将下列烯烃按稳定性由大到小排列成序(BACD) 8、下列化合物与HBr加成活性由大到小排序 (DBAC)
CH2CH2Cl
CHClCH3
A.
B.
C.
Cl
C2H5
17、下列化合物按SN1反应由快到慢排序 (BAC)
A.苄基溴 B. α-苯基乙基溴 C. β-苯基乙基溴
18、下列化合物在NaI/丙酮中反应由快到慢排序 (ABDC)
A. 3-溴-1-丁烯 B. 正溴丁烷 C. 1-溴-1-丁烯 D. 2-溴丁烷
环氧乙烷酸性开环
CH3 CH CH2 H CH3 CH CH2
O CH3OH
CH3 CH
O H CH2 - H
OCH3 OH H
CH3 CH CH2 OH
有机化学课后习题答案

第一章习题(一) 用简单的文字解释下列术语:(1)键能:形成共价鍵的过程中体系释放出的能量,或共价鍵断裂过程中体系所吸收的能量。
(2)构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(3)sp2杂化:由1 个s轨道和2个p轨道进行线性组合,形成的3个能量介于s轨道和p轨道之间的、能量完全相同的新的原子轨道。
sp2杂化轨道的形状也不同于s轨道或p轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(4)相转移催化剂:在非均相反应中能将反应物之一由一相转移到另一相的催化剂。
第二章饱和烃习题(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 1234567(2)123453-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)123456(4) 101234567892,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)1234乙基环丙烷2-环丙基丁烷(7)12345678910(8)123456789CH3 1,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)1234567(10) (C H3)3C C H25-异丁基螺[2.4]庚烷新戊基(11)H3C (12)C H3C H2C H2C H2C H C H32-甲基环丙基2-己基or (1-甲基)戊基(十) 已知环烷烃的分子式为C5H10,根据氯化反应产物的不同,试推测各环烷烃的构造式。
(1) 一元氯代产物只有一种(2) 一元氯代产物可以有三种解:(1) (2)C H3C H3(十一) 等物质的量的乙烷和新戊烷的混合物与少量的氯反应,得到的乙基氯和新戊基氯的摩尔比是1∶2.3。
试比较乙烷和新戊烷中伯氢的相当活性。
解:设乙烷中伯氢的活性为1,新戊烷中伯氢的活性为x ,则有:x123.261=15.1=x ∴ 新戊烷中伯氢的活性是乙烷中伯氢活性的1.15倍。
有机化学习题课(1-3章)

➢若环上连有支链时,支链作为取代基,其所在位次即 是环上碳原子的位次号,最后将取代基的位次和名称放 在“螺”之前。
16
桥环烷烃的命名:
和螺环烷烃的相似。
不同之处:
✓环上的编号是从一个桥头碳原子开始,沿最 长的桥到另一个桥头碳原子,再沿次长的桥编 回到开始的桥头碳原子,最短桥上的碳原子最 后编号。 ✓各桥的碳原子数由大到小分别用数字表示。
其中,CH3OCH3的C-O-C键角不是180°。
5
九、化合物按碳架和官能团分类(P23)
(1)脂肪族 卤代烷 (2)脂肪族 羧酸
(3)杂环族,四氢吡咯 (4)脂环族,酮
(5)芳香族,醚
(6)芳香族,醛
(7)脂肪族,胺
(8)脂肪族,炔
(9)脂环族,醇
例如: 呋喃
呋喃甲醛 (糠醛)
吡啶
(参见第十七章)
24
1、烯炔的命名——特别注意两点
① 所有烯炔的名称中主链的碳数必须放在烯前。 ② 若双键和三键处于相同的位次供选择时,优先给 双键最低编号。 例如:
1-戊烯-4-炔
25
习题 3.1 命名下列化合物(P73)
(1)
(2)
2,5-二甲基-3-己烯
2,6-二甲基-4-辛烯
(3)
3-己炔 (二乙基乙炔)
(1)E>A>B>C>D
(2)F>G>E>H>D>C>B>A
(3)D>B>C>A 14
第二章 脂环烃
命名规则不清
15
螺环烷烃命名:
➢两个碳环共有的碳原子称为螺原子,以螺作为词头, 按成环的碳原子总数称为“某烷”。
有机化学B习题课-期中

类似:烯烃及芳香烃的α-卤代
12
化学性质
烯烃马氏:Cl2,HCl,H2SO4(会水解成醇), Br2+H2O,Br2+NaCl/H2O
炔烃马氏:Cl2(FeCl3),HCl(HgCl2,加热),H2O (H2SO4/HgSO4, 会烯醇异构)
烯烃,炔烃反马氏: HBr自由基加成;B2H6+H2O2/OH-/H2O 加成速率:双键上电子云密度越大,即给电子基越多 越易加成 13
有机化学习题课
1
考试题型
一、回答问题(28%) 命名、构型构象、对映体、自由基稳定性、 反应速率及反应活性、熔沸点、定位效应 二、写出反应的主产物(23%) (必要时请注明立体化学问题) 三、推测结构、鉴别(10%) 四、机理题 (15%) 五、合成题(24%)
2
命名
(3Z,5E)-2-甲基-3,5-辛二烯 编号位置使双键尽可能小
10
化学性质
烷烃的卤化反应
反应条件:光照、高温或催化剂
反应机理:自由基
反应活性:叔氢 〉仲氢 〉伯氢 卤原子的选择性:I>Br>Cl>F
CH3CHCH3 + Br2 CH3 hv 127 (CH3)2CHCH2Br + (CH3)3CBr <1% >99%
11
V(1 H):V(2 H) : V(3 H) =1:82:1600
强
中
NR2 OR R
NHR
NH2
OH
NHCOR C6H5
OCOR X
20
弱
苯环的定位基团
第二类定位基(间位定位基)(钝化) 中
强
NR3 CHO
NO2 COR
有机化学课后习题及答案(第五章)

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
大学《有机化学》课后习题答案

第一章绪论2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2第二章有机化合物的结构本质及构性关系1.(1) sp3(2) sp (3) sp2(4) sp (5) sp3(6)sp2第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(12) 3-甲基-1-庚烯-5-炔2.7.11.14. (5) > (3) > (2) >(1) > (4) 即: CH 2=CHC +HCH 3 >(CH3)3C +>CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC +H 216. (1)(2)(3)17.21AB.10.(1)CH 3-CH=CH 2−−−−−→−+H /KMnO 4CH 3COOH(2)CH 3-C ≡CH+HBr (2mol ) CH 3CBr 2CH 3(3)CH 3-C ≡3-C=CH 2−−→−2Br CH 3CBr 2CH 2Br Br第四章 环 烃 2.1-戊烯 1-戊炔 戊 烷Br 2/CCl 4室温,避光√ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷Br 2/CCl 4 室温,避光√溴褪色 × Ag(NH 3)2+√灰白色↓ × × 1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4√ 溴褪色 √ 溴褪色 × Ag(NH 3)2+×√ 灰白色↓C(CH 3)3CH 3(1)(2)(3)3.(1)反式CH 3Br(3)顺式4.C H 3B rC lC l +C l C lC O O HH 3CO 2N (C H 3)3C C O O H(1)(2)(3)(4)(5)(6)(7) B rC 2H 5C 2H 5B r +C H 3C O C H 3(C H 3)2C C H (C H 3)2B r(8) 1molCl 2 / h , 苯/无水AlCl 3N H C O C H 3N O 2C H 3C H 3S O 3H (9) (10)7. (2)有芳香性 10.第六章 旋光异构6-32. (1)× (2)× (3)× (4)√ (5)√ (6)√7.2.66120678.58.18][20+=⨯÷+=⨯=l c Dαα第七章 卤 代 烃2、C l C lC l (2)4、第八章 醇、酚、醚1. (1) 3-甲基-3-戊烯-1-醇 (2) 2-甲基苯酚 (3) 2,5-庚二醇 (4) 4-苯基-2-戊醇 (5) 2-溴-1-丙醇 (6) 1-苯基乙醇(7) 2-硝基-1-萘酚 (8) 3-甲氧基苯甲 (9) 1,2-二乙氧基乙烷(乙二醇二乙醚)(1)(2)3、4. (1) 甲醇 分子间氢键 (6) 邻硝基苯酚 分子内氢键、分子间氢键 5、(1)CH 2IH 3COOH(5)(6)HOOCH 3H(7)6、AgNO 3/乙醇,室温白↓× ×AgNO 3/乙醇,加热白↓×OH+OHBrBr(1)(2)10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲酸
R-OH + HBr (CH3)2 CH 45 R2CHX S N1 , S N2 (CH3)3 C 108 R3CX S N1
CH3CH2 1.7 RCH2X S N2
V相对
结论
CH3X S N2
烯丙型、苯甲型卤代烷是1oRX,但其SN1和SN2 反应都很易进行。
RX 相对V SN2 CH3CH2X 1 CH2=CHCH2X 40 SN2:过渡态稳定
SN2:不利于Nu :从背面进攻
1、本小题5分 比较下列化合物在无水丙酮中与NaI反应活性的大小: (A) (CH3)3CCH2Br (B) CH3Br (C) (CH3)2CHBr
2、本小题5分 将下列化合物按与AgNO3醇溶液反应快慢排序: (B) (CH3)3CCl (C) CH3CH2CH2CH2Cl
例1
例2
2-甲基-2-丁烯 80%
2-甲基-1-丁烯 20%
卤烷脱卤化氢时,氢原子往往是从 含氢较少的碳原子上脱去的 。 在大多数情况下,卤烷的消除 反应和取代反应同时进行,而且相互竞争,哪种反应占优势 则与分子的结构和反应条件有关。
查依采夫规则——
(CH3)2C=CHCH3
与金属镁的反应 卤代烷与镁作用,生成有机镁化合物RMgX的反应, 是法国化学家格利雅在1900年发现的。所以把这种有机 镁化合物称为格利雅试剂,简称格氏试剂。通常采用 RX与金属Mg在无水乙醚中进行反应,制格氏试剂产率 达85%-95%。
碳正离子
CH 2
CH3
CH 3 C Br CH 3
慢
CH3
Cδ…… Br CH 3
δ
CH3
CH 3 C CH 3+ NhomakorabeaBr
-
过渡态(1)
CH3
CH 3 C CH 3
+ OH
-
快
δ δ CH3 C …… OH
CH 2 CH 3
CH3
CH 3 C OH CH 3
2) 过渡态 (
SN1反应与SN2反应的区别
醇和酚
醇反应性的总分析
氧化反应
形成氢键 羊盐 形成金
H C H
脱 水 反 应 取 代 反 应
酸性(被金属取代)
C
O
H
1. 醇和氢卤酸的反应
反应式 ROH + HX 醇活性的比较: 苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH HX的活性比较: HI > HBr > HCl RX + H2O
RMgX +
CH2=CHCH2Br +
格氏试剂的应用(总结)
R COOH 羧酸 OH O 1.CO2 1.HCHO RMgX R CH R R CH2OH 2.H2O R CH 2.H3O 2°醇 1°醇 醛 OH 1. O R MgX O R CH2CH2OH RMgX R C R' R'COOR'' 2.H3O R Li R CR' 1°醇 R 酮 醇 3° OH 1.R'COR'' O 1.R'CHO OH RMgX R'COCl 2.H O R CHR' 3 R CR' 2.H3O R C R' 1. R'CN 2°醇 R 酮 OH 2.H3O 3°醇 R C R' O 第2步生成叔醇, R'' R CR' 2个支链是一样 的! 3°醇 酮 O H COR'
键的反应,称为消除反应,用E表示。该反应在有机合成上 常作为在分子中引入碳碳双键和碳碳三键的方法。 卤烷脱卤化氢的难易与烃基结构有关:
叔卤烷最易,仲卤烷次之,伯卤烷最难
叔卤烷和仲卤烷在脱卤化氢时可能得到两种不同的消除产物。
CH3-CH2-CH-CH3 Br CH3CH=CHCH3 (81%) KOH-C2H5OH CH3CH2CH=CH2 (19%)
SN1 单分子反应 V = K [ R-X ] 两步反应 有中间体碳正离子生成 构型翻转 + 构型保持 有重排产物 SN2 双分子反应 V = K [ R-X ] [ Nu:] 一步反应 形成过渡态
构型翻转(瓦尔登转化) 无重排产物
(
)(写构型式)
1 烷基结构的影响
烷基结构对SN2的影响
VCH X > V1 RX > V 2 RX > V 3 RX
3 o o o
R-Br + IR: CH3 150 CH3CH2 1
RI + Br (CH3)2 CH 0.01 (CH3)3 C 0.001
V相对
考虑位阻效应 碳上取代基增加也影响SN2的反应
烷基结构对SN1的影响
V3 o RX > V2 RX > V1 RX > VCH X
o o 3
R-Br + H2O R: CH3 1
13、本小题2分
双分子亲核取代反应(SN2)机理
(1)反应历程
一步完成(新键的形成和旧键的断裂同步进行),无中间体 生成,经过一个不稳定的“过渡态”。
H
HO +
H H
C
Br
δ δ HO … C … Br
H
H HO C H H
+ Br
HH 过渡态
单分子亲核取代反应(SN1)机理
(1)反应历程
两步反应(SN1反应是分两步完成的)
R’ON a NaCN
HCCNa NH3
R’COON R’COOR 酯 a AgONO2 类 RONO2 硝酸酯+AgX NaI RI + NaX
卤代烃的SN反应在有机合成上有重要用途
消除反应(Elimination reaction)
1. 脱卤化氢
消除反应——这种从分子中失去一个简单分子生成不饱和
卤代烷
烷烃 各种有机 化合物
R-X
烯烃
金属化合物
通式:
中心碳原子
RCH2–L + Nu:
底物 受进攻 的对象 (进攻基团) 亲核试剂
RCH2–Nu + L:
产物 离去基团
一般是负离子或带孤电子 对的中性分子
NaOH
ROH 醇类 ROR’ 醚类 RCN 腈类 RCCH 炔类 RNH2 胺类
烷烃、烯烃、炔烃 R-X
CH2X
120
SN1:C+稳定
苯型(芳香卤代烃)、乙烯型卤代烃较难发生SN反应。
X
SN1: C-X键不易断裂
CH2=CH X
SN2:不能发生瓦尔登转化
桥头卤素,不利于SN反应(比苯型、乙烯型卤代烃 更难)
(CH3)3CBr
相对V
13
Br
Br
Br
SN1
1
10-3
10-6
10-
SN1:不利于形成平面结构
例如:
R-X + Mg
无水乙醚
RMgX
X = Cl 、Br
CH3Br + Mg
无水乙醚
CH3MgBr 甲基溴化镁
格氏试剂的反应
HOH R-OH ′ HNH2 HX R-C ′ CH
R-H + R-H + R-H + R-H + R-H +
Mg Mg Mg Mg Mg
OH X OR X NH2 X X X X C CR ′ ′ 烷烃的制备方法之一
