晶体结构课件20
合集下载
XRD晶体结构分析 ppt课件

衍射点是分立、不连续的,只在某些方向出现
Bragg方程
晶体的空间点阵可划分成平行且等间距的面网。它们是
一组相互平行、等间距[d(hkl) ]、相同的点阵平面
法线
P Q R 1θ
2
R' Q' P' θ
d(hkl)
d(hkl) 3
平面点阵对X-射线的散射
要保证产生衍射,则必须:PP’ = QQ’ = RR’,这就 要求:入射角和散射角相等,而且入射线、散射线和点 阵平面的法线在同一个平面 上。
❖ X-射线管发出的X-射线束并不是单一波长的辐射 ❖ X-射线谱——X-射线随波长而变化的关系
叠加
强度随波长连续变化的连续谱 波长一定、强度很大的特征谱
管电压 X射线连续谱的强度 最大强度对应波长
最短波长界限
特征谱
当管电压超过一定值 (激发电压Vk)
只取决于阳极靶材料
XRD晶体结构分析
特征X-射线——线性光谱,由若干分离且具有特定波长的谱线组成 强度大大超过连续谱线的强度,可迭加于连续线谱之上
XRD晶体结构分析
XRD晶体结构分析
XRD晶体结构分析
XRD晶体结构分析
晶体
多晶(玻璃)
非晶(液体)
长程有序 +
短程有序
长程无序 +
短程有序
长程无序 +
短程无序
XRD晶体结构分析
均一性
稳定性
各向异性
最小内能性
对称性
自限性(自范性)
晶体的根本特征:在于它内部结构的周期性
XRD晶体结构分析
面角守恒定律
同一物质的不 同晶体,其晶 面的大小、形 状、个数可能 不同,但其相 应的晶面间的 夹角不变。
Bragg方程
晶体的空间点阵可划分成平行且等间距的面网。它们是
一组相互平行、等间距[d(hkl) ]、相同的点阵平面
法线
P Q R 1θ
2
R' Q' P' θ
d(hkl)
d(hkl) 3
平面点阵对X-射线的散射
要保证产生衍射,则必须:PP’ = QQ’ = RR’,这就 要求:入射角和散射角相等,而且入射线、散射线和点 阵平面的法线在同一个平面 上。
❖ X-射线管发出的X-射线束并不是单一波长的辐射 ❖ X-射线谱——X-射线随波长而变化的关系
叠加
强度随波长连续变化的连续谱 波长一定、强度很大的特征谱
管电压 X射线连续谱的强度 最大强度对应波长
最短波长界限
特征谱
当管电压超过一定值 (激发电压Vk)
只取决于阳极靶材料
XRD晶体结构分析
特征X-射线——线性光谱,由若干分离且具有特定波长的谱线组成 强度大大超过连续谱线的强度,可迭加于连续线谱之上
XRD晶体结构分析
XRD晶体结构分析
XRD晶体结构分析
XRD晶体结构分析
晶体
多晶(玻璃)
非晶(液体)
长程有序 +
短程有序
长程无序 +
短程有序
长程无序 +
短程无序
XRD晶体结构分析
均一性
稳定性
各向异性
最小内能性
对称性
自限性(自范性)
晶体的根本特征:在于它内部结构的周期性
XRD晶体结构分析
面角守恒定律
同一物质的不 同晶体,其晶 面的大小、形 状、个数可能 不同,但其相 应的晶面间的 夹角不变。
认识晶体(完整版)ppt课件

第一节
认识晶体
精选ppt
1
一、晶体的特性
1.晶体与非晶体
(1)晶体:内部微粒(原子、离子或分 子)在空间按一定规律做周期性重复 排列构成的固体物质。
非晶体:内部原子或分子的排列呈现杂 乱无章的分布状态。
精选ppt
2
2.晶体的特性
(1)具有规则的几何外形。
(2)自范性:在适宜条件下,晶体能够 自发地呈现封闭的、规则的多面体外形。
练习1:根据离子晶体的晶胞结构,判断下 列离子晶体的化学式:(A表示阳离子)
A B
化学式: AB
精选ppt
31
Hale Waihona Puke 练习2:根据离子晶体的晶胞结构,判断下 列离子晶体的化学式:(A表示阳离子)
A B
化学式: A2B
精选ppt
32
练习3:根据离子晶体的晶胞结构,判断下列 离子晶体的化学式:(A表示阳离子)
顶 ----1/8 棱----1/4 面----1/2 心----1
精选ppt
38
2001年报道的硼和镁形成的化合物刷新了 金属化合物超导温度的最高记录。如图所 示的是该化合物的晶体结构单元:镁原子 间形成正六棱柱,且棱柱的上下底面还各 有1个镁原子,6个硼原子位于棱柱内。则 该化合物的化学式可表示为
微粒数为:8×1/8 + 6×1/2 = 4
(3)体心立方:在立方体顶点的微粒 为8个晶胞共享,处于体心的金属原 子全部属于该晶胞。
微粒数为:8×1/8 + 1 = 2 长方体晶胞中不同位置的粒子对晶胞的贡献:
顶点 ----1/8 棱----1/精4选ppt 面----1/2 心----1 25
精选ppt
微粒数为:12×1/6 + 2×1/2 + 3 = 6
认识晶体
精选ppt
1
一、晶体的特性
1.晶体与非晶体
(1)晶体:内部微粒(原子、离子或分 子)在空间按一定规律做周期性重复 排列构成的固体物质。
非晶体:内部原子或分子的排列呈现杂 乱无章的分布状态。
精选ppt
2
2.晶体的特性
(1)具有规则的几何外形。
(2)自范性:在适宜条件下,晶体能够 自发地呈现封闭的、规则的多面体外形。
练习1:根据离子晶体的晶胞结构,判断下 列离子晶体的化学式:(A表示阳离子)
A B
化学式: AB
精选ppt
31
Hale Waihona Puke 练习2:根据离子晶体的晶胞结构,判断下 列离子晶体的化学式:(A表示阳离子)
A B
化学式: A2B
精选ppt
32
练习3:根据离子晶体的晶胞结构,判断下列 离子晶体的化学式:(A表示阳离子)
顶 ----1/8 棱----1/4 面----1/2 心----1
精选ppt
38
2001年报道的硼和镁形成的化合物刷新了 金属化合物超导温度的最高记录。如图所 示的是该化合物的晶体结构单元:镁原子 间形成正六棱柱,且棱柱的上下底面还各 有1个镁原子,6个硼原子位于棱柱内。则 该化合物的化学式可表示为
微粒数为:8×1/8 + 6×1/2 = 4
(3)体心立方:在立方体顶点的微粒 为8个晶胞共享,处于体心的金属原 子全部属于该晶胞。
微粒数为:8×1/8 + 1 = 2 长方体晶胞中不同位置的粒子对晶胞的贡献:
顶点 ----1/8 棱----1/精4选ppt 面----1/2 心----1 25
精选ppt
微粒数为:12×1/6 + 2×1/2 + 3 = 6
金属学热处理--金属的晶体结构 ppt课件

ppt课件
22
晶体结构与空间点阵
图1-3 晶体中原子排列示意图
a)原子堆垛模型 b)晶格 c)晶胞
ppt课件
23
晶体结构与空间点阵
从图中可以看出,原子在各个方向的排列都是 很规则的。这种模型的优点是立体感强,很直观; 缺点是很难看清原子排列的规律和特点,不便于研 究。为了清楚地表明原子在空间排列的规律性,常 常将构成晶体的原子(或原子群)忽略,而将其抽 象为纯粹的几何点,称之为阵点。这些阵点可以是 原子的中心,也可以是彼此等同的原子群的中心, 所有阵点的物理环境和几何环境都相同。由这些阵 点有规则地周期性重复排列所形成的三维空间阵列 称为空间点阵。
ppt课件
8
金属键
事实上,虽然它偶尔也能与别的元素形成离子 键,但它本身原子之间多以共价键方式结合。所谓 共价键,即相邻原子共用它们外部的价电子,形成 稳定的电子满壳层。金刚石中的碳原子之间即完全 以共价键结合。铜原子之间的结合,既不同于离子 键,也不同于共价键。
ppt课件
9
金属键
近代物理学的观点认为,处于集聚状态的金属 原子,全部或大部将它们的价电子贡献出来,为其 整个原子集体所公有,称之为电子云或电子气。这 些价电子或自由电子,已不再只围绕自己的原子核 转动,而是与所有的价电子一起在所有原子核周围 按量子力学规律运动着。贡献出价电子的原子,则 变为正离子,沉浸在电子云中,它们依靠运动于其 间的公有化的自由电子的静电作用而结合起来,这 种结合方式叫做金属键,它没有饱和性和方向性。
轴的正方向,反之为负方向。晶胞的棱边长度一般
称为晶格常数或点阵常数,在X、Y、Z轴上分别以a、
b、c表示。晶胞的棱间夹角又称为轴间夹角,通常
Y-Z轴、Z-X轴和X-Y轴之间的夹角分别用α、β和γ
金属学与热处理-1.2-金属的晶体结构课件.ppt

C
B
A
C
C层
B
A
A
ABABABAB ABCABCABC
B层 ACACACAC ACBACBACB
25
26
ABCA ABA
27
面心立方晶格密排面的堆垛方式 28
密排六方晶格密排面的堆垛方式
29
典型金属晶体中原子间的间隙
四面体空隙(tetrahedral interstice),由4个球体所构成, 球心连线构成一个正四面体; 八面体空隙(octahedral interstice),由6个球体构成,球 心连线形成一个正八面体。
r 3a 4
r 2a 4
ra 2
14
配位数与致密度
➢配位数和致密度定量地表示原子排列的紧密程度。 ➢配位数(coordination number,CN):晶体结构中 任一原子周围最近且等距离的原子数。 ➢致密度(K):晶胞中原子所占的体积分数,
K nv V
式中,n为晶胞原子数,v原子体积,V晶胞体积。
22
晶体中原子的堆垛方式
面心立方和密排六方结构的致密度均为0.74, 是纯金属中最密集的结构。 面心立方与密排六方虽然晶体结构不同,但配 位数与致密度却相同,为搞清其原因,必须研究 晶体中原子的堆垛方式。 面心立方与密排六方的最密排面原子排列情况 完全相同,但堆垛方式不一样。
23
24
A
A
C
B A
(11 1)
59
练习4:下图标注了立方晶体的4个晶面,在每个晶 面上给出了3个晶面指数,选择正确的答案。
60
ACF
FN
ABD’E’
A’F’
AFI
BC
ADE’F’
O’M
B
A
C
C层
B
A
A
ABABABAB ABCABCABC
B层 ACACACAC ACBACBACB
25
26
ABCA ABA
27
面心立方晶格密排面的堆垛方式 28
密排六方晶格密排面的堆垛方式
29
典型金属晶体中原子间的间隙
四面体空隙(tetrahedral interstice),由4个球体所构成, 球心连线构成一个正四面体; 八面体空隙(octahedral interstice),由6个球体构成,球 心连线形成一个正八面体。
r 3a 4
r 2a 4
ra 2
14
配位数与致密度
➢配位数和致密度定量地表示原子排列的紧密程度。 ➢配位数(coordination number,CN):晶体结构中 任一原子周围最近且等距离的原子数。 ➢致密度(K):晶胞中原子所占的体积分数,
K nv V
式中,n为晶胞原子数,v原子体积,V晶胞体积。
22
晶体中原子的堆垛方式
面心立方和密排六方结构的致密度均为0.74, 是纯金属中最密集的结构。 面心立方与密排六方虽然晶体结构不同,但配 位数与致密度却相同,为搞清其原因,必须研究 晶体中原子的堆垛方式。 面心立方与密排六方的最密排面原子排列情况 完全相同,但堆垛方式不一样。
23
24
A
A
C
B A
(11 1)
59
练习4:下图标注了立方晶体的4个晶面,在每个晶 面上给出了3个晶面指数,选择正确的答案。
60
ACF
FN
ABD’E’
A’F’
AFI
BC
ADE’F’
O’M
《晶体场理论》课件

晶体结构与物理性质的实验测量
03
通过实验测量可以获得晶体的各种物理性质数据,如通过硬度测试了解晶体的机械性能,通过电导率测试了解晶体的导电性能等。
03
CHAPTER
晶体场理论的基本概念
晶体场中电子由于受到周期性势场作用而产生的能级分裂,产生的能量差值即为晶体场稳定化能。
晶体场稳定化能
晶体场分裂能
随着晶体场强度的增加,分裂能级的间距逐渐增大。
强晶体场中分裂能级较为稳定,弱晶体场中分裂能级不稳定。
在晶体场作用下,电子云会发生变形,以适应周围势场的分布。
电子云变形
光谱线分裂
磁有序现象
化学键合作用
由于晶体场作用,光谱线会分裂成多个子线,子线的数目和位置取决于晶体场的对称性和强度。
在强晶体场中,由于电子自旋和轨道磁矩的相互作用,可导致磁有序现象的出现。
常用的数值计算方法包括有限差分法、有限元法、蒙特卡洛方法等。这些方法可以根据具体问题选择合适的数值计算方法,以获得更准确的结果。
05
CHAPTER
晶体场理论的应用
磁性材料设计
利用晶体场理论预测和解释不同材料的磁学性质,为磁性材料的设计和优化提供理论支持。
催化剂设计
通过晶体场理论模拟催化剂的电子结构和活性位点,优化催化剂的性能,提高化学反应效率。
晶体场效应
由于晶体场作用导致能级分裂的能量差值,反映了晶体场对电子的束缚强弱。
晶体场对电子的相互作用和影响,包括电子云变形和能级分裂等。
03
02
01
能级分裂类型
分裂能级数量
分裂能级间距
分裂能级的稳定性
01
02
03
04
根据晶体场强度和对称性,能级分裂可分为弱场分裂、中等强度场分裂和强场分裂。
03
通过实验测量可以获得晶体的各种物理性质数据,如通过硬度测试了解晶体的机械性能,通过电导率测试了解晶体的导电性能等。
03
CHAPTER
晶体场理论的基本概念
晶体场中电子由于受到周期性势场作用而产生的能级分裂,产生的能量差值即为晶体场稳定化能。
晶体场稳定化能
晶体场分裂能
随着晶体场强度的增加,分裂能级的间距逐渐增大。
强晶体场中分裂能级较为稳定,弱晶体场中分裂能级不稳定。
在晶体场作用下,电子云会发生变形,以适应周围势场的分布。
电子云变形
光谱线分裂
磁有序现象
化学键合作用
由于晶体场作用,光谱线会分裂成多个子线,子线的数目和位置取决于晶体场的对称性和强度。
在强晶体场中,由于电子自旋和轨道磁矩的相互作用,可导致磁有序现象的出现。
常用的数值计算方法包括有限差分法、有限元法、蒙特卡洛方法等。这些方法可以根据具体问题选择合适的数值计算方法,以获得更准确的结果。
05
CHAPTER
晶体场理论的应用
磁性材料设计
利用晶体场理论预测和解释不同材料的磁学性质,为磁性材料的设计和优化提供理论支持。
催化剂设计
通过晶体场理论模拟催化剂的电子结构和活性位点,优化催化剂的性能,提高化学反应效率。
晶体场效应
由于晶体场作用导致能级分裂的能量差值,反映了晶体场对电子的束缚强弱。
晶体场对电子的相互作用和影响,包括电子云变形和能级分裂等。
03
02
01
能级分裂类型
分裂能级数量
分裂能级间距
分裂能级的稳定性
01
02
03
04
根据晶体场强度和对称性,能级分裂可分为弱场分裂、中等强度场分裂和强场分裂。
结构化学晶体点阵结构PPT课件

现代科技中的晶体材料
材料科学是人类文明大厦的基石,在现代 技术中, 晶体材料更占有举足轻重的地位. 人类对 固态物质的理解在很大程度上以单晶材料为基础, 所以晶体在物质结构研究中也具有特殊重要性.
现
半导体的后起之秀——砷化镓
代
科
技
中
的
晶
体
作为半导体材料,GaAs的综合性能优于Si, 开关速 度仅为10-12 s(而Si为10-9 s), 用GaAs芯片制造计算机将使
假若你这样做了,试 把这所谓的“点阵”放回 金刚石晶体,按箭头所示 将所有原子平移,晶体能 复原吗?
这种所谓的“点阵”有一个致命错误:它本身就违反点 阵的数学定义,并不是点阵!更别说是金刚石晶体的点阵.
正确做法如下:
金刚石的点阵:立方面心
正当空间格子的标准:
空间格子净含点阵点数:
空
1. 平行六面体
所有顶点原子: 0,0,0 (前)后面心原子: 0,1/2,1/2 左(右)面心原子: 1/2,0,1/2 (上)下面心原子: 1/2,1/2,0
四、晶面与晶面指标
1 晶面 晶体的空间点阵可划分为一族平行而等间距
的平面点阵,晶面就是平面点阵所处的平面。
晶面 = 平面点阵 + 结构基元 各个晶面的方向及结构基元排列情况不同, 表现出的性质也不相同。为了区分不同的晶面 就产生了晶面符号也叫晶面指标。
12
6
3
54
12
6
3
54
,
AB
关键是第三层,对第一、二层来说,第三层可以有两种最紧 密的堆积方式。
第一种是将球对准第一层的球。 下图是此种六方 紧密堆积的前视图
12
A
6
晶体结构(结构 晶面指数)ppt课件

School of Physics and Information
SchToeoclhonfoloPghyy,sSiNcsNUand Information Technology, SNNU
CsCl 结构式
2. CsCl 结构——由两个简单立方子晶格彼此沿立方体空间对角线位移1/2
的长度套构而成
Cs+(0,0,0),Cl-(0.5,0.5,0.5), Cs+ 平移(0.5,0.5,0.5)即可变为Cl-, Cs+和Cl离子各自构成简单立方结构
晶 体:是指其内部的原子、分子、离子或其集团在三维空间呈周期 排列的固体,表现为长程有序(在微米量级范围是有序的)
非晶体:无规则的,无序的或短程有序的。
在X射线中出现明显衍射峰的称为晶体 (微米量级甚至纳米量级)
晶体分为: 单晶体 多晶体;有机晶体 无机晶体 完整晶体 非完整晶体
Pb(Zr,Ti)O 3
金刚石晶格碳1位置碳2位置其中informationtechnologysnnuwignerseitz原胞定义以任意一个格点为中心以此格点与一切相邻格点连线的中垂面为界面围成的最小多面体特点总是代表其点阵的点群对称性总是原胞最自然最漂亮的原胞能反映晶体对称性的最小重复单元平面六角bccfcc正十二面体schoolinformationtechnologysnnubravais格子的特点所有格点周围的环境都是一样的但沿不同方向上的物理性质不同的各向异性bravais格子的格点可以看成分布在一系列平行的直线上晶列晶列的指向晶向crystaldirection晶向指数的确定步骤晶向指数的确定步骤11以晶胞中的某一阵点为原点以三条棱边为以晶胞中的某一阵点为原点以三条棱边为轴并以晶胞棱边的长度为单位长度
SchToeoclhonfoloPghyy,sSiNcsNUand Information Technology, SNNU
CsCl 结构式
2. CsCl 结构——由两个简单立方子晶格彼此沿立方体空间对角线位移1/2
的长度套构而成
Cs+(0,0,0),Cl-(0.5,0.5,0.5), Cs+ 平移(0.5,0.5,0.5)即可变为Cl-, Cs+和Cl离子各自构成简单立方结构
晶 体:是指其内部的原子、分子、离子或其集团在三维空间呈周期 排列的固体,表现为长程有序(在微米量级范围是有序的)
非晶体:无规则的,无序的或短程有序的。
在X射线中出现明显衍射峰的称为晶体 (微米量级甚至纳米量级)
晶体分为: 单晶体 多晶体;有机晶体 无机晶体 完整晶体 非完整晶体
Pb(Zr,Ti)O 3
金刚石晶格碳1位置碳2位置其中informationtechnologysnnuwignerseitz原胞定义以任意一个格点为中心以此格点与一切相邻格点连线的中垂面为界面围成的最小多面体特点总是代表其点阵的点群对称性总是原胞最自然最漂亮的原胞能反映晶体对称性的最小重复单元平面六角bccfcc正十二面体schoolinformationtechnologysnnubravais格子的特点所有格点周围的环境都是一样的但沿不同方向上的物理性质不同的各向异性bravais格子的格点可以看成分布在一系列平行的直线上晶列晶列的指向晶向crystaldirection晶向指数的确定步骤晶向指数的确定步骤11以晶胞中的某一阵点为原点以三条棱边为以晶胞中的某一阵点为原点以三条棱边为轴并以晶胞棱边的长度为单位长度
第一节纯金属的晶体结构(共20张PPT)
位错:晶体中某处有一列或假设干列原子发生了有规律错排 的现象
正刃型位错
负刃型位错
15
螺位错
空位 如果间隙原子是其它元素就称为 〔2〕面心立方晶格 fcc 原子〔离子〕的刚球模型 四、实际金属中的晶体缺陷 〔2〕线缺陷 —— 刃位错与螺位错 〔2〕面心立方晶格 fcc 晶格常数:a=b=c; 位错:晶体中某处有一列或假设干列原子发生了有规律错排的现象 〔2〕线缺陷 —— 刃位错与螺位错 〔2〕面心立方晶格fcc 〔1〕点缺陷:空位、间隙原子、异类原子 〔1〕体心立方晶格 bcc 〔2〕面心立方晶格 fcc 晶格常数:a=b=c;
b
Y
a
X
晶格常数
a,b,c
4
三种常见的金属晶体结构
〔1〕体心立方晶格bcc 〔2〕面心立方晶格fcc
〔3〕密排六方晶格hcp
5
〔1〕体心立方晶格 bcc -Fe、W、V、Mo 等
6
体心立方晶胞
Z
c
a
a 2r
a
bY
X
晶格常数:a=b=c; ===90
晶胞原子数: 2 原子半径r:
致密度=Va /Vc,其中
16
〔3〕面缺陷Байду номын сангаас晶界、亚晶界
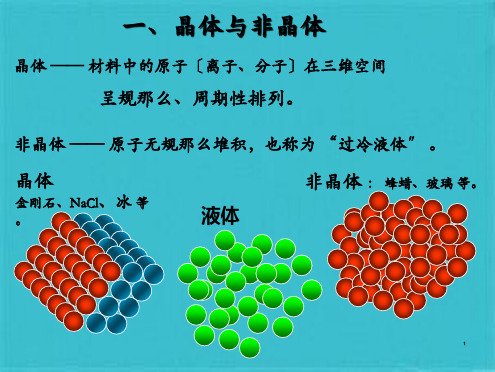
〔3〕密排六方晶格hcp 三、金属的同素异构转变〔P71〕 异类原子 〔杂质原子〕 实际金属晶体结构与理想结构的偏离 晶格常数:a=b=c; 〔1〕体心立方晶格 bcc 〔3〕密排六方晶格hcp 〔1〕体心立方晶格 bcc 原子〔离子〕的刚球模型 如果间隙原子是其它元素就称为 非晶体 : 蜂蜡、玻璃 等。 〔3〕密排六方晶格hcp 空位 晶格常数:a=b=c; 金刚石、NaCl、冰 等。
一、晶体与非晶体
正刃型位错
负刃型位错
15
螺位错
空位 如果间隙原子是其它元素就称为 〔2〕面心立方晶格 fcc 原子〔离子〕的刚球模型 四、实际金属中的晶体缺陷 〔2〕线缺陷 —— 刃位错与螺位错 〔2〕面心立方晶格 fcc 晶格常数:a=b=c; 位错:晶体中某处有一列或假设干列原子发生了有规律错排的现象 〔2〕线缺陷 —— 刃位错与螺位错 〔2〕面心立方晶格fcc 〔1〕点缺陷:空位、间隙原子、异类原子 〔1〕体心立方晶格 bcc 〔2〕面心立方晶格 fcc 晶格常数:a=b=c;
b
Y
a
X
晶格常数
a,b,c
4
三种常见的金属晶体结构
〔1〕体心立方晶格bcc 〔2〕面心立方晶格fcc
〔3〕密排六方晶格hcp
5
〔1〕体心立方晶格 bcc -Fe、W、V、Mo 等
6
体心立方晶胞
Z
c
a
a 2r
a
bY
X
晶格常数:a=b=c; ===90
晶胞原子数: 2 原子半径r:
致密度=Va /Vc,其中
16
〔3〕面缺陷Байду номын сангаас晶界、亚晶界
〔3〕密排六方晶格hcp 三、金属的同素异构转变〔P71〕 异类原子 〔杂质原子〕 实际金属晶体结构与理想结构的偏离 晶格常数:a=b=c; 〔1〕体心立方晶格 bcc 〔3〕密排六方晶格hcp 〔1〕体心立方晶格 bcc 原子〔离子〕的刚球模型 如果间隙原子是其它元素就称为 非晶体 : 蜂蜡、玻璃 等。 〔3〕密排六方晶格hcp 空位 晶格常数:a=b=c; 金刚石、NaCl、冰 等。
一、晶体与非晶体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2)同分异构体:支链越多沸点越低 金属晶体:金属键
物质结构基本理论
晶体结构
高二化学备课组
回顾
晶体
离子晶体 分子晶体 原子晶体 金属晶体
一、四种晶体类型
晶体类型 构成的微粒 微粒间的作用 含化学键情况 离子晶体 原子晶体 体
硬度
导电性
原子晶体
分子晶体 金属晶体
1、下列叙述正确的是( ) A、离子晶体中可能不含金属离子 B、 分子晶体中可能含离子键 C、分子晶体中一定含有共价键 D、离子晶体不可能含有共价键
3、物质熔、沸点高低判断 (一般而言)
晶体熔化的实质是什么?
例3:比较SiC 、晶体硅 、金刚石三者熔 点的高低?
3、物质熔、沸点的比较
1)不同晶型的熔沸点:原子晶体>离子晶体>分子晶体 (金属晶体的熔沸点有的很高, 有的则很低 )
离子晶体:离子键
原子晶体:共价键
2)同种晶体 分子晶体:分子间力 1)组成和结构相似:
物质结构基本理论
晶体结构
高二化学备课组
回顾
晶体
离子晶体 分子晶体 原子晶体 金属晶体
一、四种晶体类型
晶体类型 构成的微粒 微粒间的作用 含化学键情况 离子晶体 原子晶体 体
硬度
导电性
原子晶体
分子晶体 金属晶体
1、下列叙述正确的是( ) A、离子晶体中可能不含金属离子 B、 分子晶体中可能含离子键 C、分子晶体中一定含有共价键 D、离子晶体不可能含有共价键
3、物质熔、沸点高低判断 (一般而言)
晶体熔化的实质是什么?
例3:比较SiC 、晶体硅 、金刚石三者熔 点的高低?
3、物质熔、沸点的比较
1)不同晶型的熔沸点:原子晶体>离子晶体>分子晶体 (金属晶体的熔沸点有的很高, 有的则很低 )
离子晶体:离子键
原子晶体:共价键
2)同种晶体 分子晶体:分子间力 1)组成和结构相似:
