PH3-10缓冲溶液配制方法
pH标准缓冲溶液系列的配制表

pH标准缓冲溶液系列的制备1(1)0.1M磷酸二氢钾溶液:13.609g磷酸二氢钾(KH2PO4,分析纯)溶于蒸馏水,定溶至1L。
(2)0.05M硼砂溶液:19.068g硼砂(Na2B4O7·10H2O,分析纯)溶于蒸馏水中,定容至1L。
(3)将上述0.1M磷酸二氢钾溶液和0.05M硼砂溶液按下表比例配制,即得pH6.0—9.0的标准系列。
0.1M磷酸二氢钾溶液(ml)0.05M硼砂溶液(ml)pH(18℃)8.77 1.23 6.08.30 1.70 6.27.70 2.30 6.47.12 2.88 6.66.58 3.42 6.86.10 3.907.05.66 4.34 7.25.36 4.64 7.45.08 4.92 7.64.805.20 7.84.505.50 8.04.245.76 8.23.80 6.20 8.43.20 6.80 8.62.48 7.52 8.81.32 8.68 9.0pH标准缓冲溶液系列的制备2(1)称取23.88g磷酸氢二钠(Na2HPO4·12H2O,分析纯)溶于少量水中,定容至1L,即为1/15g分子浓度溶液。
(2)称取9.072g磷酸二氢钾(KH2PO4,分析纯)溶于少量水中,定容至1L,即为1/15g分子浓度溶液。
(3)将上述溶液按下表比例,在平底指形管内混合成pH溶液。
Na2HPO4·12H2O(ml)KH2PO4(ml)pH(18℃)0.00 10.00 4.50.20 9.80 5.00.50 9.50 5.51.00 9.00 6.03.00 7.00 6.56.00 4.007.07.50 2.50 7.59.50 0.50 8.09.80 0.20 8.510.00 0.00 9.0。
各种PH值的磷酸盐缓冲液配制

各种PH值的磷酸盐缓冲液配制磷酸盐缓冲液取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
磷酸盐缓冲液(pH7.0) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH7.2) 取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。
磷酸盐缓冲液(pH7.3) 取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。
ph缓冲溶液的配制方法

ph缓冲溶液的配制方法PH缓冲溶液是指在一定范围内,具有缓冲pH值的溶液,适用于化学、生物、医药等各个领域的实验和应用。
在实验中,通常需要制备一定浓度和pH值的缓冲溶液,以保证实验结果的准确性和可重复性。
本文将介绍几种常见的缓冲溶液配制方法。
一、磷酸缓冲液(PBS)磷酸缓冲液是一种常用的生物化学实验缓冲液,可以用于细胞培养、酶活性测定、免疫学实验等等。
其配制方法如下:1. 准备250ml坐标瓶,称取1.37g Na2HPO4·12H2O和0.26g KH2PO4。
3. 将两个溶液混合,加入NaCl使溶液最终重量达到250g,调节pH值至7.4-7.6,如果pH值过低,可加入1M NaOH调节,反之加入1M HCl。
二、三氯醋酸缓冲液(TCA)三氯醋酸缓冲液是一种酸性缓冲液,适用于蛋白质的沉淀和提取等实验。
其配制方法如下:1. 准备250ml坐标瓶,在其中加入11.9g三氯乙酸,加入去离子水至250ml。
2. 调节溶液pH值至2.0-2.5,可使用无水HCl或NaOH来调节pH值。
3. 再加入去离子水,使溶液最终体积达到500ml,并根据需要添加NaCl和KCl等。
五、TRIS缓冲液TRIS缓冲液是一种常用的生化和细胞学实验用缓冲液,其缓冲范围在7.0~9.2之间。
其配制方法如下:1. 准备500ml坐标瓶,称取12.11g Tris-Base。
3. 在室温下缓慢加入0.1M HCl溶液,同时使用pH计监测溶液pH值,当pH值达到所需值时停止加入。
4. 将溶液体积补至500ml,并调节pH值。
可根据实验需要调节缓冲液中的NaCl或其他化学物质的浓度。
以上就是几种常见缓冲溶液的配制方法,需要注意的是在配制过程中,一定要严格按照实验要求和操作规程进行,以获得准确的实验结果。
同时,制备的缓冲液要遵循使用前检测pH值、滤过消毒等规定操作,以保证实验的可重复性和安全性。
不同ph磷酸缓冲液的配置表

不同ph磷酸缓冲液的配置表
Ph磷酸缓冲液,也称为ph缓冲溶液,是一种抗变质的水溶液,具有着重要的实用价值。
它具有独特的pH稳定性,能够有效地阻止氢离子的流行,从而保持系统的pH值稳定。
Ph磷酸缓冲液的配置表如下:
Ph缓冲液1.0,可以把39.6g的磷酸氢二铵和2.0 ml的硝酸锂溶于1000 ml的水中,然后将溶液的ph值调节至1.0;
Ph缓冲液4.0,可以把20.6g的磷酸氢二铵和2.0ml的硝酸锂溶于1000 ml的水中,然后将溶液的pH值调节至4.0;
Ph缓冲液7.0,可以把25.2g的氢氧化钠和5.5g的磷酸钠溶解在1000 ml的水中,然后将溶液的pH值调节至7.0;
Ph缓冲液9.2,可以把25.3g的磷酸二氢钾和2.0ml的硝酸锂溶于1000ml的水中,然后将溶液的pH值调节至9.2。
ph缓冲液的用途十分广泛,它既可以用于实验室研究,也可以用于生物膜的细胞对环境的调节。
通常,ph缓冲液用于实验室分析,以维护实验室,可以有效提高分析精度。
此外,ph缓冲液也可以作为一种生物活动液体,决定着生物细胞内活性物质是否有活动,如,生物反应器。
总之,ph磷酸缓冲液在化学实验和生物研究中的地位不容忽视,它的准确配制以及正确的使用有助于为实验提供良好的环境和精确的分析结果。
只有充分了解ph磷酸缓冲液的配置,并熟练掌握其正确使用,才能始终维持实验室良好的稳定性,以便获得可靠的分析结果。
常见缓冲溶液配制方法

常见缓冲溶液配制方法缓冲溶液是一种能够维持溶液酸碱性质相对稳定的溶液。
常见的缓冲溶液配制方法主要包括四种:酸碱对配制、酸碱配制、水解配制和氧化还原配制。
下面将详细介绍这四种配制方法以及常用的缓冲体系。
一、酸碱对配制酸碱对配制是以两种酸碱的共存为基础实现的。
常用的酸碱对包括:醋酸与醋酸钠对、琼脂酸与琼脂酸钠对、乙酸与乙酸-乙酸钠对等。
以醋酸和醋酸钠为例:1.根据所需的pH值,计算所需的酸碱物质的摩尔量比例,使用化学计算方法可以得到这个比例。
2.首先,在一定体积(如100mL)的蒸馏水中加入醋酸的量,根据计算结果。
3.然后,在同样的蒸馏水中加入醋酸钠的量,根据计算结果。
在加入醋酸钠之前,需要校对酸碱物质的总体积是否是所需的目标体积,如果不是,可以再加入适量的蒸馏水进行调整。
4.经过充分搅拌混合后,缓冲溶液就制备好了。
最后,根据需求进行PH值校准。
二、酸碱配制酸碱配制是指利用单一酸或碱的酸碱性质与反应物种数之间的关系,通过精确配比计算得出所需的缓冲体系,使溶液能够保持所需的酸碱性质稳定。
常见的酸碱配制方法有:乙酸钠-盐酸、蒸馏水盐酸-碳酸钠等。
以乙酸钠-盐酸为例:1. 根据所需的pH值,计算所需的酸碱物质的摩尔量比例。
根据缓冲溶液配制公式 pKa=pH-log([A-]/[HA]),可以反推得到[HA]/[A-]的比例,其中[A-]代表酸根离子的浓度,[HA]代表不电离酸的浓度。
2.根据计算结果和所需体积,将乙酸钠溶液添加到蒸馏水中,同时滴加适量的盐酸溶液以调整pH值。
3.增加或减少乙酸钠和盐酸的量,直到所需的pH值达到要求。
三、水解配制水解是指酸碱反应中一种物质在水中发生分解产生酸和碱的反应。
通过精确配比计算得出所需的缓冲体系,既可以保持所需的酸碱性质稳定,又可以实现水解反应的产物稳定。
常见的水解配制方法有:磷酸盐缓冲液、硼酸缓冲液、胸腺嘧啶缓冲液等。
以硼酸缓冲液为例:1.将一定体积(如100mL)的蒸馏水倒入容器中。
ph缓冲液的配制方法

ph缓冲液的配制方法
pH缓冲溶液,本身溶液就有一定的缓冲容量,也就是允许配制溶液的过程中,各个原料的添加量有一定的误差,它的pH值仍然能保持相对稳定。
但是由于不少的客户对缓冲溶液并不了解,仍然花大价钱来购买标准的缓冲溶液,有时还要求带证书的标准溶液。
其实真的非常不便宜,本来20块钱能搞定的试剂,结果花了近百块钱。
傻瓜式的缓冲溶液配制,就是通过购买试剂包,然后用去离子水溶解,稀释到指定刻度即可完成。
(1)苯二甲酸氢钾标准缓冲溶液称取在105℃烘干2h的苯二甲酸氢钾(KHC8H4O4)10.12g溶于水中,并稀释至1L,贮存于塑料瓶中。
此溶液在25℃时,pH值为4.01。
(2)磷酸盐标准缓冲溶液称取在105℃烘干2h的磷酸二氢钾(KH2PO4)3.40g和磷酸氢二钠(Na2HPO4)3.55g,溶于水中,并稀释至1L,贮存于塑料瓶中。
此溶液在25℃时,pH值为6.86。
(3)硼酸钠标准缓冲溶液称取四硼酸钠(NaB4O7·10H2O)3.81g,溶于水中,稀释至1L,储存于塑料瓶中。
此溶液25℃时,pH值为9.18。
注意:试剂除另有说明外,均为优级纯试剂。
所用水指不含CO2的去离子水。
常用pH缓冲液配置方法及注意事项
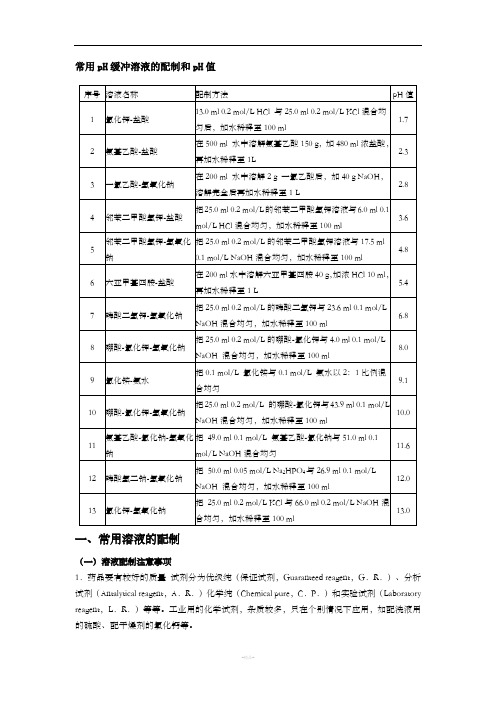
常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1000ml容量瓶内,再稀释至刻度(1000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1000ml容量瓶内,再加蒸馏水稀释至刻度(1000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)(三)0.15Mol/L PB液附表2 0.15Mol/LPB液配制法Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
各种缓冲液配制方法

各种缓冲液配制方法缓冲液是一种用于调节溶液的pH值的溶液,常用于实验室中的生物化学和分子生物学实验中。
根据所需的pH范围和实验目的,可以使用不同的缓冲液配制方法。
以下是一些常见的缓冲液配制方法:1.磷酸盐缓冲液(PBS)磷酸盐缓冲液是一种常见的生物学实验中使用的缓冲液。
它的制备方法如下:-取一个容器,加入8克氯化钠(NaCl),0.2克磷酸二氢钠(NaH2PO4),和1.44克磷酸氢二钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
2. Tris缓冲液Tris缓冲液适用于pH 7-9范围内的实验。
制备方法如下:- 取一个容器,加入121.14克Tris(羟甲基氨基甲烷)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
3.醋酸盐缓冲液醋酸盐缓冲液适用于pH3-5范围内的实验。
制备方法如下:-取一个容器,加入20毫升醋酸钠三水合物(NaC2H3O2·3H2O)。
-加入6毫升醋酸。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
4.磷酸缓冲液磷酸缓冲液适用于pH2-8范围内的实验。
制备方法如下:-取一个容器,加入0.126克磷酸二氢钾(KH2PO4)。
-加入0.680克磷酸二氢钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
5.碳酸氢盐缓冲液(HEPES缓冲液)HEPES缓冲液适用于pH6-8范围内的实验。
-取一个容器,加入10克HEPES。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P H3-10缓冲溶液配制方法
(总5页)
-CAL-FENGHAI.-(YICAI)-Company One1
-CAL-本页仅作为文档封面,使用请直接删除
PH3-10缓冲溶液的配制方法
24Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
氢氧化钠溶液或浓盐酸调节,冰箱保存。
3. 甘氨酸–盐酸缓冲液(0.05mol/L )
4.邻苯二甲酸–盐酸缓冲液(0.05 mol/L )
/升
6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克
/升。
柠檬酸C 6H 8O 7·H 2O: 2.1g
柠檬酸钠Na 3 C 6H 5O 7·2H 2O: 2.94g H2O: 100 ml
227.磷酸盐缓冲液
242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )
10.Tris –盐酸缓冲液(0.05M ,25℃)
100毫升。
C
HOCH2 NH2
分子量=121.14;
0.
1M 溶液为12.114克/升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H 2BO 3,
分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
247
2 硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂 易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )
13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)
247214.碳酸钠-碳酸氢钠缓冲液(0.1M )
2+2+
222N 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
