有机化学总结2
有机化学学习心得(通用8篇)

有机化学学习心得有机化学学习心得(通用8篇)有机化学学习心得篇1学习有机化学也已经有一个学期了,虽然说以前高中也学习过有机化学,但是到了大学再学有机化学发现高中学的基本连皮毛也说不上,真正的有机化学涉及的反应是那么多。
所以我认为有机化学就是用两个词来形容——多和变化。
先来说说多,有机化学的多最多体现在有机物多,有机反应多,反应的机理也有不少。
所以说有机化学在我学了一个学期以后明白了有机化学的最大难处就是化合物多,有机反应多,十分难以掌握。
但是有机老师的课件做得十分巧妙,把几种有机物进行了分类,学起来可以沿着各种有机物的特性了进行研究,可以掌握到同一种物质不同反应的一些特点,分类记忆这样比较方便了,也减轻了有机化学的反应的部分负担,也可以研究出不同反应的一些共同的特点。
这样就大大地减轻了学习有机化学的负担。
也使得在我们初学者的眼中看来很难学的有机化学一下子也简单了很多,有了许多规律的记忆方法,这样我们就可以掌握规律,从而可以更加简单地掌握这一类反应。
而有机化合物,虽然有很多种,但是为我们现在所用的还不多,在不同的分类中都可以找到的,这样有机化学学起来就还是减轻了许多的负担。
有机化学的另外的一个特点就是变化复杂。
变化中可能还有变化,有的比较简单的题目,但是稍加变化以后就会很复杂。
比如说许多炔烃的反应要联系到烯烃的反应,一些不同的物质却有着相同的反应规律,还有命名中有许多小的细节上的变化都可以出题。
所以这些变化更加难学,有机化学的反应多但是及不上变化多,无论有多少的机理,规律,只要把几个融合一下就可以产生不同的变化,出出来不少的题目,这样就难住的大家。
所以有机化学最难学的就是学习规律,学习机理,学习到了以后还要把这些机理融合起来,要知道如何地变化,这样才能把一些机理题和合成题作好,我们学习有机化学才有实用的价值。
所以我们可以说有机化学最难的不是那些方程式,而是那些方程式变化了以后你还知道吗的问题,只要在学习的时候多多地总结,多多地复习,多多地了解不同的变化,并且用这些不同的变化来丰富自己的有机化学的知识,这样才是学习好有机化学的正道。
有机化学的基础知识点归纳总结6篇

有机化学的基础知识点归纳总结6篇篇1一、有机化学概述有机化学是研究有机化合物的科学,主要涉及碳、氢、氧、氮等元素的化合物。
有机化学是化学领域中最为重要和广泛应用的分支之一,与人类生活息息相关。
二、有机化合物的特点1. 碳原子之间的连接方式多样,可形成链状、环状等结构。
2. 化合物种类繁多,性质各异。
3. 具有较低的熔点和沸点,易挥发。
4. 多为无色或有色液体或固体,有特殊气味。
5. 易燃烧,部分化合物有毒。
三、有机化学的基础概念1. 同分异构体:具有相同分子式但不同结构的化合物。
2. 官能团:决定化合物主要性质的原子或原子团。
3. 烷烃:只有碳和氢两种元素的化合物,具有饱和的碳链。
4. 烯烃:含有至少一个双键的烃类,具有不饱和的碳链。
5. 炔烃:含有至少一个三键的烃类,具有更强的不饱和性。
6. 醇类:含有羟基(-OH)的化合物,具有醇的特性。
7. 醛类:含有醛基(-CHO)的化合物,具有醛的特性。
8. 酮类:含有酮基(C=O)的化合物,具有酮的特性。
9. 酸类:含有羧基(-COOH)的化合物,具有酸的特性。
10. 酯类:含有酯基(COO-)的化合物,具有酯的特性。
四、有机化学反应类型1. 取代反应:化合物中的原子或原子团被其他原子或原子团取代的反应。
2. 加成反应:不饱和化合物与其他化合物反应,形成饱和化合物的反应。
3. 消除反应:化合物中去除一个原子团,形成不饱和化合物的反应。
4. 酯化反应:羧酸与醇反应生成酯的反应。
5. 水解反应:酯或酰胺等化合物与水反应,生成相应醇或胺的反应。
6. 氧化反应:有机物被氧化剂氧化,生成醛、酮、酸等化合物的反应。
7. 还原反应:有机物被还原剂还原,生成醇、胺等化合物的反应。
8. 重排反应:分子内或分子间发生原子或原子团的重新排列的反应。
9. 环化反应:不饱和化合物通过环化作用形成环状化合物的反应。
10. 开环反应:环状化合物通过断裂环状结构形成开链化合物的反应。
有机化学知识总结
C 8 H 1 7 NH 2
(8 9 -9 2 % )
CH 3 CH 2 NH 2
(8 8 % )
CH 3 CH 2 CH 2 CN
L i AlH 4 E t2O
CH 2 CN L i AlH 4
N N H
E t2O
CH 3 CH 2 CH 2 CH 2 NH 2 CH 2 CH 2 NH 2
N N H
OH
(9 3% )
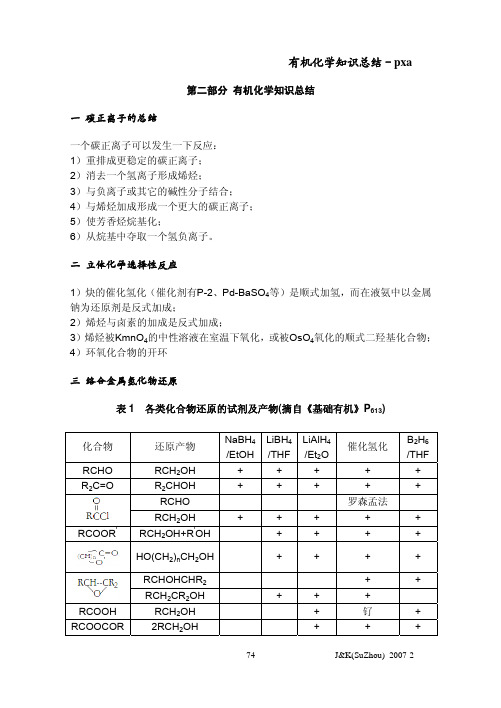
(2) 羧酸及其衍生物的还原:羧酸,酸酐,酯(内酯)可被 LAH 直接还原成醇,手性
羧酸的还原不影响手性:
C 1 5 H 3 1 COCl CF 3 C O C l
Cl 2 CHCOCl CH 2 COOH
L i AlH 4 E t2 O
L i AlH 4 E t2 O L i AlH 4 E t2 O
(5 7 % ) (5 3 % )
(5) 硝基化合物的还原:
NO 2
LiAlH 4 Et 2O
CH 2NO 2
LiAlH 4 Et 2O
NO 2
LiAlH 4 Et 2O
NO 2
LiAlH 4 Et 2O
NH 2
(85% )
CH 2NH 2
(9 0 % )
NN
(84% )
NH 2
(60% )
2 Me2N
Et
C*H
COOH
L i AlH 4
Et
C*H
CH 2 OH
Me O
E t2 O
Me
CH 3 (CH
C O
C O
2 ) 1 0 COOCH
L i AlH 4 E t2 O
L i AlH 4
3
大学有机化学知识点总结
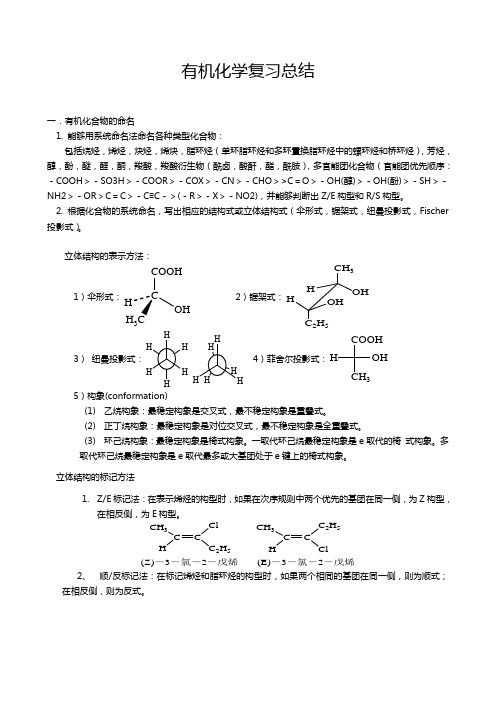
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOHH 3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3CHC 2H 5CH 3CHC 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3C CHCH3HCH3C CHHCH3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学重点知识总结 (2)

6. CH3CHCH2CH3 OH
浓 H2SO4 > 150 ℃
NBS ( CH3CH CHCH2Br)
( CH3CH CHCH3 )
24. H2C CHCH(CH3)2
Cl2 500 ℃
(
H2C
C H
C(CH3)2) Cl
NBS, CCl4
Br
(
)
O (R C O OH )
O
22.
Br
Br2
(
CH3
30.
H3C
CC CH3 H
CH2
补充:
① B2H6 ② H2O2/OH-
(
)
CH3 H3C C CH2CH2OH
CH3
CH3 ① B2H6
CH3 ② H2O2/OH-
CH3 H
OH CH3
34
② 双键上的氧化
CH2 CH2 + O2
O
Ag 250℃
O
O
C C +R C O O H
C C + R C OH O
有 机 化 学 习题课
第二章
饱和烃(烷烃和环烷烃)
(一)烷烃
1. 熟练掌握烷烃的系统命名法。 要求能根据结构式写出名称或由名称写出结构式
“最长” 选最长的碳链作为主链 “最多”选取含支链最多的碳链为主链 “最小” 取代基位次最小
最低系列:最先遇到的取代基位次最小
1 2 3 45 1. CH3CH CH CH2CH3
O C CH3)
47
1. 由 HC CH 合成 (1) CH3CH2CH2CH2OH
分析:
CH3CH2CH CH2 CH3CH2C CH
+ CH3CH2Br
大学有机化学期末总结5篇

大学有机化学期末总结5篇大学有机化学期末总结篇1忙碌又充实的教育教学工作接近尾声了,担任x年级音乐课有一个学期了,我一直都以新课标的要求为教学理念,从美的角度出发,让学生学会发现美、追求美、并创造美。
我细细的回顾一下自己在这一学期的教育教学工作情况,喜忧参半,下面我就从几个方面对我这学期的工作做以总结:一、思想方面作为一名教师,我能全面贯彻执行党的教育方针和九年制义务教育,注意培养自己良好的师德,关心和爱护每一位学生,做他们学习和生活中的良师益友,时时处处为人师表;在思想政治上,时刻能以党员的标准来严格要求自己,关心集体,以校为家。
响应学校号召,积极参加学校组织的各项活动,注重政治理论的学习。
抓住每一个学习的机会提高自己的业务水平。
每周按时参加升旗仪式,从不缺勤,服从学校安排。
二、教学方面本学期,我担任x年级的音乐课教学任务。
由学生于年龄小,又是刚刚升入小学的孩子,爱玩还是他们这时的天性,所以我抓住他们的这个特点,让他们尽量在玩的过程中去学习音乐,并且爱上音乐,让音乐也成为他们的好朋友。
于是,在课堂教学中我安排了三个学习环节听、唱、演。
这三个环节是环环相扣,相互联系的。
现将其总结如下:1、用心倾听音乐是听觉的艺术。
在学习音乐的过程中首先要学会用耳去听,我们的音乐课更要如此。
_版的教材上也刚好安排了欣赏这一部分,意旨就在于让学生初步学会欣赏音乐,感受音乐。
所以,在上这部分知识的时候,我在听之前会提出问题,如在听这部分音乐的时候,小朋友们你们想到了什么,心情是怎么样的,然后请学生闭上眼睛认真地听。
在回答的过程中,我则主张赏识教育,只要学生能够说,并且符合音乐的情境,哪怕是一个音,我都会赞扬他们,并且鼓励他们再加油。
所以学生在上欣赏的时候,课堂纪律很活跃,也爱回答问题。
2、尽情歌唱这里我所说的尽情是用自己的感情去歌唱。
小学x年级学生不宜过多的给学生讲歌唱的方法和练声,如果方法讲太多,小孩子学习起来反而会厌烦唱歌,所以,我每次都是要求学生用听的声音、最自然的声音去唱歌就是最棒的。
有机化学基础知识点归纳总结6篇

有机化学基础知识点归纳总结6篇第1篇示例:有机化学是研究有机物的组成、结构、性质、变化规律和合成方法的科学。
有机化学基础知识是理解和掌握整个有机化学体系的基础,是有机化学学习的重要环节。
接下来,我们将对有机化学基础知识点进行归纳总结,帮助大家更好地理解和掌握这一重要学科。
一、有机物的命名有机物的命名是有机化学的基础,也是有机化学学习的第一步。
有机物的命名方法繁多,常见的包括IUPAC命名法、通用命名法和结构式命名法等。
IUPAC命名法是最为严谨和规范的命名方法,它遵循一定的命名规则,能够准确地标识出有机物的结构和性质。
有机物的结构包括分子式、结构式和空间构型等。
分子式表明了有机物中各种元素的种类和原子数目,结构式则表明了有机物分子中各原子的连接方式和空间位置,空间构型则描述了有机物分子的立体结构和立体构型。
掌握有机物的结构对于理解其性质和反应具有重要意义。
有机物具有多种多样的性质,包括物理性质和化学性质。
物理性质包括熔点、沸点、溶解度等,化学性质包括燃烧、氧化、还原、加成、消除等。
不同的有机物具有不同的性质,这些性质决定了有机物在自然界中的存在形式和化学行为。
有机化学是一个极为重要的合成化学领域,合成有机化合物是有机化学的核心内容之一。
有机物的合成方法繁多,包括物质合成法、加成反应、消除反应、取代反应、氧化还原反应等。
掌握有机物的合成方法对于有机化学的学习具有至关重要的意义。
六、有机物的衍生物有机物的衍生物是指通过对原有有机物进行化学反应得到的新化合物。
有机物的衍生物包括同分异构体、立体异构体、环化合物、功能化合物等。
了解有机物的衍生物对于理解有机化学的结构和性质具有重要意义。
有机物在生活和工业生产中具有广泛的应用,包括医药、农药、染料、塑料、涂料、合成纤维等。
了解有机物的应用对于学习有机化学的意义重大,它能够帮助我们更好地理解和应用有机化学知识。
第2篇示例:有机化学是化学的重要分支之一,研究碳元素及其化合物的结构、性质、反应等规律。
有机化学总结2

多官能团化合物命名1.吸电子和斥电子取代基有哪些?1.配位原子比中心原子电负性大的是吸电子基团,如:-CHO(O>C)、-COOH(O>C)、-NO2(O>N)-CF3(F>C)、-CN(N>C)等。
这类基团在苯环的第二取代中同时表现为间位致钝基团。
2.配位原子比中心原子电负性小的是供电子基团,如:-OH(H<O)、-CH3(H小于C)、-NH2(H<N)等。
这类基团在苯环的第二取代中同时表现为邻对位致活基团。
3.本身电负性很大的单原子取代基,如卤素,是吸电子基团。
这类基团在苯环的第二取代中同时表现为邻对位致钝基团。
2.为什么吸电子基团(NO2 > CN > F > Cl > Br > I > C三C > OCH3 > OH > C6H5 > C=C > H)和斥电子基团(C(CH3)3> (CH3)2C > CH3CH2 > CH3 > H )的排序是这样?根据什么判断他们的强弱呢?还有,羟基上的O 是电负性很强的,但羟基是带负电性的,那它到底是吸电子基团还是斥电子基团?怎么判断?它们的吸电子还是供电子效应是针对其所连接的原子或分子来说的,比如硝基连在苯环上,那么对苯环就是吸电子的,因为硝基与氧的连接方式是一个氮原子与两个氧原子分别以双键相连,因为氧的电负性比氮大,所以,两个双键的电子云都偏向于氧,那么整个基团的电子云在两个氧的拉动下均偏向于氧,所以,这个基团对苯环就是吸电子的,再比较下一个基团CN,氮的电负性比碳大,所以电子云偏向氮,同理,这个集团也是吸电子的.对于后面的OCH3和OH可以这样解释,氧上有孤对电子既有吸电子的诱导效应,又有给电子的共轭效应,两个效应的加和作用使它的吸电子效应减弱了.怎么判断一个基团是吸电子基团还是斥电子基团?我知道的是:根据电负性用还原法识别基团所表现的电场. 网上可搜到“有一个简单的办法,对于一个基团-RX,如果R的电负性大于X,那么它就是给电子的,反之就是吸电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如:HCHO、CH3COOH、RCOOH、
O , OH HOOC (CH2)4 COOH ,
饱 和 烃
• 裂解反应——制备低碳烯烃:C=C、 C=C-CH3、C=C-C2H5 …… • 小环烷烃的特殊反应 (“小环似烯,其它环似烷”)
– 不对称加成规律 – 过氧化物效应
单烯烃
单烯烃 官能团:C=C,(C=C, a-C—H)
• 休克尔规则
一个单环化合物,具有4n+2个p电 子的平面离域体系,都有芳香性。
例题一
• 完成下列反应(用构型式表示):
CH3
+ HBr
ROOR
例题二
试 剂
A.
• 用简单的化学方法鉴别下列化合物: 结 论
现 象 A B - + + C + - +
D.
D - - +
E - + +
Ag(NH3)2NO3 白色沉淀
• 自由基反应——链引发、链增长、链终止三步
• 过渡态、中间体R· 2的概念 CH • 稳定性:3oR·> 2o R·> 1o R· > · 3 CH • 稳定的自由基 过渡态稳定 活化能低 反应速度快
饱 和 烃
• 氧化反应
– 完全氧化——生成CO2、H2O
• 燃烧焓——判断烷烃的热稳定性: 正构烷烃、异构烷烃 小环、普通环、中环、大环烷烃 – 部分氧化——合成含氧化合物
+
共轭二烯烃
• 周环反应
–〔2+4〕加成(Diels-Alder反应 双烯合成)
+
CHO
CHO
特点:合成六元环化合物的方法 可逆反应 双烯体、亲双烯体有取代基,取代基在产物1,4位 亲双烯体构型保持不变
概
括
• RC=C,R-C≡C,C=C-C=C
– 共性:亲电加成 – 特性:
• 炔——部分还原(加氢),炔—M化合物
单烯烃
• 烯烃的特殊加成反应——聚合、共聚合反应
n
H2C CH2
CH2 CH2
n
单体、链节、聚合度、聚合物 共聚合:
n
H2C CH2 +
n
H2C CH CH3 CH2 CH2 CH2 CH CH3
n
单烯烃
• 加成反应的机理
–亲电加成反应机理——离子型、分步加成 • 加溴(氯):三元环溴鎓离子中间体机理
F.
G.
G>E>D>B>C>A>F
例题三
• 比较下列性质:
–按亲电取代活性排列下列化合物,并指出E+进入 的位置。
A. B.
CH3 OH
E.
C.
Cl
D.
NO2
亲电取代活性:D>B>A>C>E
例题三
• E+进入的位置:
CH3
Cl
OH
NO2
例题三
• 比较下列性质:
–按对共振杂化体贡献大小排列下列共振结构:
R C CH + H2O
H2O
O H3C C R
炔 烃
• 加成反应
–几个重要的工业产品
• 加醋酸反应 :
HC CH + CH3COOH
• 加HCN反应:
H2SO4
CH3COOCH CH2
HC CH + HCN
CuCl-NH4Cl
H2C CHCN
炔 烃
• 氧化反应
–O3、KMnO4为氧化剂
• 炔氢(≡C—H)的反应
Ni
Cl Cl Cl Cl Cl
+ Cl2
hv Cl
芳 香 烃
• 其它反应
– 氧化反应
• 苯环氧化:
+ O2
V2O5
O C O + 4 CO2 + 4 H2O C O
。 400-450 C
a-H氧化:
CH3 + O2 COOH
芳 香 烃
• 其它反应
– 氧化反应 a-H氧化:
CH3 + O2 CH3
芳 香 烃
• 两类定位基
– 第二类定位基(间位定位基) • 结构特点:
N(CH3)3 ,
• 钝化苯环 • 定位能力
+
O N O , C N , OSO3H
– 二元取代苯的定位规律 • 两个取代基定位作用一致 • 不一致时,按定位能力强的取代基定位
芳 香 烃
• 其它反应
– 加成反应
• 单环加成:
+ H2
• 反应机理:
(用途)
H
+ E
+ 慢
+
E
E + H+
催化剂作用:增强亲电试剂的亲电能力
芳 香 烃
• 两类定位基
–第一类定位基(邻-对位定位基)
• 结构特点:
O · , OH , OMe , O CCH , X · · · · · · · O , NH2 3
· · • 活化苯环(除 X 外)
• 定位能力
马 式 动 力 规 学 律 控 制 共 热 轭 加 力 学 成 控 制
共轭二烯烃
• 1,3-丁二烯的化学反应
–聚合反应
n
n
C C C C
C C C C +
m
C C C C C
C C
n
C
m
C C C C +
n
C C CN
+
p
C C
共轭二烯烃
• 周环反应
–电环化反应
顺 旋
光
–〔2+4〕加成(Diels-Alder反应 双烯合成)
C C
PdCl 2-CuCl 2
CH3CHO
R CH CH2
–臭氧氧化: Zn粉/H2O
RCOCH3
合成醛
单烯烃
a — H 反应
a — H 卤代:
• 自由基型反应:CH2=CH—CH2Cl, a — H 氧化:
Br
• 自由基型反应:
CH2=CH—CHO,CH2=CH—COOH,CH2=CH—CN
炔 烃
官能团: C≡C (C≡C,≡C—H)
• 加成反应
–亲电加成 • 分步加成 • 马式加成 • 过氧化物效应
• 亲电加成比烯烃难——要催化剂
–亲核加成
HC CH + CH3OH
20% KOH
H2C CH OMe
炔 烃
• 加成反应
–部分加氢反应
R C C R' + H2
P-2Cat.
R C C
–碱金属炔化物:
HC CH + NaNH2
HC CNa
HC CNa + RX
–过渡金属炔化物:
RC CH
鉴别炔烃
• Ag(NH3)2NO3、Cu(NH3)2NO3
共轭二烯烃
官能团:
C C C C
• 基本理论和概念
–共轭
共轭体系:p—p,p—p(C=C-C+·-),s—p,s—p
共轭效应:吸电子共轭效应,推电子共轭效应
• CH3COOOH氧化,生成环氧化合物
• 这些氧化反应的用途
单烯烃
• 烯烃的氧化反应
–催化氧化:
O2 / Ag
• Warker法氧化:
O C C
C C
PdCl 2-CuCl 2
CH3CHO
R CH CH2
RCOCH3
单烯烃
• 烯烃的氧化反应
–催化氧化:
O2 / Ag
• Warker法氧化:
O C C
单烯烃
• HBr加成——过氧化物效应
–反马尔科夫尼科夫加成方向
• 硼氢化反应
–顺式加成,反马式加成, 无碳架异构 –产物碱性氧化(H2O2 /
-OH)水解合成醇。
• 催化加氢反应
–顺式加成,需催化剂 –氢化焓——判断烯烃的热稳定性 热稳定性:R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CH2 > CH2=CH2
(C10H12O),在B的IR谱上,1700cm-1的
附近有强吸收峰。A氧化生成间苯二甲酸, 写出A和B的构造式及有关反应式。
• 共轭二烯烃——1,4加成,周环反应
芳 香 烃
• 结构: 芳香性
• 亲电取代反应
–卤代反应 催化剂 AlCl3 (可逆反应)
–硝化反应 (混酸反应)
–磺化、氯磺化反应
–付-克反应
• 烷基化 (发生异构化,多烷基化)
• 酰基化
(一酰基化,AlCl3用量大)
芳 香 烃
• 亲电取代反应
– 氯甲基化反应
+ Br2
外 消 旋 体
+ Br2
内 消 旋 体
单烯烃
–亲电加成反应机理 • 加质子酸反应机理——马式加成本质 – 碳正离子中间体 碳正离子稳定性:
3oR+ > 2o R+ > 1o R+ > +CH3
– 碳架重排:
单烯烃
–自由基加成机理
· • 中间体:碳自由基 R
加成方向:遵循碳自由基的稳定性 – 硼氢化反应机理——“四元环”过渡态
R'
R C C R' + H2
–硼氢化、氧化合成酮 –聚合反应 • 二聚反应
Na- 液 NH3
R C C H
H R'
CH2 = CH — C ≡ C
• 高聚反应
C C
n
C
炔 烃
• 加成反应
–几个重要的工业产品
• 水合反应:
HC CH + H2O
