初中化学经典计算题3
初三化学计算题练习题

初三化学计算题练习题化学计算在初中化学课程中占据着重要的地位,它是帮助学生提高对化学概念理解并应用的重要手段。
在初三阶段,化学计算题的难度逐渐增加,需要学生运用所学的知识和技巧来解答。
以下是一些初三化学计算题的练习题,希望能帮助同学们巩固化学计算的能力。
1. 在一次化学实验中,将0.2mol的硫酸铜溶液和0.3mol的氢氧化钠溶液混合反应。
根据化学方程式:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4计算以下问题:a. 反应后生成的亚硝酸铜的物质的量是多少?b. 反应后剩余的未反应物的量是多少?2. 一块铁(Fe)的质量为25g,将它完全溶解在盛有200ml稀盐酸(HCl)的容器中。
根据化学反应:Fe + 2HCl → FeCl2 + H2计算以下问题:a. 盐酸溶液中含有多少克的氯离子(Cl-)?b. 反应后盐酸剩余的量是多少?3. 在一次制备氢气的实验中,将10g的锌粉与过量的硫酸反应:Zn + H2SO4 → ZnSO4 + H2计算以下问题:a. 反应后生成的硫酸锌的物质的量是多少?b. 反应后生成的氢气的物质的量是多少?4. 在一次实验中,将10g的氢氧化钠的固体与过量的盐酸反应:NaOH + HCl → NaCl + H2O计算以下问题:a. 反应后生成的盐的质量是多少?b. 反应后生成的水的质量是多少?5. 在一次实验中,将20g的二氧化铅(PbO2)和过量的盐酸反应:PbO2 + 4HCl → PbCl2 + 2H2O + Cl2计算以下问题:a. 反应后生成的氯气的物质的量是多少?b. 反应后生成的氯化铅的物质的量是多少?以上是一些初三化学计算题的练习题,希望能帮助同学们巩固化学计算的能力。
在解答这些题目时,需要根据给定的化学方程式,运用摩尔概念和化学计算公式来计算物质的物质的量、质量等相关问题。
通过反复练习和思考,同学们可以提高化学计算的能力,加深对化学知识的理解和应用。
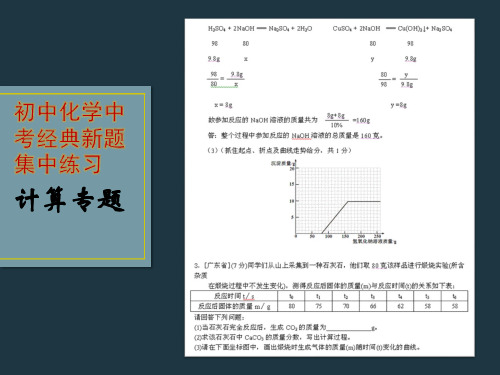
初中化学经典新题集中训练——计算题
生成H2的体积 (标准状况下)/L
1.12
2.24
3.36
m
练习九:现代社会的生产和生活需要消耗大量能量。“高能
气”是最近几年才上市的一种新燃料。其分子式可表示为CxHy。 它具有燃烧充分、火力猛、气化快、且不受环境温度的影响等 优点。但由于价格比较贵,一般在大饭店中才使用,家庭燃料 中还未推广。 (1)“高能气”属于_________化合物(填“无机”或“有 机”)。 (2)经过试验测定:该化合物中碳元素与氢元素的质量比为9: 2,试推算该化合物的化学式为_______________. (3)试计算多少克“高能气”中含碳元素3.6克?(写出计算 步骤)
们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样 (假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实 验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如右图 像:试回答(计算结果精确到0. 1%): ⑴写出实验中有关的化学方程式:_______________ 。 ⑵实验I中铁参加反应的质量为 ___________。 ⑶稀硫酸完全参加反应的实验中,反应四:在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其
中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量 与所滴入Na2CO3溶液的质量关系曲线如图所示: 请根据题意回答问题: (1)在实验过程中,有气体放出,还可以看到的明显实验现象 是____________ (2)在实验过程中放出气体的总质量为 ______ g。 (3)当滴入Na2CO3溶液至图中B点时,通过计算求此所得不饱 和溶液中溶质质量分数是多少?(计算结果精确到0.1%)
练习七:某化工厂制取硝酸铜有以下两种途径:
铜与稀硝酸反应,反应的化学方程式为: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O, 生成的一氧化氮在空气中很容易被氧化成二氧化氮。 铜与浓硝酸反应,反应的化学方程式为: Cu+4HNO3(浓)=Cu(NO3)2+2X↑+2H2O (1)试确定X的化学式为______。硝酸铜中氮元素的化合价_______ 。 (2)对比A、B两个反应可得出的结论______________________。 (3)一氧化氮、二氧化氮都是大气污染物,在生产中要尽可能减少 排放,试判断:若要制得等质量的硝酸铜,以上哪种途径较好?请说 明理由。(至少两条) (4)根据所学知识,设计制取硝酸铜更合理的途径为先将铜在空气 中加热转化为氧化铜,然后用氧化铜与硝酸反应制得硝酸铜,有关反 应的化学方程式为______________________________ , __________________________________________。 若取6.4g铜加入到50g某稀硝酸中,恰好完全反应,计算原稀硝酸中溶 质的质量分数。
初中化学计算题及答案

初中化学计算题及答案1. 摩尔质量计算题问题:计算下列物质的摩尔质量:1.氧气(O₂)2.纯净水(H₂O)3.二氯甲烷(CH₂Cl₂)解答:1.氧气(O₂):–分子式:O₂–摩尔质量计算:16.00 g/mol × 2 = 32.00 g/mol2.纯净水(H₂O):–分子式:H₂O–摩尔质量计算:1.01 g/mol × 2 + 16.00 g/mol = 18.02 g/mol3.二氯甲烷(CH₂Cl₂):–分子式:CH₂Cl₂–摩尔质量计算:1.01 g/mol × 2 + 12.01 g/mol + 35.45 g/mol +35.45 g/mol = 84.93 g/mol2. 配化计算题问题:已知某化合物的分子式为FeSO₄·7H₂O,要制备10 g该化合物,需使用多少克硫酸铁(III)七水合物和多少 mL稀硫酸?给定原子的相对原子质量(RAM)如下:•Fe: 55.85 g/mol•S: 32.07 g/mol•O: 16.00 g/mol•H: 1.01 g/mol解答:1.计算硫酸铁(III)七水合物的摩尔质量:–分子式:FeSO₄·7H₂O–摩尔质量计算: 55.85 g/mol (Fe) + 32.07 g/mol (S) + 4 *16.00 g/mol (O) + 7 * (2 * 1.01 g/mol) (H) + 7 * 16.00 g/mol (O) =278.02 g/mol2.计算10 g化合物的摩尔量:–摩尔质量计算:10 g ÷ 278.02 g/mol = 0.036 mol3.计算所需硫酸铁(III)七水合物的质量:–质量计算: 0.036 mol × 278.02 g/mol = 10.01 g所以需要使用10.01 g硫酸铁(III)七水合物。
4.计算所需硫酸的体积:–硫酸的摩尔质量:98.09 g/mol–摩尔质量计算:0.036 mol × 98.09 g/mol = 3.53 g–由于硫酸的密度约等于1 g/cm³,所以质量和体积相等: 3.53 mL所以需要使用3.53 mL稀硫酸。
初中化学计算题大全(含答案及解析)

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
中考化学计算题-经典压轴题及答案解析

一、中考初中化学计算题1.现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案(假设反应都是充分完全):(实验数据)实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4 g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10 g。
根据实验设计及有关数据进行分析与计算:(1)实验中生成的气体用氢氧化钠溶液吸收时发生的反应方程式为__________。
(2)混合溶液中CaCl2的质量分数为_______?(写出计算过程,保留结果至0.1%,下同)(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数为_______?(不考虑过滤中的损失。
)【答案】CO2+2NaOH═Na2CO3+H2O11.1%8.2%【解析】(1)根据二氧化碳与氢氧化钠的反应写出反应的化学方程式;(2)由题意可以知碳酸钠与氯化钙反应生成了碳酸钙沉淀和氯化钠,根据沉淀的质量可求出氯化钙、碳酸钠、氯化钠的质量,据此可计算出混合溶液中CaCl2的质量分数;(3)根据图中数据可以知道生成二氧化碳的质量为4.4g,结合碳酸钠和盐酸反应的化学方程式可以求出碳酸钠的质量、氯化钠的质量,再根据溶质质量分数的计算公式计算出混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数。
(1)根据题意可知,混合液中的稀盐酸与碳酸钠反应生成的二氧化碳气体与氢氧化钠反应生成了碳酸钠和水,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O;(2)设混合溶液中CaCl2的质量为x、生成的氯化钠的质量为y,与氯化钙反应的碳酸钠的质量为z。
CaCl2+Na2CO3═CaCO3↓+2NaCl111 106 100 117x z 10g y11110610011710x z g y===x=11.1gy=11.7gz=10.6g∴混合溶液中CaCl2的质量分数为11.1g100g×100%=11.1%;(3)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,设与盐酸反应的碳酸钠的质量为m,生成的氯化钠的质量为n。
初中化学初三化学较难经典计算题及答案.doc

初中化学初三化学较难经典计算题及答案姓名:_____________ 年级:____________ 学号:______________一、选择题(共5题) 1.X 、Y 两元素间能形成多种化合物,已知其中一种化合物XY 中,X 元素的质量分数为46.7%,则下列化合物中X 的质量分数大于46.7%的是( )A.XY2B.X2Y3C.X2YD.X2Y5【答案】分析:在化合物XY 中,X 原子个数与Y 原子个数之比为1:1,X 元素的质量分数为46.7%,则Y 元素的质量分数为1—46.7%=53.3%,从而得出X 元素原子的相对质量与Y 元素原子的相对质量之比为46.7:53.5,二者之比接近1:1。
因此要使X 元素的质量分数大于46.7%,则要求化合物中X 原子的个数比Y 原子的个数要多,在四个备选答案中只有C 符合要求。
答案为C 。
难度:中等 知识点:化学式与化合价2.有一包FeSO4、Fe2(SO4)3的固体混合物,已测定铁元素的质量分数为34%,则混合物中硫元素的质量分数是( )A. 22%B. 44%C. 24%D. 25%【答案】 分析:FeSO4、Fe2(SO4)3由Fe 、S 、O 三种元素组成,且其中S 和O 的原子个数比相同,则不论两种盐以何种比例混合,S 和O 的原子个数比总为1:4,质量比恒为32:16×4=1:2。
现铁的质量分数为34%,则S 和O 的质量分数总和为1—34%=66%,故其中硫的质量分数为22%,氧的质量分数为44%。
答案为B 。
难度:中等 知识点:化学式与化合价3.在NaHSO4与MgSO4的混合物中,已知硫元素的质量分数为26.7%,则原混合物中钠元素与镁元素的质量比为———————————————————( )A 一定为23:24B 一定为1:1C 可以为任意比D 以上均错【答案】C难度:偏难 知识点:酸和碱单元测试4.现将8g SO3溶于92g 水,所形成的溶液中溶质的质量分数为------------( )A8% B9.8% C8.7% D10.7%【答案】B难度:中等 知识点:溶质的质量分数5.在 X+2Y=R+2M 的反应中,已知 R 和M 的相对分子质量之比为1:2,当1.5g X 和足量的Y 反应,生成3.6g 的M 。
初中化学化学量的计算练习题及答案

初中化学化学量的计算练习题及答案一、选择题1. 下列元素化合价最高的是:A. 碳B. 氮C. 氧D. 氟2. 在氢和氯的化合物中,氯元素的电价是:A. +1B. -1C. +3D. -33. 铁的电子构型为1s²2s²2p⁶3s²3p⁶4s²3d⁶,铁的化合价最高为:A. +2B. +3C. +4D. +64. 以下物质中,化学式正确的是:A. NaNO₂B. Ca(ClO₃)₂C. Al₂(SO₄)₃D. Mg₃N₂5. 在下列物质中,原子价量最大的是:A. H₂SO₄B. FeSO₄C. Na₂SO₃D. KNO₂二、填空题1. 氯气由固态变为液态的温度为□℃。
2. 实验室常用的酸是氢氧化钠,化学式为□。
3. 硝酸和钾反应后生成的化合物是□。
4. 摩尔质量为26g/mol的氢氧化钠的氢的质量是□g。
5. 钠的电子构型为□。
三、计算题1. 计算H₂SO₄溶液的质量浓度,已知溶液中含有80g的H₂SO₄,体积为500mL。
2. 一根铁丝的质量为2.0g,完全被氧化后质量变为2.8g,求生成的铁(III)氧化物的质量。
3. 某化合物由铁和氧组成,质量比为7:2。
已知该化合物的质量为180g,求铁的质量和氧的质量分别是多少?四、解答题1. 硫酸的化学式为H₂SO₄,求硫酸的相对分子质量。
2. 硝酸铵的化学式为NH₄NO₃,求硝酸铵的分子中氮元素的质量百分比。
3. 电价为+2和-3的两种金属元素结合生成化合物,求它们的化学式。
答案及解析:一、选择题1. C 元素化合价的最高值通常等于元素的主族数。
2. D 氯元素在化合物中通常带有-1的电价。
3. C 铁的化合价最高为+6,可以通过电子构型来确定。
4. C 各选项中只有Al₂(SO₄)₃的化学式是正确的。
5. B 铁的化合价为+2,而且FeSO₄中铁的质量比其他选项中的元素的质量都大。
二、填空题1. -34℃氯气在常温下为气态,需要降低温度才能使其变为液态。
初中经典化学试题及答案

初中经典化学试题及答案一、选择题1. 化学变化的基本特征是:A. 有新物质生成B. 有能量释放B. 有颜色变化D. 有气体产生答案:A2. 以下哪个元素的化学符号是正确的?A. 铁 - FeB. 铜 - CuC. 氧 - O2D. 氢 - H2答案:A3. 根据题目所给的化学反应方程式,计算反应物和生成物的摩尔比:2H2 + O2 → 2H2OA. 1:1B. 2:1C. 1:2D. 2:2答案:B二、填空题4. 氧气的化学式是_________。
答案:O25. 根据题目所给的化学方程式,写出下列反应的类型:2HgO → 2Hg + O2↑答案:分解反应三、简答题6. 什么是质量守恒定律?请简述其内容。
答案:质量守恒定律是指在一个封闭系统中,无论发生何种化学反应或物理变化,系统总质量保持不变。
即反应前后物质的总质量是相等的。
四、计算题7. 某化学反应中,需要3摩尔的氢气(H2)与1摩尔的氧气(O2)反应生成水。
如果实验室中有6摩尔的氢气,那么理论上可以生成多少摩尔的水?答案:根据化学方程式2H2 + O2 → 2H2O,可以知道2摩尔的氢气与1摩尔的氧气反应生成2摩尔的水。
实验室中有6摩尔的氢气,可以与3摩尔的氧气反应生成6摩尔的水。
五、实验题8. 描述实验室中制备氧气的实验步骤。
答案:首先,将过氧化氢溶液倒入试管中,然后加入少量的二氧化锰作为催化剂。
接着,将试管放在铁架台上,并使用酒精灯加热试管底部。
加热过程中,过氧化氢分解生成氧气和水,氧气会从试管中冒出。
最后,使用排水法收集氧气。
结束语:化学是一门以实验为基础的科学,通过本试题的练习,希望同学们能够加深对化学基本概念和原理的理解,提高实验操作能力和化学计算能力。
同时,也希望同学们能够培养科学探究的兴趣和能力,为未来的学习打下坚实的基础。
