原子物理知识点汇总
高考物理原子物理知识点

高考物理原子物理知识点高考物理原子物理知识点:1. 元素的构成:原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,质量约为1.67x10^-27 kg;中子不带电荷,质量约为1.67x10^-27 kg;电子带负电荷,质量约为9.11x10^-31 kg。
2. 原子核结构:原子核是由质子和中子组成的,质子数称为原子序数(Z),中子数称为中子数(N)。
原子核的相对质量约为质子和中子质量之和的2000倍,核半径约为1x10^-15 m。
3. 原子的电子结构:根据量子力学理论,电子在原子中分布在能级轨道上。
能级越高,能量越大。
原子的电子结构可用电子排布规则(如阿贝尔规则、泡利不相容原理、洪特规则)来描述。
4. 常见粒子的特性:α粒子为带2倍正电荷的氦核,具有较大质量和能量;β粒子分为β+粒子(正电子)和β-粒子(电子),它们是由原子核中的质子或中子发生转化而产生的;γ射线为电磁波,无电荷、无质量,具有很高的穿透能力。
5. 放射性衰变:放射性元素具有不稳定的原子核,通过放射性衰变放出高能辐射。
常见的放射性衰变类型有α衰变、β衰变和γ衰变。
6. 核反应与核能:核反应是指核的变化过程,可分为裂变和聚变。
核能是核反应释放出的能量,具有很高的能量密度。
目前,核裂变用于发电,而核聚变仍处于研究阶段。
7. 半衰期:半衰期是指放射性物质在衰变过程中,其活度减少到初始活度的一半所需的时间。
不同放射性物质具有不同的半衰期,可用来判断物质的放射性强度和使用寿命。
8. 量子力学概念:量子力学是研究微观粒子行为的理论框架。
量子力学描述了微观粒子的双重性质,即粒子和波动性的统一性。
常见的量子力学概念包括波函数、不确定性原理、叠加态等。
9. 布居数分析:布居数分析是指根据原子能级和电子排布规则,推导出原子的电子结构和能级布居情况的方法。
布居数分析有助于理解原子的电子构型和性质。
10. 原子物理应用:原子物理在现代科技中有广泛的应用,如核能利用、医学放射治疗、核磁共振成像、半导体器件等。
原子物理知识点总结全

原子物理知识点总结全原子物理是研究原子的结构、性质和相互作用的科学领域。
在这里,我将总结一些重要的原子物理知识点。
1.原子结构:原子是由质子、中子和电子组成的。
质子和中子位于原子的核心,称为原子核,而电子则绕着原子核旋转。
2.元素和同位素:元素是由具有相同质子数的原子组成的,而同位素是具有相同质子数和不同中子数的原子。
同位素具有相似的化学性质,但质量不同。
3.原子序数和质量数:原子的序数是指原子核中的质子数。
原子的质量数是指原子核中质子和中子的总数。
原子序数决定了元素的化学性质,而质量数决定了同位素的质量。
4.量子力学:量子力学是描述微观粒子行为的理论。
根据量子力学,电子具有波粒二象性,并且其运动是不确定的。
5.薛定谔方程:薛定谔方程是量子力学的基本方程,描述了系统的波函数演化随时间的规律。
波函数包含了关于粒子位置和能量的信息。
6.能级:原子中的电子处于不同的能级。
每个能级对应着一定的能量。
电子可以通过吸收或释放能量来跃迁到不同的能级。
7.能级跃迁:当电子从高能级跃迁到低能级时,会释放光子,产生光谱线。
这种现象被称为原子的能级跃迁。
8.原子吸收光谱和发射光谱:原子在吸收能量时会产生吸收光谱,而在释放能量时会产生发射光谱。
通过研究这些光谱线,可以了解原子的结构和能级。
9.布拉格反射:布拉格反射是一种光的衍射现象,用于测量晶体中原子的间距。
这个原理是X射线晶体衍射的基础。
10.量子力学中的不确定性原理:不确定性原理表明,无法同时精确测量粒子的位置和动量,或同时测量能量和时间。
这是因为测量的过程会改变粒子的状态。
11.原子核:原子核由质子和中子组成,它们通过强相互作用力相互吸引。
原子核中的质子带正电,而中子不带电。
12.核衰变:核衰变是指原子核不稳定,释放能量和粒子以变得更加稳定的过程。
常见的核衰变方式包括α衰变、β衰变和γ衰变。
13.核力与离子束:核力是原子核中质子和中子之间相互作用的力。
离子束是由带电原子核组成的粒子束。
(完整版)原子物理知识点汇总(最新整理)
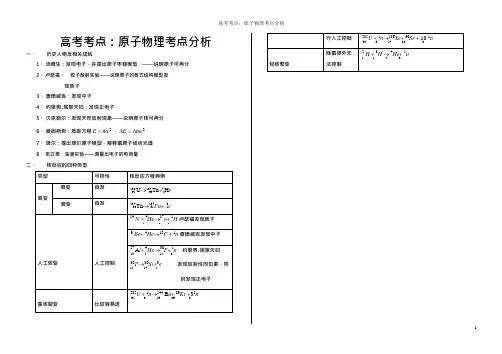
高考考点:原子物理考点分析一、历史人物及相关成就1、汤姆生:发现电子,并提出原子枣糕模型——说明原子可再分2、卢瑟福:粒子散射实验——说明原子的核式结构模型发现质子3、查德威克:发现中子4、约里奥.居里夫妇:发现正电子5、贝克勒尔:发现天然放射现象——说明原子核可再分6、爱因斯坦:质能方程E =mc2,∆E =∆mc27、玻尔:提出玻尔原子模型,解释氢原子线状光谱8、密立根:油滴实验——测量出电子的电荷量二、核反应的四种类型类型可控性核反应方程典例衰变衰变自发238 U→234 Th+4 H e92 90 2衰变自发234 Th→234Pa+0e90 91 -114N +4He→17o+1H 卢瑟福发现质子7 2 8 19Be+4He→12C +1n 查德威克发现中子4 2 6 0人工转变人工控制27A l +4He→30P+1n 约里奥.居里夫妇13 2 15 030P→30Si+0e 发现放射性同位素,同15 14 1时发现正电子重核裂变比较容易进235U +1n→144 B a+89Kr +31n92 0 56 36 0行人工控制235U +1n→136Xe+90Sr + 10 1n92 0 54 38 0轻核聚变除氢弹外无法控制2H +3H →4He+1n1 12 0提醒:1、核反应过程一般都是不可逆的,所以核反应方程只能用单箭头表示反应方向,不能用等号连接。
2、核反应的生成物一定要以实验事实为基础,不能凭空只依据两个守恒定律杜撰出生成物来写出核反应方程3、核反应遵循质量数守恒而不是质量守恒,遵循电荷数守恒射线( 4He)2 射线( 0e)1射线提醒:1、半衰期:表示原子衰变一半所用时间2、半衰期由原子核内部本身的因素据顶,跟原子所处的物理状态(如压强、温度)或化学状态(如单质、化合物)无关3、半衰期是大量原子核衰变时的统计规律,个别原子核经多长时间衰变无法预测,对个别或极少n1 数原子核,无半衰期而言。
原子物理知识点详细汇总

第一讲 原 子 物 理自1897年发现电子并确认电子是原子的组成粒子以后,物理学的中心问题就是探索原子内部的奥秘,经过众多科学家的努力,逐步弄清了原子结构及其运动变化的规律并建立了描述分子、原子等微观系统运动规律的理论体系——量子力学。
本章简单介绍一些关于原子和原子核的基本知识。
§1.1 原子1.1.1、原子的核式结构1897年,汤姆生通过对阴极射线的分析研究发现了电子,由此认识到原子也应该具有内部结构,而不是不可分的。
1909年,卢瑟福和他的同事以α粒子轰击重金属箔,即α粒子的散射实验,发现绝大多数α粒子穿过金箔后仍沿原来的方向前进,但有少数发生偏转,并且有极少数偏转角超过了90°,有的甚至被弹回,偏转几乎达到180°。
1911年,卢瑟福为解释上述实验结果而提出了原子的核式结构学说,这个学说的内容是:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外的空间里软核旋转,根据α粒子散射的实验数据可估计出原子核的大小应在10-14nm 以下。
1、1.2、氢原子的玻尔理论 1、核式结论模型的局限性通过实验建立起来的卢瑟福原子模型无疑是正确的,但它与经典论发生了严重的分歧。
电子与核运动会产生与轨道旋转频率相同的电磁辐射,运动不停,辐射不止,原子能量单调减少,轨道半径缩短,旋转频率加快。
由此可得两点结论:①电子最终将落入核内,这表明原子是一个不稳定的系统; ②电子落入核内辐射频率连续变化的电磁波。
原子是一个不稳定的系统显然与事实不符,实验所得原子光谱又为波长不连续分布的离散光谱。
如此尖锐的矛盾,揭示着原子的运动不服从经典理论所表述的规律。
为解释原子的稳定性和原子光谱的离经叛道的离散性,玻尔于1913年以氢原子为研究对象提出了他的原子理论,虽然这是一个过渡性的理论,但为建立近代量子理论迈出了意义重大的一步。
2、玻尔理论的内容:一、原子只能处于一条列不连续的能量状态中,在这些状态中原子是稳定的,电子虽做加速运动,但并不向外辐射能量,这些状态叫定态。
(完整版)原子核物理知识点归纳详解

原子核物理重点知识点第一章 原子核的基本性质1、对核素、同位素、同位素丰度、同量异位素、同质异能素、镜像核等概念的理解。
(P2)核素:核内具有一定质子数和中子数以及特定能态的一种原子核或原子。
(P2)同位素:具有相同质子数、不同质量数的核素所对应的原子。
(P2)同位素丰度:某元素中各同位素天然含量的原子数百分比。
(P83)同质异能素:原子核的激发态寿命相当短暂,但一些激发态寿命较长,一般把寿命长于0.1s 激发态的核素称为同质异能素。
(P75)镜像核:质量数、核自旋、宇称均相等,而质子数和中子数互为相反的两个核。
2、影响原子核稳定性的因素有哪些。
(P3~5)核内质子数和中子数之间的比例;质子数和中子数的奇偶性。
3、关于原子核半径的计算及单核子体积。
(P6)R =r 0A 1/3 fm r 0=1.20 fm 电荷半径:R =(1.20±0.30)A 1/3 fm 核力半径:R =(1.40±0.10)A 1/3 fm 通常 核力半径>电荷半径单核子体积:A r R V 3033434ππ==4、核力的特点。
(P14)1.核力是短程强相互作用力;2.核力与核子电荷数无关;3.核力具有饱和性;4.核力在极短程内具有排斥芯;5.核力还与自旋有关。
5、关于原子核结合能、比结合能物理意义的理解。
(P8)结合能:),()1,0()()1,1(),(),(2A Z Z Z A Z c A Z m A ZB ∆-∆-+∆=∆= 表明核子结合成原子核时会释放的能量。
比结合能(平均结合能):A A Z B A Z /),(),(=ε原子核拆散成自由核子时外界对每个核子所做的最小平均功,或者核子结合成原子核时平均每一个核子所释放的能量。
6、关于库仑势垒的理解和计算。
(P17)1.r>R ,核力为0,仅库仑斥力,入射粒子对于靶核势能V (r ),r →∞,V (r ) →0,粒子靠近靶核,r →R ,V (r )上升,靠近靶核边缘V (r )max ,势能曲线呈双曲线形,在靶核外围隆起,称为库仑势垒。
高中原子物理知识点归纳

高中原子物理知识点归纳
1.原子结构
-原子是由带正电的原子核和围绕核运动的电子组成的。
-原子核由质子和中子构成,质子带有正电荷,中子则是中性的。
-电子分布在不同的能级上,每个能级对应一定的能量。
-能级结构可以用波尔模型或者量子力学的薛定谔方程来描述,能级之间的跃迁伴随着能量的变化,这对应着原子光谱的现象。
-核内的质子和中子可以通过核反应(如裂变、聚变)释放或吸收能量。
2.原子核的特性
-原子核的质量远大于电子,集中在原子的中心部位。
-原子核大小与原子整体相比很小,但密度极高。
-卢瑟福通过α粒子散射实验证实了原子的核式结构模型,即大部分空间是空的,电子在核外空间运动。
3.原子序数与核电荷数
-原子序数等于原子核内质子的数量,决定了元素的化学性质。
-原子的核电荷数等于质子数,也等于核外电子总数(在中性原子中)。
4.放射性衰变
-放射性元素自发发生核转变,释放出α粒子、β粒子(电子或正电子)或γ射线等形式的能量。
-放射性衰变遵循一定的半衰期规律。
5.核能与核反应
-核能来源于核子重组过程中释放的能量,如核裂变(如铀-235的链式反应)和核聚变(如氢弹中的氘氚反应)。
6.量子数与电子排布
-电子在原子轨道中的排布遵循泡利不相容原理、洪特规则等,形成了元素周期表中的电子构型。
7.原子光谱
-当电子在不同能级之间跃迁时,会发射或吸收特定波长的光,形成原子的发射光谱和吸收光谱。
原子物理学知识点总结
原子物理学知识点总结原子物理学是研究原子结构和性质的一门物理学科,它是现代物理学的分支之一。
原子理论自古希腊时代就已经存在,但直到19世纪末到20世纪初,人们才开始对原子的结构和性质有了深入的了解。
本文将介绍原子物理学的基本知识点,包括原子的结构、原子核、原子的性质以及原子与分子之间的相互作用等内容。
1. 原子的结构原子是一切物质的基本单位,它主要由电子、质子和中子组成。
根据基本粒子理论,电子、质子和中子是构成原子的基本粒子。
电子是带负电荷的粒子,质子是带正电荷的粒子,中子是不带电的粒子。
在原子结构模型中,质子和中子集中在原子核中,而电子则绕核轨道运动。
根据量子力学理论,电子在轨道上的运动是离散的,即只能位于某些特定的能级上。
这些能级被称为电子壳层,不同的电子壳层对应不同的能量。
2. 原子核原子核是原子的中心部分,它由质子和中子组成,质子和中子统称为核子。
质子和中子是由夸克组成的,它们之间通过强相互作用相互吸引。
在原子核中,质子带正电,中子不带电,它们通过强相互作用相互结合在一起。
原子核的直径通常在10^-15米的数量级上,而原子的直径通常在10^-10米的数量级上,原子核的大小远远小于原子的大小。
3. 原子的性质原子的性质主要包括原子的质量、原子的电荷、原子的半径、原子的稳定性等。
原子的质量主要取决于原子核中质子和中子的质量,而电子的质量可以忽略不计。
原子的电荷等于质子数减去电子数,因此原子的电荷通常为正数或负数。
原子的半径通常用原子量子半径或科学常数玻尔半径来描述。
原子的稳定性与原子核的内部结构有关,对于较轻的原子来说,稳定的原子核通常满足质子数和中子数之比在1:1附近,而对于较重的原子来说,稳定的原子核通常含有更多的中子以保持稳定。
4. 原子与分子之间的相互作用原子与分子之间的相互作用是原子物理学研究的另一个重要内容。
原子和分子之间存在分子间力,包括范德华力、静电吸引力、静电斥力等。
范德华力是由于分子极化而产生的吸引力,静电吸引力是由于正负电荷之间的相互作用而产生的吸引力,静电斥力则是由于同性电荷之间的相互作用而产生的斥力。
高中物理原子物理知识点总结
高中物理原子物理知识点总结一、原子的组成原子是物质的基本单位,由原子核和电子组成。
原子核位于原子的中心,由质子和中子组成,质子带正电荷,中子不带电荷;电子绕着原子核运动,带负电荷。
二、原子的结构1. 核原子核的直径约为10^-15米,质子和中子都存在于核中。
质子的质量大约是中子的1.6726219 × 10^-27 千克,它们的电量相等,大小为1.60217662 × 10^-19 库仑。
2. 电子壳层电子围绕在原子核外部的轨道上,称为电子壳层。
电子壳层的数量决定了原子的大小。
第一层能容纳最多2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
三、原子的质量数和原子序数原子的质量数是指原子核中质子和中子的总数。
原子的质量数通常用字母A表示。
原子的原子序数是指原子核中质子的个数,也称为元素的序数。
原子的原子序数通常用字母Z表示。
四、同位素同位素是指化学元素原子中,质子数相同,中子数不同的原子。
同位素具有相同的化学性质,但物理性质可能有所不同。
五、原子的电离原子的电离是指从一个原子中剥离出一个或多个电子形成带电离子的过程。
当原子失去电子后变为带正电荷的离子,称为正离子;当原子获得电子后变为带负电荷的离子,称为负离子。
六、电子能级和电子排布规则电子能级是指电子在原子中的能量状态。
电子按照一定的能级顺序依次填充到不同的能级中。
根据泡利不相容原理和伯利斯规则,电子排布规则如下:1. 每个能级最多只能容纳一定数量的电子;2. 电子填充时要先填满较低的能级;3. 每个能级的轨道填充电子时,按照上层轨道的能级对轨道进行排布。
七、原子的能级跃迁原子的能级跃迁是指电子在不同能级之间跃迁的过程。
根据能级跃迁所产生的能量差异,原子可以发射光线,这种现象称为光谱。
八、原子核的衰变和辐射原子核可以通过放射性衰变进行变化,衰变过程伴随着放射性辐射的释放。
常见的原子核衰变方式包括α衰变、β衰变和γ衰变。
原子物理知识点汇总
原子物理知识点汇总原子物理是研究原子的结构和性质的科学领域,涉及到原子的核心结构、电子能级、原子间相互作用等方面的知识。
下面是一些与原子物理相关的知识点的汇总。
1.原子的组成:原子由原子核和围绕在核外的电子组成。
原子核由质子和中子组成,而电子带有负电荷。
2.元素和同位素:不同原子核内质子和中子的数量决定了元素的性质。
同一元素中质子数量相同但中子数量不同的原子被称为同位素。
3.原子的质量数和原子序数:原子的质量数等于质子和中子的总数。
原子序数等于质子的数量。
原子序数也决定了元素的化学性质。
4.原子的大小和电子云:原子的大小通常用原子半径来衡量。
原子半径与原子核半径相比很小,而都围绕在原子核周围的电子云则较大。
电子云是电子的概率分布。
5.原子核的结构:原子核内的质子和中子以一种称为核力的强相互作用力相互结合。
原子核由质子和中子组成,其中质子带正电荷,中子不带电。
6.质子数与元素周期表:元素周期表是按原子序数顺序排列的化学元素表。
元素周期表中的每个元素都有一个唯一的原子序数,这对应了元素的质子数。
7.原子的电子结构:电子以不同的能级(或轨道)存在于原子中。
电子能级是原子中电子的允许能量值,每个能级可以容纳一定数量的电子。
8.电子能级和壳层:电子能级以壳层的形式存在。
第一壳层最靠近原子核,可以容纳最多2个电子。
第二壳层可以容纳最多8个电子。
其他壳层的容纳量依次增加。
9.量子力学和电子的波粒二象性:根据量子力学理论,电子既具有波动性又具有颗粒性。
电子的波动性表现在它在原子中形成的脉动波函数上,而电子的颗粒性则表现为它在测量时被观察到的位置和动量的特定值。
10.原子光谱:当电子从一个能级跃迁到另一个能级时,会吸收或发射特定波长的光,形成原子光谱。
原子光谱可以用来确定元素的组成和电子能级的结构。
11.张量力和强相互作用:质子和中子之间的相互作用力称为张量力。
张量力是一种强相互作用力,负责保持原子核的稳定。
12.电子云和化学键:在化学反应中,原子通过共享或转移电子来形成化学键。
原子物理学知识要点总结
E s
仍与
j
有关。
能量E由
n, l , j 三个量子数决定。
碱金属原子能级的分裂 当
0
时,
1 j 2
当 0 时,
j
1 2
1 j 能级不分裂 2 2 *4 Rhc Z El , s 1 3 2n (l )(l 1) 2 Rhc 2 Z *4 El , s 1 3 2n l (l ) 2
第一章 原子的基本状况 主要内容:原子的质量和大小、原子的核式结构、α粒子散 射实验(重点)。 基本要求: (1)掌握估算原子大小的方法、理解原子量的定义和原子量、 原子质量的计算。 (2)了解汤姆逊模型的要点和遇到的困难;理解卢瑟福核式 结构的要点和提出核式结构的实验依据;
原子的质量
原子质量单位和原子量 各种原子的质量各不相同,常用它们的相对值原子量。 原子质量单位:
表
自旋多重度,表示原子态的多重数。对碱原子 2 s 1 S 态虽然是单层(重)能级,仍表示为:2 S
2
例: 3 2 P 表示: n 3, 1, j 3/ 2 的原子态,多重度:2 3/ 2
Li原子能级图(考虑精细结构,不包括相对论修正)
单电子辐射跃迁选择定则
1、选择定则 单电子辐射跃迁(吸收或发射光子)只能在下列条件下发生:
l
: 量子数亏损
能级图
0 5 4
s
=0 5 4 3 3
p =1 5 4 3
d =2 5 4
f =3 H 7 6 5 4 3
10000
柏 格 曼 系
20000 2
30000
2
40000
厘米-1
2
锂原子能级图
锂的四个线系
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考考点:原子物理考
点分析一、历史人物及相关成就
1、汤姆生:发现电子,并提出原子枣糕模型——说明原子可再分
2、卢瑟福: 粒子散射实验—
—说明原子的核式结构模型
发现质子
3、查德威克:发现中子
4、约里奥.居里夫妇:发现正电子
5、贝克勒尔:发现天然放射
现象——说明原子核可再分6、爱因斯坦:质能方程2mc E=,
2
mc
E∆
=
∆
7、玻尔:提出玻尔原子模型,解释氢原子线状光谱8、密立根:油滴实验——测
量出电子的电
荷量
二、核反应的
四种类型
类型可
控
性
核反应
例
衰
变
α衰
变
自
发
β衰
变
自
发
人工转变人
工
控
制
H
o
He
N1
1
17
8
4
2
14
7
+
→
+卢
瑟福
发现质子
n
C
He
Be1
12
6
4
2
9
4
+
→
+查
德威
克发现中子
n
P
He
l1
30
15
4
2
27
13
A+
→
+约里
奥.居里夫妇
e
Si
P0
1
30
14
30
15
+
→发
重核裂变比较容易进行人工控制
轻核聚除
变氢
弹
外
无
法
控
制
提醒:
1、核反应过程一般都是不可逆的,所以核反
应方程只能用单箭头表示反应方向,不能用等号连接。
2、核反应的生成物一定要以实验事实为基础,不能凭空只依据两个守恒定律杜撰出生成物来写出核
反应方程
3、核反应遵循质量数守恒而不是质量守恒,遵循电荷数守恒
三、三种射线比较
种
类
速
度
0.1c 0.99c C
在电磁场中偏转与a射
线反向
偏转
不偏转
贯穿本领最弱,
用纸能
挡住
较强,
穿透几
毫米的
铝板
最强,
穿透几
厘米的
铅板
对
空
气
的
电
离
作
用
很强较弱
在空气中的径迹粗、短、
直
细、较
长、曲
折
最长
通
过
胶
片
感光感光感光
产生机制核内两
个中子
和两个
质子结
合的比
较紧
密,有
时会作
为一个
整体从
较大的
核内的
中子可
以转化
为一个
质子和
一个电
子,产
生的电
子从核
内发射
出来
放射性
原子核
在发生
两种衰
变后产
生得新
核往往
处于高
能级,
当它向
低能级
原子核
抛射出
来
提醒:
1、半衰期:表示
原子衰变一半
所用时间
2、半衰期由原
子核内部本身
的因素据顶,跟
原子所处的物理状态(如压强、温度)或化学状态(如单质、化合物)无关
3、半衰期是大量原子核衰变时的统计规律,个别原子核经多长时间衰变
无法预测,对个别或极少数原子核,无半衰期而言。
4、放射性同位素的应用:(1)工业、摊上、农业、医疗等(2)作为示踪原子
四、原子结构
1、原子的核式
结构模型(1)α粒子散射实验结果:
绝大多数α粒子穿过金箔后仍沿原来的方向前进,少数α粒子发生了较大偏转,极少数α粒子甚至被反弹回来。
(2)原子的核式结构模型:
在原子中心有一个很小的原子核,原子全部的正电荷和几乎全部质量都集中在核里,带负电的电子在核外空间绕核旋转。
(3)原子核的尺度:原子核直径的
数量级为10-15m,原子直径的数量级约为10-10m。
(4)原子核的组成:原子核是由质子和中子组成的,原子核的电荷数等于核内的质子数。
2、玻尔原子模型(1)原子只能处于一系列能量不连续的状态中,具有确定能量的未定状态叫定态。
原子处于最低能级的状态叫基态,其他的状态叫激发态。
(2)频率条件:高能m到低能m 态:辐射光子
λ
c
h
E E hv n m =-= (3)原子的不同能量状态对应于电子的不同运行轨道。
五、氢原子光谱 1、氢原子光谱的实验规律 巴耳末系是氢光谱在可见光区的谱线,其波长公式
)为里德伯常量(1722
101.01R ..R .,54,3n )n
1
-21R(
1
-⨯===m λ
2、 氢原子的能
级和轨道半径 (1) 氢原子的能级公式:...)3,2,1(1
1
2
==n E n En 其
中E 1=-3.6ev (2) 氢原子的半径公式:
...)
3,2,1(12=⋅=n r n r n ,其中
r1=0.53
×
10-10m
(3)氢原子能级图:
提醒:
A、原子跃迁条件:n m E E hv-=,只适用于光子和原子作用而使原子在各定态之间跃迁的情况。
对于光子和原子作用而使原子电离时,只要入射光的能量
eV
E6.
13
≥,原子就能吸收,对于实物粒子与原子作用使原子
1 -13.61
2 -3.40
3 -1.51
4 -0.85
5 -0.54
∞ 0
n E/eV
图3
激发时,粒子能量大于或等于能级差即可。
B、原子跃迁发出的光谱线
条数
2)1
( 2-
= =
n n
C
N
n,是一群氢原子,而不是一个,因为某一个氢原子有固
定的跃迁路径。
六、核力与核能
1、核力:原子核内核子间存在的相互作用力
2、特点:强相互作用、短程力,作用范围 1.5×10-15m之内
3、核能
(1)质能方程:一定的能量和一定的质量相联系,物体的总能量和他的质量成正比。
即2mc E=
含义:物体具有的能量与他的质量之间存在简单的正比关系,物体的能量增大,质量也增大,物体的能量减小,质量也减小。
(2)核子在结合成核子时出现质量亏损m∆,吸收的能量也要相应减小。
2mc
E∆
=
∆
原子核分解成核子时要吸收一定的能量,相应的
质量增加m∆,吸收能量2mc
∆
E∆
=
(4)获得方式:重核裂变和轻核聚变
聚变反应比裂变反应平均每个核子放出的能量大约要大3-4倍。
