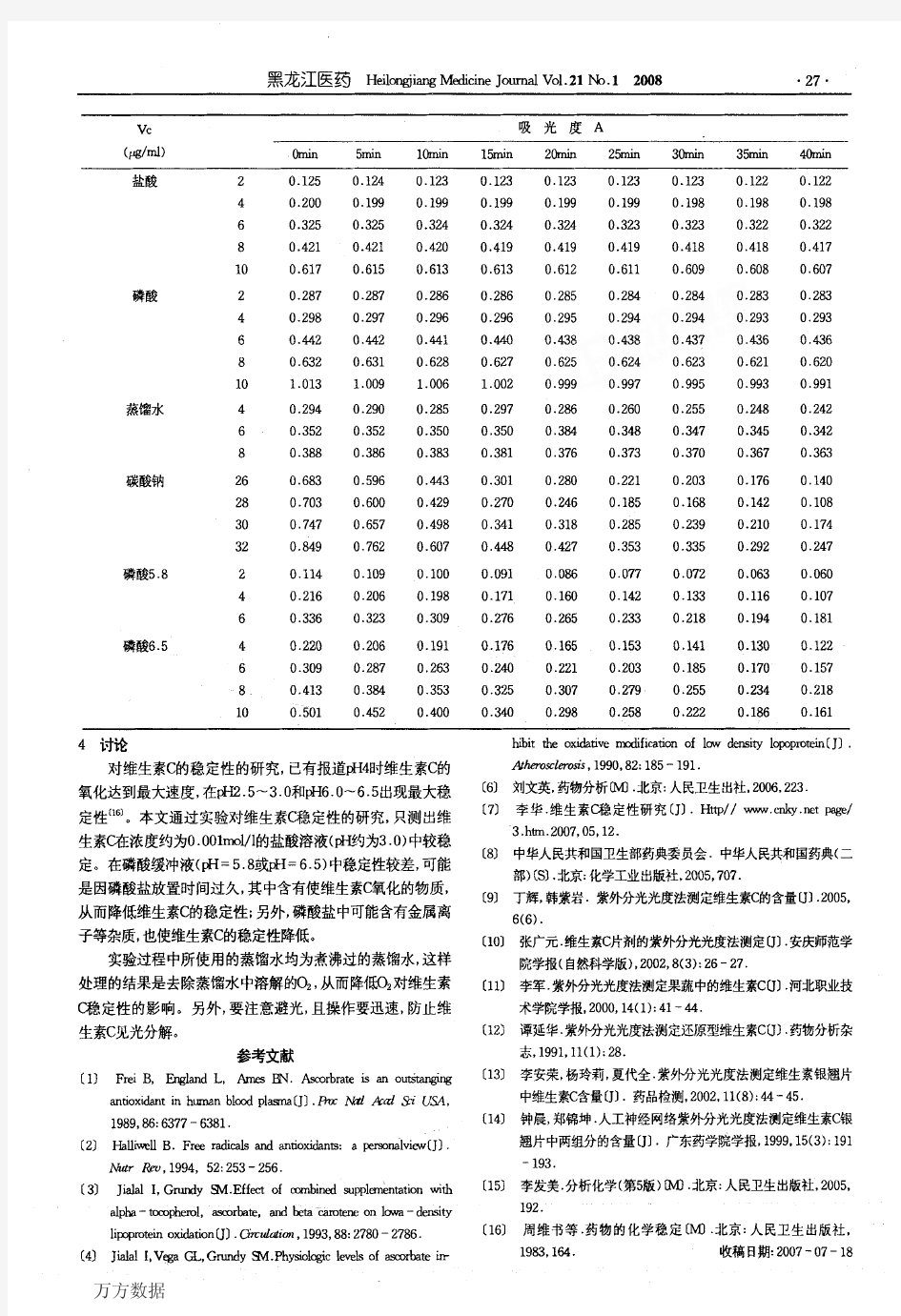
维生素C稳定性紫外分光光度测定法的建立

紫外可见分光光度法
1、什么是透光率?什么是吸光度?什么是百分吸光系数和摩尔吸光系数 2、举例说明生色团和助色团,并解释长移和短移。 4、电子跃迁有哪几种类型?跃迁所需的能量大小顺序如何?具有什么样结构的化合物产生紫外吸收光谱?紫外吸收光谱有什么特征? 5、以有机化合物的基团说明各种类型的吸收带,并指出各吸收带在紫外—可见吸收光谱中的大概位置和各吸收带的特征。 6、紫外吸收光谱中,吸收带的位置受哪些因素影响? 8、用紫外光谱法定量,测量最适宜的吸光度范围为0.2-0.7的依据是什么?为什么用高精度的仪器此范围可以扩大? 11、简述用紫外分光光度法定性鉴别未知物的方法。 13、说明双波长消去法的原理和优点。怎样选择λ1λ2? 15、为什么最好在λmax处测定化合物的含量? 2、Lambert-Beer定律是描述与和的关系,它的数学表达式是 3、紫外-可见分光光度法定性分析的重要参数是和;定量分析的依据是 4、在不饱和脂肪烃化合物分子中,共轭双键愈多,吸收带的位置长移愈多,这是由于 6、可见--紫外分光光度计的光源,可见光区用灯,吸收池可用材料的吸收池,紫外光区光源用灯,吸收池必须用材料的吸收池 10、分光光度法的定量原理是定律,它的适用条件是和,影响因素主要有、。 11、可见-紫外分光光度计的主要部件包括、、、、和5个部分。在以暗噪音为主的检测器上,设△T=0.5%,则吸收度A的测量值在间,由于测量透光率的绝对误差小,使结果相对误差△c/c的值较小。 15、在分光光度法中,通常采用作为测定波长。此时,试样浓度的较小变化将使吸光度产生变化 1、紫外-可见分光光度法的合适检测波长范围是( ) A.400-800 nm B.200-400nm C.200~800nm D.10~200nm 2、下列说法正确的是( )o A.按比尔定律,浓度C与吸光度A之间的关系是一条通过原点的直线 B.比尔定律成立的必要条件是稀溶液,与是否单色光无关 C.E称吸光系数,是指用浓度为1%(W/V)的溶液,吸收池厚度为lcm时所测得吸光度值 D.同一物质在不同波长处吸光系数不同,不同物质在同一波长处的吸光系数相同 3、在乙醇溶液中,某分子的K带λmax计算值为385nm, λmax测定值388nm,若改用二氧六环及水为溶剂,λmax计算值估计分别为( ) (已知在二氧六环和水中的λmax校正值分别为-5和+8) A .二氧六环中390nm,水中37 7nm B.二氧六环中380nm,水中393 nm C.二氧六环中383nm,水中396nm D.二氧六环中393nm,水中380nm 6、1,3-丁二烯有强紫外吸收,随着溶剂极性的降低,其λmax将( ) A.长移 B.短移 C.不变化,但ε增强D.不能断定 8、在紫外-可见光谱分析中极性溶剂会使被测物吸收峰()
紫外分光光度法计算
第20章 吸光光度法 思 考 题 1. 什么叫单色光复色光哪一种光适用于朗伯-比耳定律 答:仅具有单一波长的光叫单色光。由不同波长的光所组成光称为复合光。朗伯--比耳定律应适用于单色光。 2. 什么叫互补色与物质的颜色有何关系 答:如果两种适当的单色光按一定的强度比例混合后形成白光,这两种光称为互补色光。当混合光照射物质分子时,分子选择性地吸收一定波长的光,而其它波长的光则透过,物质呈现透过光的颜色,透过光与吸收光就是互补色光。 3. 何谓透光率和吸光度 两者有何关系 答:透光率是指透射光强和入射光强之比,用T 表示 T = t I I 吸光度是吸光物质对入射光的吸收程度,用A 表示,A εbc =,其两者的关系 lg =-A T 4. 朗伯-比耳定律的物理意义是什么 什么叫吸收曲线 什么叫标准曲线 答:朗伯--比耳定律是吸光光度法定量分析的理论依据,即吸光物质溶液对光的吸收程度与溶液浓度和液层厚度之间的定量关系。数学表达式为 lg A T εbc =-= 吸收曲线是描述某一吸光物质对不同波长光的吸收能力的曲线,即在不同波长处测得吸光度,波长为横坐标,吸光度为纵坐标作图即可得到吸收曲线。 标准曲线是描述在一定波长下,某一吸光物质不同浓度的溶液的吸光能力的曲线,吸光度为纵坐标,浓度为横坐标作图即可得到。 5. 何谓摩尔吸光系数质量吸光系数两者有何关系 答:吸光系数是吸光物质吸光能力的量度。摩尔吸光系数是指浓度为 mol ·L ,液层度为1cm 时,吸光物质的溶液在某一波长下的吸光度。用ε表示,其单位 11cm mol L --??。 质量吸光系数是吸光物质的浓度为1g 1L -?时的吸光度,用a 表示。其单位 11cm g L --?? 两者的关系为 εM a =? M 为被测物的摩尔质量。 6. 分光光度法的误差来源有哪些 答:误差来源主要有两方面,一是所用仪器提供的单色光不纯,因为单色光不纯时,朗伯—比耳定律中吸光度和浓度之间的关系偏离线性;二是吸光物质本身的化学反应,其结果同样
紫外可见分光光度法含量测定word版本
紫外可见分光光度法 含量测定
精品文档 【含量测定】照紫外-可见分光光度法(附录V A)测定。 1.仪器与测定条件:室温:____℃相对湿度:____% 分析天平编号:;水浴锅编号:; 紫外可见分光光度计编号:; 2.对照品溶液的制备: 取西贝母碱对照品适量,精密称定,加三氯甲烷制成每1ml含_______mg的溶液,即得。 3. 供试品溶液的制备: 取本品粉末(过三号筛)约______g,精密称定,置具塞锥形瓶中,加浓氨试液3ml,浸润1小时。加三氯甲烷-甲醇(4:1)混合溶液40ml,置80℃水浴加热回流2小时,放冷,滤过,滤液置50ml量瓶中,用适量三氯甲烷-甲醇(4:1)混合溶液洗涤药渣2~3次,洗液并入同一量瓶中,加三氯甲烷-甲醇(4:1)混合溶液至刻度,摇匀,即得。 4.标准曲线的制备: 精密量取对照品溶液0.1ml、0.2ml、0.4ml、0.6ml、1.0ml,置25ml具塞试管中,分别补加三氯甲烷至10.0ml,精密加水5ml、再精密加0.05%溴甲酚绿缓冲液(取溴甲酚绿0.05g,用0.2mol/L氢氧化钠溶液6ml使溶解,加磷酸二氢钾1g,加水使溶解并稀释至100ml,即得)2ml,密塞,剧烈振摇,转移至分液漏斗中,放置30分钟。取三氯甲烷液,用干燥滤纸滤过,取续滤液,以相应的试剂为空白。 5.测定法: 照紫外-可见分光光度法 (附录Ⅴ A),在nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。依法测定吸光度,从标准曲线上读出供试品溶液中含西贝母碱的重量,计算,即得。 6.结果与计算 6.1 标准曲线制备: 收集于网络,如有侵权请联系管理员删除
紫外可见分光光度法练习题
紫外-可见分光光度法 一、单项选择题 1.可见光的波长范围是 A、760~1000nm B、400~760nm C、200~400nm D、小于400nm E、大于760nm 2.下列关于光波的叙述,正确的是 A、只具有波动性 B、只具有粒子性 C、具有波粒二象性 D、其能量大小于波长成正比 E、传播速度与介质无关 3.两种是互补色关系的单色光,按一定的强度比例混合可成为 A、白光 B、红色光 C、黄色光 D、蓝色光 E、紫色光 4.测定Fe3+含量时,加入KSCN显色剂,生成的配合物是红色的,则此配合物吸收了白光中的 A、红光 B、绿光 C、紫光 D、蓝光 E、青光 5.紫外-可见分光光度计的波长范围是 A、200~1000nm B、400~760nm C、1000nm 以上 D、200~760nm E、200nm以下 6.紫外-可见分光光度法测定的灵敏度高,准确度好,一般其相对误差在 A、不超过±% B、1%~5% C、5%~20%
D 、5%~10% E 、%~1% 7.在分光光度分析中,透过光强度(I t )与入射光强度(I 0)之比,即I t / I 0称 为 A 、吸光度 B 、透光率 C 、吸光系数 D 、光密度 E 、 消光度 8.当入射光的强度(I 0)一定时,溶液吸收光的强度(I a )越小,则溶液透过光的 强度(I t ) A 、越大 B 、越小 C 、保持不变 D 、等于0 E 、以 上都不正确 9.朗伯-比尔定律,即光的吸收定律,表述了光的吸光度与 A 、溶液浓度的关系 B 、溶液液层厚度的关系 C 、波长的关系 D 、溶液的浓度与液层厚度的关系 E 、溶液温度的关系 10.符合光的吸收定律的物质,与吸光系数无关的因素是 A 、入射光的波长 B 、吸光物质的性质 C 、溶 液的温度 D 、溶剂的性质 E 、在稀溶液条件下,溶液的浓度 11.在吸收光谱曲线上,如果其他条件都不变,只改变溶液的浓度,则最大吸收波长的位置和峰的 高度将 A 、峰位向长波方向移动,逢高增加 B 、峰位向短波方向移 动,峰高增加
紫外分光光度法计算
第20章吸光光度法 1?什么叫单色光?复色光?哪一种光适用于朗伯一比耳定律? 答:仅具有单一波长的光叫单色光。由不同波长的光所组成光称为复合光。朗伯--比耳定律应 适用于单色光。 2?什么叫互补色?与物质的颜色有何关系? 答:如果两种适当的单色光按一定的强度比例混合后形成白光,这两种光称为互补色光。当 混合光照射物质分子时,分子选择性地吸收一定波长的光,而其它波长的光则透过,物质呈现透过光的颜色,透过光与吸收光就是互补色光。 3?何谓透光率和吸光度?两者有何关系? 答:透光率是指透射光强和入射光强之比,用T表示T=X 10 吸光度是吸光物质对入射光的吸收程度,用A表示,A b e,其两者的关系 A lgT 4.朗伯-比耳定律的物理意义是什么?什么叫吸收曲线?什么叫标准曲线? 答:朗伯--比耳定律是吸光光度法定量分析的理论依据,即吸光物质溶液对光的吸收程度与溶液浓度和液层厚度之间的定量关系。数学表达式为 A lgT be 吸收曲线是描述某一吸光物质对不同波长光的吸收能力的曲线,即在不同波长处测得吸 光度,波长为横坐标,吸光度为纵坐标作图即可得到吸收曲线。 标准曲线是描述在一定波长下,某一吸光物质不同浓度的溶液的吸光能力的曲线,吸光度 为纵坐标,浓度为横坐标作图即可得到。 5?何谓摩尔吸光系数?质量吸光系数?两者有何关系? 答:吸光系数是吸光物质吸光能力的量度。摩尔吸光系数是指浓度为1.0 mol L,液层度为1em 时,吸光物质的溶液在某一波长下的吸光度。用&表示,其单位L mol 1 cm 1。 质量吸光系数是吸光物质的浓度为1g L 1时的吸光度,用a表示。其单位L g 1 cm 1 两者的关系为 e M a M为被测物的摩尔质量。 6. 分光光度法的误差来源有哪些? 答:误差来源主要有两方面,一是所用仪器提供的单色光不纯,因为单色光不纯时,朗伯一比耳定律中吸光度和浓度之间的关系偏离线性;二是吸光物质本身的化学反应,其结果同样
紫外可见分光光度法习题答案
第十一章紫外-可见分光光度法 思考题和习题 1.名词解释:吸光度、透光率、吸光系数(摩尔吸光系数、百分吸光系数)、发色团、助色团、红移、蓝移。 2.什么叫选择吸收?它与物质的分子结构有什么关系? 物质对不同波长的光吸收程度不同,往往对某一波长(或波段)的光表现出强烈的吸收。这时称该物质对此波长(或波段)的光有选择性的吸收。 由于各种物质分子结构不同,从而对不同能量的光子有选择性吸收,吸收光子后产生的吸收光谱不同,利用物质的光谱可作为物质分析的依据。 3.电子跃迁有哪几种类型?跃迁所需的能量大小顺序如何?具有什么样结构的化合物产生紫外吸收光谱?紫外吸收光谱有何特征? 电子跃迁类型有以下几种类型:σ→σ*跃迁,跃迁所需能量最大;n →σ*跃迁,跃迁所需能量较大,π→π*跃迁,跃迁所需能量较小;n→ π*跃迁,所需能量最低。而电荷转移跃迁吸收峰可延伸至可见光区内,配位场跃迁的吸收峰也多在可见光区内。 分子结构中能产生电子能级跃迁的化合物可以产生紫外吸收光谱。 紫外吸收光谱又称紫外吸收曲线,是以波长或波数为横坐标,以吸光度为纵坐标所描绘的图线。在吸收光谱上,一般都有一些特征值,如最大吸收波长(吸收峰),最小吸收波长(吸收谷)、肩峰、末端吸收等。 4.Lambert-Beer定律的物理意义是什么?为什么说Beer定律只适用于单色光?浓度C 与吸光度A线性关系发生偏离的主要因素有哪些? 朗伯-比耳定律的物理意义:当一束平行单色光垂直通过某溶液时,溶液的吸光度A 与吸光物质的浓度c及液层厚度l成正比。 Beer定律的一个重要前提是单色光。也就是说物质对单色光吸收强弱与吸收光物质的浓度和厚度有一定的关系。非单色光其吸收强弱与物质的浓度关系不确定,不能提供准确的定性定量信息。 浓度C与吸光度A线性关系发生偏离的主要因素 (1)定律本身的局限性:定律适用于浓度小于0.01 mol/L的稀溶液,减免:将测定液稀释至小于0.01 mol/L测定 (2)化学因素:溶液中发生电离、酸碱反应、配位及缔合反应而改变吸光物质的浓度等导致偏离Beer定律。减免:选择合适的测定条件和测定波长 (3)光学因素: 非单色光的影响。减免:选用较纯的单色光;选max的光作为入射光 杂散光的影响。减免:选择远离末端吸收的波长测定 散射光和反射光:减免:空白溶液对比校正。 非平行光的影响:减免:双波长法 (4)透光率测量误差:减免:当±0.002<ΔT< ±0.01时,使0.2 【含量测定】照紫外-可见分光光度法(附录V A)测定。 1.仪器与测定条件:室温:____℃相对湿度:____% 分析天平编号:;水浴锅编号:; 紫外可见分光光度计编号:; 2.对照品溶液的制备: 取西贝母碱对照品适量,精密称定,加三氯甲烷制成每1ml含_______mg的溶液,即得。 3. 供试品溶液的制备: 取本品粉末(过三号筛)约______g,精密称定,置具塞锥形瓶中,加浓氨试液3ml,浸润1小时。加三氯甲烷-甲醇(4:1)混合溶液40ml,置80℃水浴加热回流2小时,放冷,滤过,滤液置50ml量瓶中,用适量三氯甲烷-甲醇(4:1)混合溶液洗涤药渣2~3次,洗液并入同一量瓶中,加三氯甲烷-甲醇(4:1)混合溶液至刻度,摇匀,即得。 4.标准曲线的制备: 精密量取对照品溶液0.1ml、0.2ml、0.4ml、0.6ml、1.0ml,置25ml具塞试管中,分别补加三氯甲烷至10.0ml,精密加水5ml、再精密加0.05%溴甲酚绿缓冲液(取溴甲酚绿0.05g,用0.2mol/L氢氧化钠溶液6ml使溶解,加磷酸二氢钾1g,加水使溶解并稀释至100ml,即得)2ml,密塞,剧烈振摇,转移至分液漏斗中,放置30分钟。取三氯甲烷液,用干燥滤纸滤过,取续滤液,以相应的试剂为空白。 5.测定法: 照紫外-可见分光光度法(附录ⅤA),在nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。依法测定吸光度,从标准曲线上读出供试品溶液中含西贝母碱的重量,计算,即得。 6.结果与计算 6.1 标准曲线制备: 对照品批号 纯 度 S 对照品来源 干燥条件 对照品称重W 对(mg) 各浓度点稀释倍数f 对 溶液浓度C 对(ug/ml) 吸光度A 对 线性回归方程 A=( )C +/-( ) r =( ) 计算公式: W S C f ?= 对对对 C 对= 6.2 样品测定: 水分Q 取样量W 样(g ) 样品稀释倍数f 样 样品吸光度A 样 样品平均吸光度A 样 浓度C(ug/ml) 含量X (%) 平均含量X (%) 计算公式:() %100Q 110W f C X 6 ?-???= 样样 样 X 1= X 2= 7.本品按干燥品计算,含总生物碱以西贝母碱(C 27H 43NO 3)计,不得少于0.050%。 结果: 规定 检验人: 检验日期: 复核人: 复核日期: 实验一紫外分光光度法测定苯甲酸 一、实验目的 学习、了解紫外分光光度法原理 了解紫外分光光度计的结构和使用方法 二、实验原理 当辐射能(光)通过吸光物质时,物质的分子对辐射能选择性的吸收而得到的光谱称为分子吸收光谱。分子吸收光谱的产生与物质的分子结构、物质所在状态、溶剂和溶液的PH等因素有关。分子吸收光谱的强度与吸光物质的浓度有关。表示物质对光的吸收程度,通常采用“吸光度”这一概念来量度。 根据朗伯-比尔定律,在一定的条件下,吸光物质的吸光度A 与该物质的浓度C和液层厚度成正比。即A= LC 因此,只要选择一定的波长测定溶液的吸光度,即可求出该溶液浓度,这就是紫外-可见分光光度计的基本原理。 在碱性条件下,苯甲酸形成苯甲酸盐,对紫外光有选择性吸收,其吸收光谱的最大吸收波长为225nm。因此,采用紫外分光光度计测定苯甲酸在225nm处的吸收度就能进行定量分析。 三、仪器与主要试剂 TU-1810紫外可见分光光度计1cm石英比色皿 0.1M氢氧化钠溶液 苯甲酸(AR) 四、实验步骤 1、苯甲酸标准溶液的制备 称取苯甲酸(105℃烘干)100mg,用0.1M氢氧化钠溶液100ml溶解后,转入1000ml容量瓶中,用蒸馏水稀释至刻度.此溶液1ml含0.1mg 苯甲酸. 2、制作苯甲酸吸收曲线,选择最大吸收波长 ①移取苯甲酸标准溶液4.00ml于50ml容量瓶中,用0.01M氢氧化钠溶液定容,摇匀,此溶液1ml含苯甲酸8ug. 以氘灯为光源,用0.01M氢氧化钠溶液作为参比,改变测量波长(从210-240nm)测量8ug/ml苯甲酸的吸光度. ②以波长为横坐标,吸光度为纵坐标,绘制苯甲酸的紫外吸收曲线,并找出最大的吸收波长 (是否是225nm). 3﹑样品的测定 ①取10.00ml苯甲酸样品,放入50ml容量瓶中,用0.01M氢氧化钠 紫外分光光度法测定蛋白质含量 一、实验目的 1.学习紫外光度法测定蛋白质含量的原理; 2.掌握紫外分光光度法测蛋白质含量的实验技术。 二、实验原理 1.测蛋白质含量的方法主要有:①测参数法:折射率、相对密度、紫外吸收等;②基于化学反应:定氮法、双缩脲法、Folin―酚试剂法等。本实验采用紫外分光光度法。 2.蛋白质中的酪氨酸和色氨酸残基的苯环中含有共轭双键,因此,蛋白质具有吸收紫外光的性质,其最大吸收峰位于280nm附近(不同蛋白质略有不同)。在最大吸收波长处,吸光度与蛋白质溶液的浓度服从朗伯―比尔定律。 利用紫外吸收法测蛋白质含量的准确度较差,原因有二:①对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定误差,故该法适于测定与标准蛋白质氨基酸组成相似的蛋白质;②样品中含有的嘌呤、嘧啶等吸收紫外光的物质,会出现较大干扰。 三、仪器与试剂 TU―1901紫外可见分光光度计、标准蛋白质溶液3.00mg·mL-1、0.9%NaCl 溶液、试样蛋白质溶液。 10mL比色管、1cm石英比色皿、吸量管。 四、实验步骤 1.绘制吸收曲线 用吸量管吸取2mL3.00mg·mL-1标准蛋白质溶液于10mL比色管中,用0.9%NaCl溶液稀释至刻度,摇匀。用1cm石英比色皿,以0.9%NaCl溶液作参比溶液,在190~400nm间每隔5nm测一次吸光度Abs,记录数据并作图。 2.绘制标准曲线 用吸量管分别吸取1.0、1.5、2.0、2.5、3.0mL3.00mg·mL-1标准蛋白质溶液于10mL比色管中,用0.9%NaCl溶液稀释至刻度,摇匀。用1cm石英比色皿,以0.9%NaCl溶液作参比溶液,在波长280nm处分别测其吸光度,记录数据并作图。 3.样品测定 取适量浓度试样蛋白质溶液,在波长280nm处测其吸光度,重复三次。在已经得到标准曲线的情况下,为了使测量结果准确度高,待测溶液的浓度需在标准曲线的线性范围内,所以,先测定试样蛋白质原液的吸光度(1.363),估算浓度为2.0960 mg·mL-1,再将原试液稀释至5倍(即取2mL试液,用0.9%NaCl 溶液稀释至刻度,摇匀),估算浓度为0.4192 mg·mL-1,测吸光度,重复三次五、数据处理与结果分析 紫外分光光度法原理,使用范围,仪器的校正,测定方法和注意事项 紫外分光光度法 一、原理 可见光、紫外线照射某些物质,主要是由于物质分子中价电子能级跃迁对辐射的吸收,而产生化合物的可见紫外吸收光谱。基于物质对光的选择性吸收的特性而建立分光光度法或称吸收光谱法的分析方法。它是以朗伯──比耳定律为基础。 1 朗伯—比耳定律 A = lg—- = ECL T 式中 A为吸收度; T为透光率; E为吸收系数,采用的表示方法是(E1%1cm),其物理意义为当溶液浓度为1%(g/ml),液层厚度为1cm时的吸收度数值; C为100ml溶液中所含被测物质的重量(按干燥品或无水物计算),g; L为液层厚度,cm。 二、使用范围 凡具有芳香环或共轭双键结构的有机化合物,根据在特定吸收波长处所测得的吸收度,可用于药品的鉴别、纯度检查及含量测定。 三、仪器 可见-紫外分光光度计。其应用波长范围为200~400nm的紫外光区、400~850nm的可见光区。主要由辐射源(光源)、色散系统、检测系统、吸收池、数据处理机、自动记录器及显示器等部件组成。 本仪器是根据相对测量的原理工作的,即先选定某一溶剂(或空气、试样)作为标准(空白或称参比)溶液,并认为它的透光率为100%(或吸收度为0),而被测的试样透光率(或吸收度)是相对于标准溶液而言,实际上就是由出射狭缝射出的单色光,分别通过被测试样和标准溶液,这两个光能量之比值,就是在一定波长下对于被测试样的透光率(或吸收度)。 本仪器可精密测定具有芳香环或共轭双键结构的有机化合物、有色物质或在适当条件下能与某些试剂作用生成有色物的物质。 使用前应校正测定波长并按仪器说明书进行操作。 四、仪器的校正 1.波长的准确度试验 以仪器显示的波长数值与单色光的实际波长值之间误差表示,应在±1.0nm 范围内。 可用仪器中氘灯的486.02nm与656.10nm谱线进行校正。 2.吸收度的准确度试验 紫外-可见分光光度法 紫外-可见分光光度法是在190~800nm波长范围内测定物质的吸收度,用于鉴别、杂质检查和定量测定的方法。当光穿过被测物质溶液时,物质对光的吸收程度随光的波长不同而变化。因此,通过测定物质在不同波长处的吸光度,并绘制其吸光度与波长的关系图即得被测物质的吸收光谱。从吸收光谱中,可以确定最大吸收波长λmax和最小吸收波长λmim。物质的吸收光谱具有与其结构相关的特征性。因此,可以通过特定波长范围内样品的光谱与对照光谱或对照品光谱的比较,或通过确定最大吸收波长,或通过测量两个特定波长处的吸收比值而鉴别物质。用于定量时,在最大吸收波长处测量一定浓度样品溶液的吸光度,并与一定浓度的对照溶液的吸光度进行比较或采用吸收系数法求算出样品溶液的浓度。 仪器的校正和检定 1.波长由于环境因素对机械部分的影响,仪器的波长经常会略有变动,因此除应定期对所用的仪器进行全面校正检定外,还应于测定前校正测定波长。常用汞灯中的较强谱线237.83nm、253.65nm、275.28nm、296.73nm、313.16nm、334.15nm、365.02nm、404.66nm、435.83nm、546.07nm与576.96nm,或用仪器中氘灯的486.02nm与656.10nm谱线进行校正,钬玻璃在波长279.4nm、287.5nm、333.7nm、360.9nm、418.5nm、460.0nm、484.5nm、536.2nm与637.5nm处有尖锐吸收峰,也可作波长校正用,但因来源不同或随着时间的推移会有微小的变化,使用时应注意;近年来,尝试由高氯酸狄溶液校正双光束仪器,以10%高氯酸溶液为溶剂,配置含氧化狄(Ho2O3)4%的溶液,该溶液的吸收峰波长为241.13nm,278.10nm,287.18nm,333.44nm,345.47nm,361.31nm,416.28nm,451.30nm, 485.29nm,536.64nm和640.52nm。 仪器波长的允许误差为:紫外光区±1nm,500nm附近±2nm 2.吸光度的准确度可用重铬酸钾的硫酸溶液检定。取在120℃干燥至恒重的基准重铬酸钾约60mg,精密称定,用0.005mol/L硫酸溶液溶解并稀释至1000ml,在规定的波长处测定并计算其吸收系数,并与规定的吸收系数比较, 紫外分光光度计的使用原理和方法 紫外-可见分光光度法(ultraviolet-visible spectrophotometry, UV-VIS) 1定义: 它是利用物质的分子或离子对某一波长范围的光的吸收作用,对物质进行定性分析、定量分析及结构分析, 所依据的光谱是分子或离子吸收入射光中特定波长的光而产生的吸收光谱。 2分类: 按所吸收光的波长区域不同:分为紫外分光光度法和可见分光光度法,合称为紫外-可见分光光度法。 3、紫外-可见分光光度法的特点: (1) 其仪器设备和操作都比较简单,费用少,分析速度快;(与其它光谱分析方法相比)(2)灵敏度高; (3)选择性好; (4)精密度和准确度较高; (5)用途广泛。 §1. 紫外-可见吸收光谱 1. 物质对光的选择性吸收 物质对光的吸收是选择性的,利用被测物质对某波长的光的吸收来了解物质的特性,这就是光谱法的基础。通过测定被测物质对不同波长的光的吸收强度(吸光度),以波长为横坐标,吸光度为纵坐标作图,得出该物质在测定波长范围的吸收曲线。在吸收曲线中,通常选用最大吸收波长λmax进行物质含量的测定。 2.有机化合物的紫外-可见吸收光谱 2.1 有机化合物的电子跃迁 与紫外-可见吸收光谱有关的电子有三种,即形成单键的σ电子、形成双键的π电子以及未参与成键的n电子。跃迁类型有:σ→σ*、n→σ* 、π→π*、n→π* 四种。 饱合有机化合物的电子跃迁类型为σ→σ*,n→σ*跃迁, 吸收峰一般出现在真空紫外区,吸收峰低于200nm,实际应用价值不大。 不饱合机化合物的电子跃迁类型为n→π*,π→π*跃迁,吸收峰一般大于200nm。 生色团:是指分子中可以吸收光子而产生电子跃迁的原子基团。人们通常将能吸收紫外、可见光的原子团或结构系统定义为生色团。 助色团:是指带有非键电子对的基团,如-OH、-OR、-NHR、-SH、-Cl、-Br、-I等,它们本身不能吸收大于200nm的光,但是当它们与生色团相连时,会使生色团的吸收峰向长波方向移动, 第二章 紫外-可见分光光度法 一、选择题 1 物质的紫外 – 可见吸收光谱的产生是由于 (B ) A. 原子核内层电子的跃迁 B. 原子核外层电子的跃迁 C. 分子的振动 D. 分子的转动 2 紫外–可见吸收光谱主要决定于 (C ) A.原子核外层电子能级间的跃迁 B. 分子的振动、转动能级的跃迁 C. 分子的电子结构 D. 原子的电子结构 3 分子运动包括有电子相对原子核的运动(E 电子)、核间相对位移的振动(E 振动)和转 动(E 转动)这三种运动的能量大小顺序为 (A ) A. E 电子>E 振动>E 转动 B. E 电子>E 转动>E 振动 C. E 转动>E 电子>E 振动 D. E 振动>E 转动>E 电子 4 符合朗伯-比尔定律的一有色溶液,当有色物质的浓度增加时,最大吸收波长和吸光度分别是 (C ) A. 增加、不变 B. 减少、不变 C. 不变、增加 D. 不变、减少 5 吸光度与透射比的关系是 (B ) A. T A 1= B. T A 1lg = C. A = lg T D. A T 1lg = 6 一有色溶液符合比尔定律,当浓度为c 时,透射比为T 0,若浓度增大一倍时,透光率的对数为 (D ) A. 2T O B. 021T C. 0lg 2 1T D. 2lg T 0 7 相同质量的Fe 3+和Cd 2+ 各用一种显色剂在相同体积溶液中显色,用分光光度法测定,前者用2cm 比色皿,后者用1cm 比色皿,测得的吸光度值相同,则两者配合物的摩尔吸光系数为 (C ) 已知:A r(Fe) = ,A r(Cd) = A. Cd Fe 2εε≈ B. e d F C 2εε≈ 第十一章紫外--可见分光光度法 思考题和习题 1.名词解释:吸光度、透光率、吸光系数(摩尔吸光系数、百分吸光系数)、发色团、助色团、红移、蓝移。 2.什么叫选择吸收?它与物质的分子结构有什么关系? 物质对不同波长的光吸收程度不同,往往对某一波长(或波段)的光表现出强烈的吸收。这时称该物质对此波长(或波段)的光有选择性的吸收。 由于各种物质分子结构不同,从而对不同能量的光子有选择性吸收,吸收光子后产生的吸收光谱不同,利用物质的光谱可作为物质分析的依据。 3.电子跃迁有哪几种类型?跃迁所需的能量大小顺序如何?具有什么样结构的化合物产生紫外吸收光谱?紫外吸收光谱有何特征? 电子跃迁类型有以下几种类型:σ→σ*跃迁,跃迁所需能量最大;n →σ*跃迁,跃迁所需能量较大,π→π*跃迁,跃迁所需能量较小;n→ π*跃迁,所需能量最低。而电荷转移跃迁吸收峰可延伸至可见光区内,配位场跃迁的吸收峰也多在可见光区内。 分子结构中能产生电子能级跃迁的化合物可以产生紫外吸收光谱。 紫外吸收光谱又称紫外吸收曲线,是以波长或波数为横坐标,以吸光度为纵坐标所描绘的图线。在吸收光谱上,一般都有一些特征值,如最大吸收波长(吸收峰),最小吸收波长(吸收谷)、肩峰、末端吸收等。 4.Lambert-Beer定律的物理意义是什么?为什么说Beer定律只适用于单色光?浓度C 与吸光度A线性关系发生偏离的主要因素有哪些? 朗伯-比耳定律的物理意义:当一束平行单色光垂直通过某溶液时,溶液的吸光度A 与吸光物质的浓度c及液层厚度l成正比。 Beer定律的一个重要前提是单色光。也就是说物质对单色光吸收强弱与吸收光物质的浓度和厚度有一定的关系。非单色光其吸收强弱与物质的浓度关系不确定,不能提供准确的定性定量信息。 浓度C与吸光度A线性关系发生偏离的主要因素 (1)定律本身的局限性:定律适用于浓度小于0.01 mol/L的稀溶液,减免:将测定液稀释至小于0.01 mol/L测定 (2)化学因素:溶液中发生电离、酸碱反应、配位及缔合反应而改变吸光物质的浓度等导致偏离Beer定律。减免:选择合适的测定条件和测定波长 (3)光学因素: 非单色光的影响。减免:选用较纯的单色光;选 max的光作为入射光 杂散光的影响。减免:选择远离末端吸收的波长测定 散射光和反射光:减免:空白溶液对比校正。 非平行光的影响:减免:双波长法 (4)透光率测量误差:减免:当±0.002<ΔT< ±0.01时,使0.2 紫外分光光度法测定未知样含量 (含方案、公式、标准误吸收光谱图) 1.仪器 1.1紫外可见分光光度计(T6型); 1.2石英吸收池(1cm):2只; 1.3比色管(50mL)10支; 1.4吸量管5mL:2支。 2.试剂 2.1苯甲酸标准溶液(0.1mg/mL); 2.2未知液:浓度约为40~60ug/mL。 3.实验操作 3.1吸收曲线的绘制 3.1.1标准苯甲酸吸收曲线绘制 在一支50mL比色管中由2.1配制成浓度为0~10ug/mL范围内的溶液,以水定容,并摇匀。于波长200~350nm范围内每间隔10nm测定一次吸光度,在最大吸收波长附近间隔5 nm测定一次测定吸光度,再次根据最大吸收波长,附近间隔1 nm测定一次吸光度,绘制吸收曲线,从曲线上确定苯甲酸的最大吸收波长(作为定量测定波长)。 附图:苯甲酸的吸收曲线。 3.1.2标准水杨酸吸收曲线绘制 在一支50mL比色管中由2.1配制成浓度为0~10ug/mL范围内的溶液,以水定容,并摇匀。于波长200~350nm范围内每间隔10nm测定一次吸光度,在最大吸收波长附近间隔5 nm测定一次吸光度,再次根据最大吸收波长附近,间隔1 nm测定一次吸光度,绘制吸收曲线,从曲线上确定水杨酸的最大吸收波长(作为定量测定波长)。 附图:水杨酸吸收曲线。 3.1.3未知液吸收曲线的绘制 准确吸取含苯甲酸的未知液若干体积(5mL)于一支50mL比色管中,以水定容并摇匀。以蒸馏水为参比,于波长200~350nm范围内每间隔10nm测定一次吸光度,在最大吸收波长附近间隔5 nm测定一次吸光度,再次根据最大吸收波长,附近间隔1 nm测定一次吸光度,绘制吸收曲线。(观察3.1.1和3.1.2各自所得吸收曲线有什么相同之处?这说明了什么问题?对于一个未知样品如何利用分光光度法进行定性?)附图:未知液的吸收曲线。 3.2吸收池配套性检查 石英吸收池装蒸馏水,于定量测定波长处,以一个吸收池为参比,测定并记录另一吸收池的吸光度(其偏差应小于0.5%,可配成一套使用,否则更换)作为校正值。 3.3校准曲线的绘制及未知样含量的测定 准确移取与未知样相同的物质的标准溶液若干体积于50mL比色管中,以水定容,制成一系列相同体积不同浓度的标准溶液(0~10ug/mL),在最大吸收波长处,以水为参比,测定各自吸光度。由实验数据计算回归方程及相关系数,以浓度(ρ/ ug·mL-1)为横坐标,以相应的吸光度为纵坐标绘制校准曲线。 在相同条件下,测定样品稀释液(配制方法同3.1.2)的吸光度,代入回归方程计算出样品稀释液的浓度。试样平行测定三份。 4.结果计算 根据未知液的稀释倍数,求出未知溶液中水杨酸的含量。 紫外可见分光光度法基本原理 紫外可见分光光度法基本原理透射比和吸光度当一束平行光通过均匀的溶液介质时光的一部分被吸收一部分被器皿反射。设入射光强度为I0吸收光强度为Ia 透射光强度为It反射光强度为Ir则在进行吸收光谱分析中被测溶液和参比溶液是分别放在同样材料及厚度的两个吸收池中让强度同为I0的单色光分别通过两个吸收池用参比池调节仪器的零吸收点再测量被测量溶液的透射光强度所以反射光的影响可以从参比溶液中消除则上式可简写为透射光强度It与入射光强度I0之比称为透射比亦称透射率用T表示则有: 溶液的T越大表明它对光的吸收越弱反之T 越小表明它对光的吸收越强。为了更明确地表明溶液的吸光强弱与表达物理量的相应关系常用吸光度A表示物质对光的吸收程度其定义为: 则A值越大表明物质对光吸收越强。T及A都是表示物质对光吸收程度的一种量度透射比常以百分率表示称为百分透射比T吸光度A为一个无因次的量两者可通过上式互相换算。朗伯-比耳定律朗伯-比耳定律Lambert-Beer是光吸收的基本定律俗称光吸收定律是分光光度法定量分析的依据和基础。当入射光波长一定时溶液的吸光度A是吸光物质的浓度C及吸收介质厚度l吸收光程的函数。朗伯和比耳分别于1760年和1852年研究了这三者的定量关系。朗伯的结论是当用适当波长的单色光照射一固定浓度的均匀溶液时A与l成正比其数学式为: A kl 此即称为朗伯定律k为比例系数而比耳的结论是当用适当波长的单色光照射一固定液层厚度的均匀溶液时A与C成正比其数学表达式为: 此即称为比耳定律k称为比例系数合并上述k的数值取决于吸光物质的特性外其单位及数值还与C和l所采用的单位有关。l通常采用cm为单位并用b表示。所以k的单位取决C采用的单位。当C采用重量单位g/L时吸收定律表达为: a称为吸光系数单位为当C采用摩尔浓度mol/L时吸收定律表达为: ε称摩尔吸光系数单位为有时在化合物的组成不明的情况下物质的摩尔质量不知道 1.物质的颜色与吸收光的关系 电磁波谱: X射线 0.1~100 nm 远紫外光 10~200 nm 近紫外光 200~400 nm 可见光 400~760 nm 近红外光 750~2500 nm 中红外光 2500~5000 nm 远红外光 5000~10000 nm 微波 0.1~100 cm 无线电波 1~1000 m 2 日光:紫蓝青绿黄橙红 2014-11-33 ?复合光:由各种单色光组成的光。如白光(太阳光) ?单色光:只具有一种波长的光。 要求:?λ=±2nm 。 ?互补色光:如果把两种适当颜色的光按一定的强度比例混合也可以得到白光,这两种光就叫互补色光。 ?物质的颜色是由于物质对不同波长的光具有选择性的吸收作用而产生的。如:CuSO 4呈兰色。 ?物质呈现的颜色和吸收的光颜色之间是互补关系。 光的互补:蓝 黄日 光 7 ? (1)不同物质吸收曲线的形状和吸收波长不同。 MnO 4- 531吸收曲线2014-11-38?(2)同一物质对不同波长光的吸光度不同;同一物质不同浓度,其吸收曲线形状相似。 ?吸收曲线是特性的,可以提供物质的结构信息,作为物质定性分析的依据之一;吸收曲线是定量分析中选择入射光波长的 重要依据。 3.光的吸收定律——朗伯-比耳定律 λ 吸光度A:物质对光的吸收程度。 定义:A=lg(I0/I t) A越大,表示对光的吸收越大,透过光越弱。 9 λ 1760年朗伯(Lambert)阐明了光的吸收程度和吸收层厚度的关系:A∝b ?1852年比耳(Beer)又提出了光的吸收程度和吸收物浓度之间也具有类似的关系:A∝c 二者的结合称为朗伯—比耳定律,A∝bc 10 紫外-可见分光光度法 1简述 紫外-可见分光光度法是在190-80Onm波长范围内测定物质的吸光度,用于鉴别、杂质检查和含量测定的方法。 定量分析通常选择物质的最大吸收波长处测出吸光度,然后用对照品或吸收系数求算出被测物质的含量,多用于制剂的含量测定;对已知物质定性可用吸收峰波长或吸光度比值作为鉴别方法;若该物质本身在紫外光区无吸收,而其杂质在紫外光区有相当强度的吸收,或杂质的吸收峰处该物质无吸收,则可用本法作杂质检查。 物质对紫外辐射的吸收是由于分子中原子的外层电子跃迁所产生,因此,紫外吸收主要决定于分子的电子结构,故紫外光谱又称电子光谱。有机化合物分子结构中如含有共轭体系、芳香环等发色基团,均可在紫外区(200~400nm)或可见光区(400~850nm)产生吸收。通常使用的紫外-可见分光光度计的工作波长范围为 190~900nm。 紫外吸收光谱为物质对紫外区辐射的能量吸收图。朗伯-比尔(Lambert-Beer) 定律为光的吸收定律,它是紫外-可见分光光度法定量分析的依据,其数学表达式为: 1 A=log =ECL 式中A为吸光度; T为透光率; E为吸收系数; C为溶液浓度; L为光路长度。 如溶液的浓度(C)为1%(g/ml),光路长度(L)%lcm,相应的吸光度即为吸收系数以E;Cm表示。如溶液的浓度(C)为摩尔浓度(mol/L),光路长度为lcm 时,则相应有吸收系数为摩尔吸收系数,以表示。 2仪器 紫外-可见分光光度计主要由光源、单色器、样品室、检测器、记录仪、显示系 统和数据处理系统等部分组成。 为了满足紫外-可见光区全波长范围的测定,仪器备有二种光源,即氘灯和碘钨灯,前者用于紫外区,后者用于可见光区。 单色器通常由进光狭缝、出光狭缝、平行光装置、色散元件,聚焦透镜或反射镜等组成。色散元件有棱镜和光栅二种,棱镜多用天然石英或熔融硅石制成,对200~400nm波长光的色散能力很强,对600nm以上波长的光色散能力较差,棱镜色散所得的光谱为非匀排光谱。光栅系将反射或透射光经衍射而达到色散作用,故常称为衍射光栅,光栅光谱是按波长作线性排列,故为匀排光谱,双光束仪器多用光栅为色散元件。 检测器有光电管和光电倍增管二种。 紫外-可见分光光度计依据其结构和测量操作方式的不同可分为单光束和双光束分光光 度计二类。单光束分光光度计有些仍为手工操作,即固定在某一波长,分别测量比较空白、样品或参比的透光率或吸收度,操作比较费时,用于绘制吸收光谱图时很不方便,但适用于单波长的含量测定。双光束分光光度计藉扇形镜交替切换光路使分成样品(S)和参比(R)两光束,并先后到达检测器,检测器信号经调制分离成两光路对应信号,信号的比值可直接用记录仪记录,双光束分光光度计操作简单,测量快速,自动化程度高,但作含量测定时,为求准确起见,仍宜用固定波长测量方式。 3 紫外-可见分光光度计的检定 3.1 波长准确度 3.1.1 波长准确度的允差范围紫外-可见分光光度计波长准确度允许误差,紫外区为 ±1.0nm,500nm处吃.0nm,700nm处±4.8nm。 3.1.2 波长准确度检定方法 3.1.2.1 用低压汞灯检定关闭仪器光源,将汞灯(用笔式汞灯最方便)直接对准进光狭缝,如为双光束仪器,用单光束能量测定方式,采用波长扫描方式,扫描速度慢”(如 I5nm/min )、响应快”、最小狭缝宽度(如0.1 nm)、量程0~100%,在200~800nm范围内单方向重复扫描3次,由仪器识别记录各峰值(若仪器无峰检测” 功能,必要时可对指定波长进行“单峰”扫描)。 单光束仪器以751G型为例,可将选择开关放在X).1位置,透光率读数放在100 (或选择开关放在X,透光率放在10),关小狭缝,打开光闸门,缓缓转动波长盘,寻找汞灯546.07nm峰出现的位置,若与波长读数不符,应调节仪器左侧准直镜的波长调整螺丝,如 教材1 紫外分光光度法测定蛋白质含量 一、实验目的 学习紫外分光光度法测定蛋白质含量的原理; 掌握紫外分光光度法测定蛋白质含量的实验技术; 掌握TU-1901紫外-可见分光光度计的使用方法并了解此仪器的主要构造。 二、实验原理 紫外-可见吸收光谱法又称紫外-可见分光光度法,它是研究分子吸收190nm~750nm波长范围内的吸收光谱,是以溶液中物质分子对光的选择性吸收为基础而建立起来的一类分析方法。紫外-可见吸收光谱的产生是由于分子的外层价电子跃迁的结果,其吸收光谱为分子光谱,是带光谱。 进行定性:利用紫外-可见吸收光谱法进行定性分析一般采用光谱比较法。即将未知纯化合物的吸收光谱特征,如吸收峰的数目、位置、相对强度以及吸收峰的形状与已知纯化合物的吸收光谱进行比较。 定量分析:紫外-可见吸收光谱法进行定量分析的依据是朗伯-比尔定律:A=lgI0/I=εbc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比,即物质在一定波长处的吸光度与它的浓度成线形关系。因此,通过测定溶液对一定波长入射光的吸光度,就可求出溶液中物质浓度和含量。由于最大吸收波长λmax处的摩尔吸收系数最大,通常都是测量λmax的吸光度,以获得最大灵敏度。 光度分析时,分别将空白溶液和待测溶液装入厚度为b的两个吸收池中,让一束一定波长的平行单色光非别照射空白和待测溶液,以通过空白溶液的透光强度为I0,通过待测溶液的透光强度为I,根据上式,由仪器直接给出I0与I之比的对数值即吸光度。 紫外-可见分光光度计:紫外-可见吸收光谱法所采用的仪器称为分光光度计,它的主要部件有五个部分组成,即 I0I 光源单色器吸收池检测器信号显示器由光源发出的复合光经过单色器分光后即可获得任一所需波长的平行单色光,该单色光通过样品池静样品溶液吸收后,通过光照到光电管或光电倍增管等检测器上产生光电流,产生的光电流由信号显示器直接读出吸光度A。可见光区采用钨灯光源、玻璃吸收池;紫外光区采用氘灯光源、石英吸收池。 本实验采用紫外分光光度法测定蛋白质含量。蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,因此,蛋白质具有吸收紫外光的性质,其最大吸收峰位于280 nm 附近(不同的蛋白质吸收波长略有差别)。在最大吸收波长处,吸光度与蛋白质溶液的浓度的关系服从朗伯-比耳定律。该测定法具有简单灵敏快速高选择性,且稳定性紫外可见分光光度法含量测定
实验一-紫外分光光度法测定苯甲酸
紫外分光光度法测定蛋白质含量实验报告.docx
紫外分光光度法原理
紫外-可见分光光度法
紫外-分光光度法原理
紫外-可见分光光度法-答案
10紫外可见分光光度法课后习题答案
1.紫外分光光度法测定未知样含量-方案+公式+图
紫外可见分光光度法基本原理
分光光度法基本原理简介
(完整word版)紫外-可见分光光度法
紫外分光光度法测定蛋白质含量(精)
