1.气体的等温变化.ppt
合集下载
气体的等温变化课件

在化学反应动力学研究中,气体的等温变化原理被用于研 究化学反应速率与温度的关系,为化学反应机理和动力学 模型的研究提供重要依原理是研究热力学性质 和状态方程的重要基础,如范德华方程、维里方程等。
在日常生活中的应用
压力锅
温度调节
压力锅是利用气体的等温变化原理来 提高烹饪效率的厨房用具。通过加压 烹饪,可以缩短烹饪时间并保持食物 的营养和口感。
验结果的影响。
数据记录
准确记录实验数据,避 免遗漏或误差。
实验后处理
实验结束后,应关闭气 瓶阀门,清理实验装置
,确保实验室整洁。
04
等温变化的实验结果分析
实验数据记录与整理
数据记录
在实验过程中,需要详细记录气体的 温度、压力和体积等数据,确保数据 的准确性和完整性。
数据整理
将实验数据整理成表格或图表形式, 便于分析和比较不同条件下的实验结 果。
在日常生活中,温度调节设备如空调 、暖气等都利用了气体的等温变化原 理。通过调节温度和压力,实现室内 温度的调节和控制。
气球和飞艇
气球和飞艇利用气体的等温变化原理 来调节浮力和姿态。通过充气和放气 ,气球和飞艇可以实现升空、悬浮和 下降等动作。
感谢您的观看
THANKS
如化工、制药、食品加工 等领域,利用等温变化原 理进行气体分离、液化、 压缩等操作。
科学实验研究
在实验室中模拟等温变化 过程,研究气体性质和反 应机理。
02
理想气体定律
理想气体定律的表述
理想气体定律的表述
在等温、等压条件下,气体的体积与气体的物质的量成正比。
公式表示
V1/n1=V2/n2 或 p1V1=p2V2
理想气体定律的适用范围
适用范围
在日常生活中的应用
压力锅
温度调节
压力锅是利用气体的等温变化原理来 提高烹饪效率的厨房用具。通过加压 烹饪,可以缩短烹饪时间并保持食物 的营养和口感。
验结果的影响。
数据记录
准确记录实验数据,避 免遗漏或误差。
实验后处理
实验结束后,应关闭气 瓶阀门,清理实验装置
,确保实验室整洁。
04
等温变化的实验结果分析
实验数据记录与整理
数据记录
在实验过程中,需要详细记录气体的 温度、压力和体积等数据,确保数据 的准确性和完整性。
数据整理
将实验数据整理成表格或图表形式, 便于分析和比较不同条件下的实验结 果。
在日常生活中,温度调节设备如空调 、暖气等都利用了气体的等温变化原 理。通过调节温度和压力,实现室内 温度的调节和控制。
气球和飞艇
气球和飞艇利用气体的等温变化原理 来调节浮力和姿态。通过充气和放气 ,气球和飞艇可以实现升空、悬浮和 下降等动作。
感谢您的观看
THANKS
如化工、制药、食品加工 等领域,利用等温变化原 理进行气体分离、液化、 压缩等操作。
科学实验研究
在实验室中模拟等温变化 过程,研究气体性质和反 应机理。
02
理想气体定律
理想气体定律的表述
理想气体定律的表述
在等温、等压条件下,气体的体积与气体的物质的量成正比。
公式表示
V1/n1=V2/n2 或 p1V1=p2V2
理想气体定律的适用范围
适用范围
[物理课件]探究气体等温变化图像(共19张PPT)
![[物理课件]探究气体等温变化图像(共19张PPT)](https://img.taocdn.com/s3/m/9db3750dbb1aa8114431b90d6c85ec3a87c28b39.png)
结论
P
P-1/V图中等温线
为正比例函数
一定质量的气体 等温变化时,P与
1/V V成反比。
图像描述规律
P
P
V
1/V
一定质量的气体等温变化时,P 与V成反比。
问题讨论
为什么不能用手握住注射器外壁?
为什么改变气体体积过程要缓慢进行? 为什么活塞和注射器内壁要涂油? 万一实验过程中发生漏气现象要如何处
气体压强探头
TI画P-V图
一定质量的气体等温变化时,P与V成反比。 探究一定质量的气体等温变化规律 P-1/V图中等温线为正比例函数
正确连接 一定质量的气体等温变化时,P与V成反比。住注射器外壁。 探究气体等温变化规律 基于图形计算器的掌上实验室 为什么活塞和注射器内壁要涂油?
理?
小结
一、实验方法:控制变量法(m,T不变)
二、图像描述规律
P-V图中等温线为双曲线的一支。 P-1/V图中等温线为正比例函数 三、实验结论 一定质量的气体等温变化时,P与V 成反比。
作业
完成实验手册4-8页。
图像中如何画两条等温线?它 们之间的关系是什么?
采集数据 为什么不能用手握住注射器外壁?
探究气体等温变化规律 纵坐标 P , 横坐标 1/V 。 其余同学选取适当刻度在在实验手册第6页右半部分画P-1/V图 。
数据处理
P-1/V图
五组同学用TI 画P-1/V图
其余同学选取适当刻度在在实验 手册第6页右半部分画P-1/V图 。
纵坐标 P , 横坐标 1/V 。
探究气体等温变化规律
高一(4) 物理实验室
玻意耳实验
目的 探究一定质量的气体等 温变化规律
方法 控制变量法 m,T不变
《1 气体的等温变化》PPT课件(部级优课)
温变化过程中压强与体积的定量关系
1、实验中的研究对象是什么? 一定质量的气体
2、如何控制气体的质量m、温度T保持不变?
封闭、缓慢移动活塞、不触碰容器壁
3、如何改变压强P、体积V? 4、如何测量压强P、体积V?
求压强
Ps
m M
P0s (M+m)g
横截面积S Ps =P0s +(M+m)g
P=P0 +(M+m)g/S-F/S
(三)玻意耳定律
1、内容:
一定质量的气体,在温度不变的情况下,它的压强跟体 积成反比
2、表达式: PV C P1V1 P2V2
3、图像:
P
P
V
4、适用范围:温度不太低,压强不太大 1/V
5.等温变化图象
①等温线是双曲线的一支。 ②温度越高,其等温线离原点越远.
同一气体,不同温度下等温线是不同的
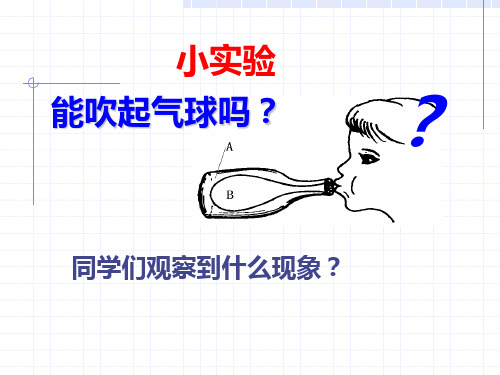
小实验
能吹起气球吗?
?
同学们观察到什么现象?
热学性质 T
复习: 气体状态的描述 (气体的三个状态参量)
几何性质
V
力学性质 P
(一) 气体的等温变化
m不变 T不变
(二)实验探究
猜想: P、V的关系
水中的气泡在上升的过程中,气泡 不断变大,说明压强减小,体积增大。
定量研究: 设计一个实验研究一定质量的气体在等
求压强刻度值是体积吗? 怎么算体积? 一定需要测截面积吗?
实 验次
实验数据的处理
数1 2 3 4 5
压强(×105Pa)
体积(L)
p/105 Pa
3
2
1
0
0.2
0.4
0.6
0.8
1/V
1、实验中的研究对象是什么? 一定质量的气体
2、如何控制气体的质量m、温度T保持不变?
封闭、缓慢移动活塞、不触碰容器壁
3、如何改变压强P、体积V? 4、如何测量压强P、体积V?
求压强
Ps
m M
P0s (M+m)g
横截面积S Ps =P0s +(M+m)g
P=P0 +(M+m)g/S-F/S
(三)玻意耳定律
1、内容:
一定质量的气体,在温度不变的情况下,它的压强跟体 积成反比
2、表达式: PV C P1V1 P2V2
3、图像:
P
P
V
4、适用范围:温度不太低,压强不太大 1/V
5.等温变化图象
①等温线是双曲线的一支。 ②温度越高,其等温线离原点越远.
同一气体,不同温度下等温线是不同的
小实验
能吹起气球吗?
?
同学们观察到什么现象?
热学性质 T
复习: 气体状态的描述 (气体的三个状态参量)
几何性质
V
力学性质 P
(一) 气体的等温变化
m不变 T不变
(二)实验探究
猜想: P、V的关系
水中的气泡在上升的过程中,气泡 不断变大,说明压强减小,体积增大。
定量研究: 设计一个实验研究一定质量的气体在等
求压强刻度值是体积吗? 怎么算体积? 一定需要测截面积吗?
实 验次
实验数据的处理
数1 2 3 4 5
压强(×105Pa)
体积(L)
p/105 Pa
3
2
1
0
0.2
0.4
0.6
0.8
1/V
《气体的等温变化》课件

《气体的等温变化》ppt课件
目录
• 气体的等温变化概述 • 理想气体模型 • 波义耳定律 • 等温变化的实验验证 • 等温变化的工程应用
01
气体的等温变化概述
等温变化的概念
等温变化
在等温过程中,气体的温度保持 不变,即气体与外界没有热量交
换。
等温变化的过程
气体在等温条件下经历的状态变化 。
等温变化的条件
理想气体模型的应用
在科学研究、工业生产和日常生活中,理想气体模型被广泛用于描述气体的性质和 行为。
在化学反应、燃烧过程、热力学等领域,理想气体模型为理论分析和实验研究提供 了基础。
通过理想气体模型,我们可以推导出许多重要的热力学公式和定律,如波义耳定律 、查理定律等。
03
波义耳定律
波义耳定律的表述
02
理想气体模型
理想气体模型的定义
01
理想气体模型是一种理论模型, 用于描述气体在一定条件下(如 温度和压力)的行为。
02
它忽略了气体分子间的相互作用 和分子自身的体积,只考虑气体 分子的平均动能。
可以忽略不计。
气体的温度保持恒定 ,即等温变化。
气体分子本身的体积 相比于容器容积可以 忽略不计。
在管道输送过程中,等温过程 可以减少气体温度的变化,保 证输送效率。
在气瓶压力控制过程中,等温 过程可以保证气瓶压力的稳定 性,提高气瓶的使用安全性。
THANKS
感谢观看
波义耳定律的应用实例
总结词
波义耳定律的应用实例
详细描述
波义耳定律在日常生活和工业生产中有着广泛的应用。例如,在气瓶压力不足时,可以通过减小体积来增大压力 ;在气瓶压力过高时,可以通过增大体积来减小压力。此外,波义耳定律还应用于气体压缩、气体输送、气体分 离等领域。
目录
• 气体的等温变化概述 • 理想气体模型 • 波义耳定律 • 等温变化的实验验证 • 等温变化的工程应用
01
气体的等温变化概述
等温变化的概念
等温变化
在等温过程中,气体的温度保持 不变,即气体与外界没有热量交
换。
等温变化的过程
气体在等温条件下经历的状态变化 。
等温变化的条件
理想气体模型的应用
在科学研究、工业生产和日常生活中,理想气体模型被广泛用于描述气体的性质和 行为。
在化学反应、燃烧过程、热力学等领域,理想气体模型为理论分析和实验研究提供 了基础。
通过理想气体模型,我们可以推导出许多重要的热力学公式和定律,如波义耳定律 、查理定律等。
03
波义耳定律
波义耳定律的表述
02
理想气体模型
理想气体模型的定义
01
理想气体模型是一种理论模型, 用于描述气体在一定条件下(如 温度和压力)的行为。
02
它忽略了气体分子间的相互作用 和分子自身的体积,只考虑气体 分子的平均动能。
可以忽略不计。
气体的温度保持恒定 ,即等温变化。
气体分子本身的体积 相比于容器容积可以 忽略不计。
在管道输送过程中,等温过程 可以减少气体温度的变化,保 证输送效率。
在气瓶压力控制过程中,等温 过程可以保证气瓶压力的稳定 性,提高气瓶的使用安全性。
THANKS
感谢观看
波义耳定律的应用实例
总结词
波义耳定律的应用实例
详细描述
波义耳定律在日常生活和工业生产中有着广泛的应用。例如,在气瓶压力不足时,可以通过减小体积来增大压力 ;在气瓶压力过高时,可以通过增大体积来减小压力。此外,波义耳定律还应用于气体压缩、气体输送、气体分 离等领域。
气体的等温变化PPT教学课件

四.平衡状态
平衡态: 在不受外界影响(即系统与外界没有物质和能
量的交换)的条件下,无论初始状态如何,系统的 宏观性质在经充分长时间后不再发生变化的状态。 准静态过程:如果状态变化过程进行得非常缓慢,以 至过程中的每一个中间状态都近似于平衡态,这样的 过程称为“准静态过程 ”,又称“平衡过程 ”。
§3 理想气体物态方程
例:若汽缸内气体为系统,其它为外界
二.系统状态的描述 微观量:分子的质量、速度、动量、能量等。
在宏观上不能直接进行测量和观察。 宏观量: 温度、压强、体积等。
在宏观上能够直接进行测量和观察。 宏观量与微观量的关系: 宏观量与微观量的内在联系表现在大量分子杂乱无章 的热运动遵从一定的统计规律性上。在实验中,所测 量到的宏观量只是大量分子热运动的统计平均值。
3.1 气体的实验规律 一.气体定律
P1V1 P2V2 恒量 (质量不变) T1 T2
二.阿伏伽德罗定律 在相同的温度和压强下,1摩尔的任何气体所占据的体积 都相同.在标准状态下,即压强P0=1atm、温度T0=273.15K 时, 1摩尔的任何气体的体积均为 v0=22.41L/mol
N A 6.022 1023 mol 1
D
p=p0-h
探究方法: 控制变量法
控制变量法:在实验中研究三个物理量的关 系时,先保持一个量不变,研究另外两个 量的关系;然后再保持另一个量不变,研 究剩余两个量的关系,最后把研究结果结 合起来,这种方法叫做控制变量法
基础知识:
等温变化: 气体在温度不变的状态下,
发生的变化叫做等温变化。
猜想
讨论回答:
气体等温变化的p-v图像
p
t2 t1
0
V
例题:
人教物理教材《气体的等温变化》PPT幻灯片

)
(6)一定质量的某种气体,在温度保持不变的情况下,压强p与体积V
成正比。(
)
(7)玻意耳定律适用于质量不变,温度变化的任何气体。(
)
答案(1)√ (2)√ (3)√ (4)× (5)× (6)× (7)×
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
必备知识
自我检测
2.(多选)下列图中,p表示压强,V表示体积,T为热力学温度,各图中正
确描述一定质量的气体是等温变化的是(
)
解析一定质量的气体在温度不变的情况下,压强与体积成反比,B、
C正确,D错误;温度不变,A正确。
探究一
探究二
随堂检测
4.实验步骤
(1)安装实验器材。
(2)将注射器活塞推到刻度2处。
(3)记下此时的压强值和对应的体积值(刻度值),填入表格。
(4)缓慢推拉活塞,使刻度值分别为1.5、1、…(或2.5、3、…),重复
上一步骤,记下对应的压强和体积。
5.实验结论
一定质量的某种气体,在温度不变的条件下,压强与体积的倒数成
注射器下端用橡胶套密封,上端用活塞(柱塞)封闭一段空气柱,这段空气柱是我们的研究对象。
根据题意确定所研究的气体,质量不变,温度不变。
【名校课堂】获奖PPT-人教物理教材《气体的等温变化》PPT说课稿(最新版本)推荐
采用横截面积较大的针筒
(1)实验器材:如图所示,铁架台、
气体的压强和体积必须用国际单位
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
(6)一定质量的某种气体,在温度保持不变的情况下,压强p与体积V
成正比。(
)
(7)玻意耳定律适用于质量不变,温度变化的任何气体。(
)
答案(1)√ (2)√ (3)√ (4)× (5)× (6)× (7)×
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
必备知识
自我检测
2.(多选)下列图中,p表示压强,V表示体积,T为热力学温度,各图中正
确描述一定质量的气体是等温变化的是(
)
解析一定质量的气体在温度不变的情况下,压强与体积成反比,B、
C正确,D错误;温度不变,A正确。
探究一
探究二
随堂检测
4.实验步骤
(1)安装实验器材。
(2)将注射器活塞推到刻度2处。
(3)记下此时的压强值和对应的体积值(刻度值),填入表格。
(4)缓慢推拉活塞,使刻度值分别为1.5、1、…(或2.5、3、…),重复
上一步骤,记下对应的压强和体积。
5.实验结论
一定质量的某种气体,在温度不变的条件下,压强与体积的倒数成
注射器下端用橡胶套密封,上端用活塞(柱塞)封闭一段空气柱,这段空气柱是我们的研究对象。
根据题意确定所研究的气体,质量不变,温度不变。
【名校课堂】获奖PPT-人教物理教材《气体的等温变化》PPT说课稿(最新版本)推荐
采用横截面积较大的针筒
(1)实验器材:如图所示,铁架台、
气体的压强和体积必须用国际单位
【名校课堂】获奖PPT-人教物理教材 《气体 的等温 变化》P PT说课 稿(最 新版本 )推荐
气体的等温变化PPT课件3 人教课标版

(2)pV=C。其中常量C 与气体 的质量、温度有关。
玻意耳定律
等温线
(1)一定质量的某种气 P 体在等温变化过程中压 强p跟体积V的反比关系, 在p-V 直角坐标系中表 示出来的图线叫等温线。
O (2)一定质量的气体 V 等温线的p-V图是双曲 线的一支。 (3)等温线的物理意义:图线上的一点表 示气体的一个确定的状态。同一条等温线上 各状态的温度相同,p与V 的乘积相同。不同 温度下的等温线,离原点越远,温度越高。
3、压强(P) 单位面积上受到的 压力 , 液体和大气压强的产生原因――重力 mg gV p gh (1)液体压强
s s
说明:h是某点距液面的距离,压强与深度有关, 向各个方向都有压强
(2)容器内气体压强
1.产生原因――碰撞 大量的气体对器壁的频繁撞击,产生一个均匀的,持续 的压力(举例:雨伞),这个压力就产生了压强。 2.说明:压强与深度无关,在各处都相 等,向各个方向都有压强 3.单位:Pa 换 算 关 系 atm mmHg
第八章 气体
第一节 气体的等温变化
凹进的乒乓球用热水烫起来,原因? 乒乓球内的气体受热,温度升高,压 强增大。 打足气的自行车在烈日下曝晒,常常 会爆胎,原因? 车胎内的气体温度升高,压强增大。
一、 气体的状态参量: 压强P,体积V,温度T 1 、温度(T) 两种温标: 摄氏温标,热力学温标 单位分别是: ℃,K。 两种温标关系式 : T = t + 273.15K 就每一度来说,它们是否相同的? 相同 2 、体积(V)单位:L、ml、m3 、 cm3
0.3 压强 (×105Pa) 体积 (h0×S) 16
0.6
0.9
1.2
1.5
8
5.3
玻意耳定律
等温线
(1)一定质量的某种气 P 体在等温变化过程中压 强p跟体积V的反比关系, 在p-V 直角坐标系中表 示出来的图线叫等温线。
O (2)一定质量的气体 V 等温线的p-V图是双曲 线的一支。 (3)等温线的物理意义:图线上的一点表 示气体的一个确定的状态。同一条等温线上 各状态的温度相同,p与V 的乘积相同。不同 温度下的等温线,离原点越远,温度越高。
3、压强(P) 单位面积上受到的 压力 , 液体和大气压强的产生原因――重力 mg gV p gh (1)液体压强
s s
说明:h是某点距液面的距离,压强与深度有关, 向各个方向都有压强
(2)容器内气体压强
1.产生原因――碰撞 大量的气体对器壁的频繁撞击,产生一个均匀的,持续 的压力(举例:雨伞),这个压力就产生了压强。 2.说明:压强与深度无关,在各处都相 等,向各个方向都有压强 3.单位:Pa 换 算 关 系 atm mmHg
第八章 气体
第一节 气体的等温变化
凹进的乒乓球用热水烫起来,原因? 乒乓球内的气体受热,温度升高,压 强增大。 打足气的自行车在烈日下曝晒,常常 会爆胎,原因? 车胎内的气体温度升高,压强增大。
一、 气体的状态参量: 压强P,体积V,温度T 1 、温度(T) 两种温标: 摄氏温标,热力学温标 单位分别是: ℃,K。 两种温标关系式 : T = t + 273.15K 就每一度来说,它们是否相同的? 相同 2 、体积(V)单位:L、ml、m3 、 cm3
0.3 压强 (×105Pa) 体积 (h0×S) 16
0.6
0.9
1.2
1.5
8
5.3
《气体的等温变化》(课件)

液化气体制备
利用气体的等温过程,我 们可以制备出一些化学物 质,并将其转化为液态。
总结
在这份课件中,我们探究了等温过程的基本原理,讲解了内能变化的计算方 法。我们还看到了等温变化在工程领域中的一些应用。掌握这些知识将使你 更好地理解,评估和改进含气体的过程。
内能变化与等温过程
内能变化是一个关键的概念,它描述的是系统内部的能量转换。在等温过程中,内能变化与温度变化有 着密不可分的关系。我们将探究这种关系的原理,并讲解内能变化的计算方法。
气体的等温变化实验
气体的等温变化实验旨在验证一些等温过程的理论预测。通过一些简单的实 验设置,我们可以很容易地观察到气体的内部特性,从而更好地理解等温过 程的基本原理。
我们还将探究程中的应用
等温过程在发动机工作、压缩空气工程和液化气体制备等领域有着广泛的应用。
发动机工作
发动机中的气缸中就包含 了等温过程。这个过程是 引擎工作中至关重要的一 个因素。
压缩空气工程
在压缩空气工程中,等温 过程用于减少压缩工序中 产生的热量。
气体的等温变化
气体的等温变化是非常重要的一个概念。在这份课件中,我们将深入探讨等 温过程的基本原理,及其在工程领域中应用的几个例子。
等温过程简介
等温过程是指在恒温条件下进行的气体变化过程。它最显著的特征是系统内的温度始终不变。例如,汽 车发动机中的气体在燃烧过程中发生的膨胀就是一个等温过程。
等温过程的理论基础依托于理想气体模型。我们将通过推导等温过程的公式来更深入地理解这个基础模 型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 解=pp22V=1析2.0,1:×.5p×11=01p5013、P5×aPp.1a由30.可5于直PAa,接→V从B1过=p-程5 V为L图,等中V温2读=变出1化0,,L分,由别即玻为3意×p耳11=0定5×3律×5=可10p得52×Ppa11V、01=,p3 • 答案: 3×105 1.5×105 1×105
• 设潜入水下的深度为h,玻璃管的横截面积为S,气体的初末状态参量分 别为
初状态:p1=p0,V1=12S. 末状态:p2=p0+ρgh,V2=10S. 由玻意耳定律:p1V1=p2V2,得:p0+p0ρgh=1102SS. 解得h=2 m.
• 答案: 2 m
• 解析: 根据等温图线的物理意义可知A、B选项都对,气体的温度 越高时,等温图线的位置就越高,所以C错,D对.答案为A、B、D.
• 答案: ABD
• 【跟踪发散】 2-1:如图所示是某气体状态变化的p-V图象,则下列 说法中正确的是( )
• A.气体作的是等温变化 • B.从A至B气体的压强一直减小 • C.从A至B气体的体积一直增大 • D.气体的三个状态参量一直都在变
• (pA+ph0)S=(p0+ph+ph0)S.即pA=p0+ph. • 3.力平衡法:选与封闭气体接触的液柱(或活塞、汽缸)为研究对象进行
受力分析,由F合=0列式求气体压强.
•
如图所示,竖直放置的U形管,左端开口,右端封闭,管
内有a、b两段水银柱,将A、B两段空气柱封闭在管内.已知水银柱
a长10 cm,水银柱b两个液面间的高度差为5 cm,大气压强为75
T2>T1.
• 如图,粗细均匀的弯曲玻璃管A、B两端开口,管内有一段水银柱, 右管内气体柱长为39 cm,中管内水银面与管口A之间气体柱长为40 cm. 先将B端封闭,再将左管竖直插入水银槽中,设整个过程温度不变,稳 定后右管内水银面比中管内水银面高2 cm,求:
• (1)稳定后右管内的气体压强p;
• (2)左管气柱的长度l′.(大气压强p0=76 cmHg)
解析: (1)插入水银槽后右管内气体:由玻意耳定律得: p0l0S=pl0-Δ2hS, 得 p=78 cmHg. (2)插入水银槽后左管压强: p′=p+ρgΔh=80 cmHg, 左管内外水银面高度差 h1=p′ρ-g p0=4 cm, 中、左管内气体由玻意耳定律得 p0l=p′l′,代入数据解 得 l′=38 cm,
• 解析: 当洗衣缸水位升高时,封闭空气的压强增大.因温度不变, 由玻意耳定律可知体积一定减小,故选B.
• 答案: B
• 4.一定质量的理想气体经历一等温膨胀过程,这一过程可以用p- V时的图压,上强气的p体2曲=的线_压_来_强_表_p_1示_=_,P_a_如;__图当__所气__示体Pa.的;由体当此积气可V体3=知的1,体5 当L积时气V,体2=气的1体0体的L积时压V,1强=气p53体=L ________Pa.
内灵活选取等压面.由两侧压强相等列方程求解压强. • 例如图中,同一液面C、D处压强相等
• pA=p0+ph.
• 2.参考液片法:选取假想的液体薄片(自身重力不计)为研究对象,分析 液片两侧受力情况,建立平衡方程消去面积,得到液片两侧压强相等, 进而求得气体压强.
• 例如,图中粗细均匀的U形管中封闭了一定质量的气体A,在其最低处取 一液片B,由其两侧受力平衡可知
•1.气体的等温变化
• 一、玻意耳定律
• 1.气体状态参量
• 气体的三个状态参量为 温度 、 体积 、压强 .
• 2.实验探究
•
(1)实验装置:如图所示,实验的研究对象是 .
被封闭的
气体
• (2)实验数据收集
• 空气柱的压强p可以从
上读出,空气柱的长度L可以从注射器两
侧的
上读出,则空气柱的体积为长压度L力与表横截面积S的乘积,即V=
• 解析: 一定质量的气体的等温过程的p-V图象即等温曲线是双曲线, 显然图中所示AB图线不是等温线,AB过程不是等温变化,A选项不正 确.
• 从AB图线可知气体从A状态变为B状态的过程中,压强p在逐渐减小,体 积V在不断增大,则B、C选项正确.
• 又该过程不是等温过程,所以气体的三个状态参量一直都在变化,D选 项正确.
• 2温.度恒有量关的,定对义一:定p质1V量1=的p气2V体2=温恒度量越C高,,该该恒恒量量CC与越气大体.的种类、质量、
• 3.等温变化的图象
• (1)p-V图象:一定质量的气体发生等温变化时的p-V图象如图所示, 图象为双曲线的一支.
• ①图线反映了在等温情况下,一定质量的气体的压强与体积成反比的规 律.
• 1.p-V图象
• 一定质量的理想气体的p-V图象如图甲所示,图线为双曲线的一支, 且温度t1<t2.
甲
乙
2.p-V1 图象 一定质量的理想气体的p-V1 图象如图乙所示,图线为 过原点的倾斜直线,且温度t1<t2.
• 一、容器静止或匀速运动时封闭气体压强的求法 • 1.取等压面法:根据同种液体在同一水平液面处压强相等,在连通器
量,p与V成反比,p与
1 V
就成正比,在p-
1 V
图上的等温线应
是过原点的直线,直线的斜率即为p与V的乘积,斜率越
大,pV乘积越大,温度就越高,如图T2>T1.
•
下列图中,p表示压强,V表示体积,T为热力学温度,各图
中正确描述一定质量的气体不是等温变化的是( )
解析:
等温变化过程中,p∝
1 V
,所以A、B、C表示
• 答案: (1)向下 (2)42 cm
•
如图所示,为一定质量的气体在不同温度下的两条等温线,则下
列说法正确的是( )
• A.从等温线可以看出,一定质量的气体在发生等温变化时,其压强与 体积成反比
• B.一定质量的气体,在不同温度下的等温线是不同的
• C.由图可知T1>T2 • D.由图可知T1<T2
• 答案: A
• 3.(2010·广东卷)如图所示,某种自动洗衣机进水时,与洗衣缸相连的
细管中会封闭一定质量的空气,通过压力传感器感知管中的空气压力, 从而控制进水量.设温度不变,洗衣缸内水位升高,则细管中被封闭的 空气( )
• A.体积不变,压强变小 • C.体积不变,压强变大
B.体积变小,压强变大 D.体积变小,压强变小
• 取液柱b为研究对象进行受力分析如图乙所示,同理可得
• pBS+pbS=pAS • 所以pB=pA-pb=65 cmHg-5 cmHg=60 cmHg. • 答案: 65 cmHg 60 cmHg
• 二、对玻意耳定律的理解
• 1.成立条件:玻意耳定律p1V1=p2V2是实验定律. • 只有在气体质量一定、温度不变的条件下才成立.
• (1)应如何移动玻璃管? • (2)此刻管内空气柱长度为多少?(设此时大气压相当于75 cmHg 产生的
压强)
解析: (1)要增大压强可采取的办法是:向下移动玻 璃管时,内部气体体积V减小、压强p增大,h减小.所以应 向下移动玻璃管.
(2)设此刻管内空气柱长度l′,由p1V1=p2V2, 得(p0-h)lS=p0l′S, l′=p0-p0hl=75-755×45 cm=42 cm.
• 3.玻意耳定律
• (1)内容:一定 的气体,在温度保持不变时,它的压强和体积成反比;
或者说,压强和体积的质乘量积保持
.此即玻意耳定律.
• (2)数学表达式:pV=C(常量)或p1V1=p2V2. • (3)适用条件:
不变
• ①气体质量不变、温度不变;
• ②气体温度不太低、压强不太大.
• 二、气体等温变化的p-V图象
• 答案: BC
• 2.如图所示,D→A→B→C表示一定质量的某种气体状态变化的一个过 程,则下列说法正确的是( )
• A.D→A是一个等温过程 • B.A→B是一个等温过程 • C.A与B的状态参量相同 • D.B→C体积减小,压强减小,温度不变
• 解析: D→A是一个等温过程,A对;A、B两状态温度不同,A→B 是一个等容过程(体积不变),B、C错;B→C,V增大,p减小,T不 变,D错.
• 答案: BCD
• 1.一定质量的气体,在等温变化过程中,下列物理量发生变化的是
()
• A.分子的平均速率
B.单位体积内的分子数
• C.气体的压强
D.分子总数
• 解析: 一定质量的气体,温度不变,因此分子的总数及平均速率都是 不变的,但压强与体积要发生变化使单位体积的分子数发生变化,故选
BC.
LS. • 用手把柱塞向下压或向上拉,读出若干组
刻度
与
的值.
• (3)实验数据处理
• ①猜想:由实验观察及记录数据可知,空气柱的体积越小,其压强
就
,空气柱的压强与体积可能成
.
体积V
压强p
反比
越大
②检验:以压强 p 为纵坐标,以体积的倒数V1为横坐标,把 以上各组数据在坐标系中描点,如图所示.观察各点的位置关 系,若各点位于过原点的同一直线上,说明压强跟体积的倒数 成 正比 ,即 p∝V1,也就是说压强 p 与体积 V 成 反比 .若 各点不在同一直线上,再尝试其他关系.
cmHg,求空气柱A、B的压强.
• 解为=m析研a:究g,对设象气进体行A受、力B分产析生如的图压甲强所分示别,为得pAp、ASp+B,m管ag截=面p0S积,为而Sp,aS取=aρ液gh柱1S
• 故pAS+paS=p0S • 所以pA=p0-pa=75 cmHg-10 cmHg • =65 cmHg
等温变化,D不是等温变化.
• 答案: D
• ◎ 教材资料分析 • 〔思考与讨论〕——教材P20 • 图中有两条等温线,你能判断哪条等温线表
示的是温度比较高时的情形吗?你是根据什 么理由做出判断的?
