初中化学工艺流程图题集
初中化学实用工艺流程图题集

初中化学工艺流程图题集1、某氯化钾固体样品中含有少量氯化钙和硫酸镁等杂质,实验室提纯氯化钾流程如下:(1)操作A的目的是使样品________。
过滤时用到的玻璃仪器有漏斗、烧杯、________。
实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是________________。
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号),反应的化学方程式为。
X溶液中溶质是________(填化学式)。
若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是。
答案:(1)充分溶解;玻璃棒;滤纸没有紧贴漏斗内壁(2)SO42-、Mg2+(写全才1分);Ba(OH)2+MgSO4==BaSO4↓+Mg(OH)2↓;K2CO3;氯2、(2014.佛山)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。
下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图:(1)操作a、b、c的名称都是。
(2)操作a的目的是。
(3)从滤液C中可回收的副产品的化学式为。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(2)在该生产过程中,用110kg 大理石制得了72Kg 的过氧化钙。
如果不考虑过程中的损耗,可计算出大理石中CaCO 3的质量分数为 。
(结果保留一位小数)答案:(1)过滤 (2)除去大理石中不溶于水也不溶于酸的杂质 (3)NH 4Cl(4)3NH 3·H 2O+AlCl 3=Al(OH)3 +3NH 4Cl (5)复分解反应 (6)90.9%3.(2014.广州)粗盐中除NaCl 外还含有MgSO4以及泥沙等杂质。
初步提纯粗盐的实验流程如下:溶解过滤3.6g 粗盐蒸馏水滤渣滤液蒸发结晶精盐回收装瓶(1)“滤渣”是粗盐中含有的 。
(2)实验过程中四次用到玻璃棒,分别是:第一次:溶解时搅拌;第二次: ;第三次: ;第四次:将精盐从蒸发皿转移出来。
完整版)初中化学流程图题目附答案

完整版)初中化学流程图题目附答案1.海水是一种重要的自然资源,在我们市也有相应的利用方式。
其中,从海水中获取淡水是一种常用的操作方法。
另外,从海水中获得氯化钠也是一种利用方式。
具体操作包括将海水进行处理,得到粗盐,然后除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质。
从海水中得到金属镁也是一种利用方式,其中包括从海水中提取镁的简单流程。
海水本身就是含有MgCl2的溶液,与通过步骤①、②得到的MgCl2溶液有所不同。
此外,海水还可以用于“制碱”,具体操作流程如图所示。
2.海水中含有丰富的镁,是制取金属镁的重要原料。
分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2工业上以苦卤水为原料制取金属镁的流程包括在沉淀槽中进行反应、将产物溶于水得到溶液等步骤。
其中,沉淀槽中发生的反应的化学方程式为重要的一部分。
此外,烘干后得到的MgCl2中可能含有一些杂质。
3.海水中含有丰富的氯化镁,可以用于提取镁。
具体操作包括选择合适的试剂进行反应、进行沉淀等步骤。
其中,试剂A可以根据实际需要进行选择,沉淀B与试剂C发生的是中和反应,沉淀B的化学式为重要的一部分。
由无水MgCl 2电解制取Mg的化学方程式也是关键的一环。
电解无水MgCl2过程中所发生的能量转化与给蓄电池充电相同。
在从氯化镁溶液中取得氯化镁晶体时,应选择蒸发溶剂结晶方式。
4.通过海水晾晒可得粗盐,但其除NaCl外还含有MgCl2CaCl2Na2SO4以及泥沙等杂质。
为制备精盐,需要进行一系列的实验操作,包括溶解、过滤、结晶等步骤。
其中,选择适当的结晶方式也是非常重要的。
1)在第一步粗盐溶解操作中要用水搅拌,作用是使盐溶解均匀。
2)第二步操作的目的是除去粗盐中的杂质,化学式为NaCl。
3)第五步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2.4)在第三步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是因为不同试剂对应的化学反应不同。
中考化学专题复习-流程图题复习(有详解答案)

工艺流程图题类型1物质合成流程图Ⅰ.与碳酸钙有关的工艺流程1. 医用氯化钙常用于合成药物。
以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程如图所示。
第1题图(1)写出第①步中碳酸钙与盐酸反应的化学方程式:_______________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是____________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法:______________________________________________。
2. 超细碳酸钙可用于生产钙片、牙膏等产品。
利用碳化法生产超细碳酸钙的主要流程示意图如下:第2题图(1)石灰石主要成分的化学式为________。
(2)乳化池中,生石灰与水发生反应,其化学方程式为___________________________。
(3)过筛的目的是拦截________(填“大于”或“小于”)筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为____________________________________。
3. 牙膏中常用轻质碳酸钙粉末作摩擦剂。
小李在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠。
第3题图(1)操作②的名称是________。
(2)石灰石高温灼烧的化学方程式为______________________________。
(3)为了验证加入Na2CO3溶液后,溶液M中的溶质是否反应完全,可取上层清液加入________(填序号)进行检验,该反应的现象为__________________。
A. 碳酸钠溶液B. 铁粉C. 无色酚酞(4)浓NaOH溶液溅到皮肤或衣服上时,应立即用较多水冲洗,并涂上________溶液。
中考化学流程图综合经典题及详细答案

一、中考初中化学流程图1.《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO 3)和煤炭饼装入炼锌罐(如下图所示),泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。
(已知:锌的熔点 为 419℃,沸点为 907℃)(1)反应区中,ZnCO 3 分解生成 ZnO 和另一种氧化物,反应的化学方程式为_________。
C 与 ZnO 发生置换反应得到 Zn ,反应中化合价升高的元素是_____。
(2)冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是_____℃。
(3) “冷定”后方能“毁罐”取锌、从化学变化角度解释其原因:_____。
【答案】ZnCO 3加热ZnO +CO 2↑ C (或“碳”) 419~907 防止生成的锌在较高温度下又被氧化成氧化锌(或“2Zn +O 2加热2ZnO”)【解析】【分析】 碳酸锌高温生成氧化锌和二氧化碳,碳和氧化锌高温生成锌和二氧化碳,锌和氧气加热生成氧化锌。
【详解】(1)反应区中,ZnCO 3 分解生成 ZnO 和二氧化碳,反应的化学方程式为32ZnCO ZnO+CO 加热。
C 与 ZnO 发生置换反应得到Zn 和二氧化碳,故反应中化合价升高的元素是碳。
(2)锌的熔点为 419℃,沸点为 907℃,冷凝区中,锌由气态转化为液态,故该区应控制的温度范围是419~907℃。
(3)锌在较高温度被氧化成氧化锌,“冷定”后方能“毁罐”取锌,原因是防止生成的锌在较高温度下又被氧化成氧化锌。
2.酸、碱、盐在生产和生活中有广泛的应用。
(1)氢氧化钠、氢氧化钙具有相似的化学性质,是因为它们的水溶液中均含有_____(填离子符号)。
(2)同学们想除去粗盐中含的泥沙等不溶性杂质和含有的少量氯化镁、氯化钙、硫酸钠可溶性杂质,进行了探究活动:实验一:除去粗盐中不溶性杂质实验二:从滤液1中提取氯化钠固体①实验一中的操作I是_____,实验二中蒸发结晶操作中玻璃棒的作用为_____。
中考化学专题练习:流程题图
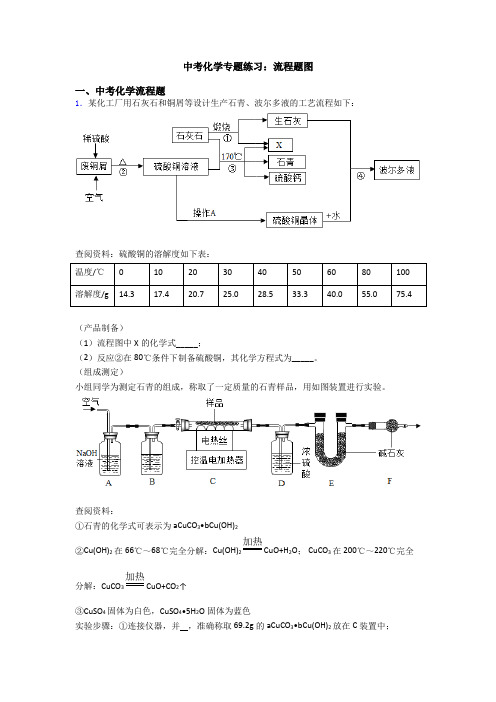
中考化学专题练习:流程题图一、中考化学流程题1.某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:查阅资料:硫酸铜的溶解度如下表:温度/℃010203040506080100溶解度/g14.317.420.725.028.533.340.055.075.4(产品制备)(1)流程图中X的化学式_____;(2)反应②在80℃条件下制备硫酸铜,其化学方程式为_____。
(组成测定)小组同学为测定石青的组成,称取了一定质量的石青样品,用如图装置进行实验。
查阅资料:①石青的化学式可表示为aCuCO3•bCu(OH)2②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2加热CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3加热CuO+CO2↑③CuSO4固体为白色,CuSO4•5H2O固体为蓝色实验步骤:①连接仪器,并,准确称取69.2g的aCuCO3•bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞,继续通一段时间空气;⑤冷却后,称量,装置D增重3.6g,装置E增重17.6g。
(3)完善上述实验步骤①中的填空: _____;(4)洗气瓶A中氢氧化钠溶液的作用是_____;B中所装液体为___(填名称)。
(5)试确定石青的化学式___(请写出计算过程)。
(6)若缺少F装置,测得的a:b的值将___(选填“偏大”、“偏小”、“不变”)。
(脱水探究)硫酸铜晶体受热会逐步失去结晶水。
取纯净的CuSO4•5H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。
(7)G点固体的化学式是___;H点固体的颜色是__。
(8)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。
中考化学 流程图综合试题附答案

一、中考初中化学流程图1.硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO、SiO2等,铁的氧化物均能与盐酸反应,SiO2不与酸反应)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(Fe2O3)等产品的部分流程如图所示:(1)焙烧时C与O2不完全燃烧产生的气体都能将铁的多种氧化物还原成铁。
试写出该气体与Fe3O4反应的化学方程式__________。
(2)酸浸、过滤后滤液中的溶质主要是__________。
(填化学式)(3)在空气中煅烧FeCO3即FeCO3与空气中的O2反应生成Fe2O3和CO2,试写出该反应的化学反应方程式为:__________。
(4)若产品a的主要成分是K2SO4,得到产品a时加入的试剂X为__________。
由此判断在此条件下K2SO4的溶解度__________NH4Cl的溶解度(选填“<”或“>”或“=”)。
(5)可选用下列__________(填字母)洗涤产品a。
A.KCl饱和溶液 B.水 C.饱和K2SO4溶液.【答案】4CO + Fe3O43Fe + 4 CO2FeSO44FeCO3 + O2 2Fe2O 3 + 4CO2KCl<C【解析】(1)根据碳不完全燃烧产生的气体是一氧化碳,一氧化碳与四氧化三铁在高温的条件下反应生成铁和二氧化碳解答;(2)根据酸浸后发生的反应考虑生成物;(3)根据书写方程式的原则书写;(4)根据反应流程分析解答;(5)根据产品a的主要成分是硫酸钾,所选试剂能溶解其他物质但不能溶解硫酸钾解答。
(1)C与氧气不完全燃烧生成一氧化碳,一氧化碳与Fe3O4反应生成物是铁和二氧化碳,化学方程式为Fe3O4+4CO 高温3Fe+4CO2;(2)酸浸后发生的反应是铁与硫酸反应生成硫酸亚铁和氢气,所以酸浸、过滤后滤液中的溶质主要是硫酸亚铁(FeSO4);(3)在空气中煅烧FeCO3的反应物是FeCO3和氧气,生成物是Fe2O3与CO2,反应条件是高温,所以方程式为4FeCO3+O2高温2Fe2O3+4CO2;(4)由流程图可以看出酸浸、过滤后滤液中的溶质主要是硫酸亚铁,硫酸亚铁和碳酸氢铵反应生成碳酸亚铁和硫酸铵,过滤后反应Ⅱ中硫酸铵与X 反应生成硫酸钾和氯化铵,因此加入的X应为氯化钾(KCl),要过滤得到硫酸钾,说明在此条件下硫酸钾的溶解度小于氯化铵的溶解度;(5)产品a的主要成分是硫酸钾,所选试剂必须能溶解其他物质但不能溶解硫酸钾,故选C 。
【精品免费】【决胜】(压轴题)中考化学专题06工艺流程图(含解析)

专题06 工艺流程图1.【2014年四川省达州市】化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。
流程如下:请回答:(1)四种金属的活动性顺序由强到弱的是;(2)固体丙中一定含有的金属是;(3)写出③中反应的化学方程式;(4)为了检验滤液C中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C中一定含有的阳离子。
【答案】(1)Zn、X、Cu、Ag ;(2)Ag ;(3)Cu+2AgNO3=Cu(NO3)2+2Ag;(4)Ag+、Cu2+【解析】试题分析:(1)由流程可知,锌能与滤液A反应得到滤液B,而铜和银在固体甲中,故X在滤液A中,且能被锌置换,故四种金属的活动性顺序由强到弱的是Zn、X、Cu、Ag ;(2)因为铜和银在固体甲中,且铜能与硝酸银反应,所以固体丙中一定含有的金属是银;(3)③发生的反应是铜和硝酸银生成硝酸铜和银,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;(4)加入稀盐酸有白色沉淀产生,则滤液中含有Ag+,又因为反应③为铜和硝酸银生成硝酸铜和银,则滤液C中一定含有的阳离子Ag+、Cu2+。
考点:金属活动性顺序表;2.(2013•无锡)高纯氧化钙是用于电子工业重要的无机化工原料.用硝酸钙溶液制备高纯氧化钙的工艺流程如下:反应池中发生反应的化学方程式为:CO3+2NH3•H2O+C a(NO3)2═2NH4NO3+CaCO3↓+H2O请回答下列问题:(1)过滤操作中玻璃棒的作用是.(2)过滤后所得沉淀表面可能含有的可溶性杂质有(写出一种即可).(3)该工艺流程中可循环使用的物质是.(4)冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有的杂质是.(5)上述流程中的副产物NH4NO3可用作氮肥,氮肥的主要作用是.A、促进植物生长,叶色浓绿B、增强作物的抗寒,抗旱能力C、增强作物的抗病虫害和抗倒伏能力.【答案】(1)引流(2)硝酸钙(3)二氧化碳.(4)氢氧化钙.(5) A .【解析】试题分析:(1)过滤操作中玻璃棒的作用是引流.故填:引流.(2)过滤后所得沉淀表面可能含有的可溶性杂质有硝酸钙、硝酸铵等.故填:硝酸钙.(3)因为碳酸钙受热分解能生成二氧化碳,所以该工艺流程中可循环使用的物质是二氧化碳.故填:二氧化碳.(4)冷却需在干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙.故填:氢氧化钙.(5)上述流程中的副产物NH4NO3可用作氮肥,氮肥的主要作用是促进植物生长,叶色浓绿.故填:A.3.(2013•扬州)某热电厂用脱硫得到的石膏(CaSO4•2H2O)生产K2SO4肥料的流程如下.请回答下列问题:(1)石膏中S的化合价是.脱硫过程的化学方程式为2CaCO3+2SO2+O2+4H2O=2CaSO4•2H2O+2 .(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是.(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及(填字母序号),玻璃棒的作用是.(4)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体.此反应的基本类型是,浓氨水的作用是,反应Ⅱ需在密闭容器中进行的原因是.(5)该工艺可以循环利用的物质有(写一种),副产品NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变色.【答案】(1)+6 CO2.(2)使原料充分反应,提高原料利用率(3)ac 引流(4)复分解反应降低硫酸钾的溶解度,利于硫酸钾的析出,浓氨水易挥发.(5)碳酸钙蓝【解析】试题分析:(1)在CaSO4•2H2O中,由于钙显+2价、氧显﹣2价、氢显+1价,所以,硫显+6价.由质量守恒定律反应前后原子的种类及数目不变可知,应填入的物质是CO2;(2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是使原料充分反应,提高原料利用率;(3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及烧杯和漏斗,玻璃棒的作用是引流;(4)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体,生成了氯化铵,是两种化合物相互交换了成分生成了另外两种化合物,属于复分解反应.由于浓氨水易挥发出氨气带走了大量的热,降低硫酸钾的溶解度,利于硫酸钾的析出,为了防止氨气挥发,反应Ⅱ需在密闭容器中进行;(5)由反应的流程可知,该工艺可以循环利用的物质是碳酸钙,由于NH4Cl与NaOH溶液混合微热,产生了氨气,氨气的水溶液显碱性,能使湿润的红色石蕊试纸变蓝色.4.(2013•泰州)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图所示:请回答下列问题:(1)纳米级 Fe 粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为Fe3O4.(2)请补充完成上述制备工艺的化学方程式:H2+FeCl2Fe+ 2HCl .在制备纳米级 Fe 粉的工艺流程中,N2的作用是催化作用.(3)研究人员发现最后制得的纳米级 Fe 粉样品中混有少量的 FeCl2杂质.①为除去样品中的杂质,在无氧环境下,先加水溶解,然后再过滤、洗涤、烘干.②取样品20g,加入足量的盐酸,生成氢气 0.7g.请计算该样品中单质 Fe 的质量分数.(请写出计算过程).【答案】(1)Fe3O4.(2)2HCl 催化作用(3)①水过滤②98%.②设生成0.7g 氢气需要参加反应的铁的质量为X ,则:Fe+2HCl═FeCl 2+H 2↑56 2X 0.7g 根据:解得X=19.6g .铁的质量分数为:19.6g 20g×100%=98% 答:略。
中考化学《流程图题》专项练习题(附带答案)

①步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为______。
②溶液X中只含有一种溶质,该溶质为______。
17.(2023贵州)溶液的配制和应用在生活、生产中非常普遍。
(1)实验室用“电解水”的实验来探究水的组成,探究的理论依据是_____,反应的化学方程式是_______。
(4)反应②生成的水全部循环利用,为使该过程持续发生,反应①需要不断补充水,其原因是_______。
12.(2023广西)柠檬酸亚铁(FeC6H6O7)是一种易被吸收的补血剂。利用硫酸厂的废渣(主要含Fe2O3、Fe3O4,还有少量SiO2)制备柠檬酸亚铁,该工艺流程如图所示,回答下列问题:
资料1: ;
资料2:SiO2不溶于水,也不与稀硫酸反应。
(1)柠檬酸亚铁进入人体肠道后以_______(填阳离子符号)的形式被吸收,达到补血效果。
(2)固体C的成分是_______。
(3)步骤①②③④中涉及置换反应的是_______(填数字序号)。
(4)步骤③中发生反应的化学方程式是_______。
(5)“一系列操作”中,将柠檬酸亚铁晶体与溶液分离的操作是_______。
(4)降温至0℃的“冷冻结晶”过程,析出的两种物质中较多的是_________________。
(5)结合溶解度曲线解释,“蒸发结晶2”主要得到氯化钠的原因是_________________。
10.(2023深圳)某同学以金泥(含有Au、CuS、ZnS等)为原料制备(Au)和Cu的流程如图所示:
琴琴同学查阅资料已知:
13.(2023广州)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学工艺流程图题集1、某氯化钾固体样品中含有少量氯化钙和硫酸镁等杂质,实验室提纯氯化钾流程如下:(1)操作A的目的是使样品________。
过滤时用到的玻璃仪器有漏斗、烧杯、________。
实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是________________。
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号),反应的化学方程式为。
X溶液中溶质是________(填化学式)。
若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是。
答案:(1)充分溶解;玻璃棒;滤纸没有紧贴漏斗内壁(2)SO42-、Mg2+(写全才1分);Ba(OH)2+MgSO4==BaSO4↓+Mg(OH)2↓;K2CO3;氯2、(2014.佛山)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。
下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO 2的流程图:(1)操作a 、b 、c 的名称都是 。
(2)操作a 的目的是 。
(3)从滤液C 中可回收的副产品的化学式为 。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(2)在该生产过程中,用110kg 大理石制得了72Kg 的过氧化钙。
如果不考虑过程中的损耗,可计算出大理石中CaCO 3的质量分数为 。
(结果保留一位小数)答案:(1)过滤 (2)除去大理石中不溶于水也不溶于酸的杂质(3)NH 4Cl(4)3NH 3·H 2O+AlCl 3=Al(OH)3 +3NH 4Cl (5)复分解反应(6)90.9%3.(2014.广州)粗盐中除NaCl 外还含有MgSO4以及泥沙等杂质。
初步提纯粗盐的实验流程如下: 溶解过滤3.6g 粗盐蒸馏水滤渣滤液蒸发结晶精盐回收装瓶(1)“滤渣”是粗盐中含有的。
(2)实验过程中四次用到玻璃棒,分别是:第一次:溶解时搅拌;第二次:;第三次:;第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因:(4)看图可知,200C时NaCl的溶解度为g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为 ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是。
答案:⑴泥沙⑵过滤时引流蒸发时搅拌⑶氯化钠的溶解度受温度影响不大⑷36 10 不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料。
4、(2014•茂名)某沿海工业区排放的污水中含有少量的Fe2+,Na+,Ca2+,Cu2+,Cl﹣,为了达到零污染的目标,将污水进行如下工业流程处理:(1)步骤Ⅰ的操作名称是,并写出步骤Ⅰ中的化学方程式.(2)滤渣Ⅰ所含的物质是(填化学式).(3)加入过量NaOH溶液的目的是.(4)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用来测定溶液的酸碱度,确保盐酸不过量.解答:解:(1)分离难溶性固体和液体应该采用过滤的方法;因为在金属活动顺序中,铁排在铜的前面,因此可以置换出氯化铜中的铜;故填:过滤;Fe+CuCl2=Cu+FeCl2;(2)因为在步骤Ⅰ中加入的铁粉是过量的,所以滤渣Ⅰ是置换出来的铜与剩余的铁的混合物;故填:Fe和Cu;(3)氢氧化钠溶液能与氯化亚铁溶液反应生成氯化钠和氢氧化亚铁沉淀,加入过量的氢氧化钠溶液就可以将亚铁离子完全除去;故填:完全除去Fe2+;(4)测定溶液的酸碱度,也就是pH,通常用pH试纸.故填:pH试纸.点评:本题考查了金属活动性、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.5.某兴趣小组在实验室发现了一块绿色的孔雀石标本,查阅资料知其主要成分是Cu2(OH)2CO3.他们以Cu2(OH)2CO 3为原料制取铜,其工艺流程如图所示.(1)过滤操作中用到的铁制仪器为(2)无色气体A的化学式是,大气中该气体含量不断上升,会导致增强,全球气候变暖.(3)写出蓝色溶液B与铁粉发生反应的化学方程式.(4)试剂E可选用溶液.解答:解:碱式碳酸铜和过量的硫酸反应会生成硫酸铜、水和二氧化碳,所以蓝色溶液B是硫酸铜溶液,其中含有反应剩余的稀硫酸,硫酸铜和铁反应会生成硫酸亚铁和铜,所以C中含有铁和铜,溶液D中含有硫酸亚铁和硫酸,铁和硫酸反应生成硫酸亚铁和氢气,所以F是氢气,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,硫酸铜和铁反应生成硫酸亚铁和铜,铁和硫酸反应生成硫酸亚铁和氢气,推导合理.(1)过滤操作中用到的仪器有:烧杯、漏斗、玻璃棒、铁架台、滤纸等,所以过滤操作中用到的铁制仪器为:铁架台;(2)通过推导可知A是二氧化碳,化学式为:CO2,大气中二氧化碳含量增多,会导致温室效应增强,全球气候变暖;(3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:CuSO4+Fe=FeSO4+Cu;(4)通过推导可知固体C中含有铁和铜,铁排在氢之前,铜排在氢之后,所以试剂E 可选用稀硫酸溶液.故答案为:(1)铁架台;(2)温室效应;(3)CuSO4+Fe=FeSO4+Cu;(4)稀硫酸.点评:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.6.木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学实验小组设计回收铜的方案如下:(1)过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和_________,其中玻璃棒的作用是_________.(2)反应①的化学方程式为_________.(3)滤液Ⅱ中的溶质为_________.(4)试剂A最好选用下列_________溶液(填序号).①H2SO4②CuSO4③MgSO4(5)为了完善实验方案,可对滤渣Ⅰ中的_________进行回收.解析:(1)根据过滤时所用仪器可知,必须用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流(2)氧化铜与硫酸反应生成硫酸铜和水,铜、木炭与硫酸不反应,化学方程式为:H2SO4+CuO═CuSO4+H2O;(3)反应①后,滤液1中的溶质是硫酸和硫酸铜,过滤后的滤液中加入过量铁粉,硫酸铜和铁粉反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu,H2SO4+Fe═FeSO4+H2↑;滤液Ⅱ中的溶质为硫酸亚铁;(4)滤渣Ⅱ中含有剩余的铁粉,因此可加入硫酸除去;(5)开始混合粉末中的铜没有和酸反应,进入滤渣Ⅰ中,为了回收更多的铜,可将滤渣Ⅰ中的铜也回收.答案:(1)漏斗引流(2)H2SO4+CuO═CuSO4+H2O(3)硫酸亚铁(4)①(5)Cu7(2013•佛山)硫酸钙转化为K2SO4和CaCl2•6H2O的工艺流程如下:(1)吸收过程中发生了化学反应,化学方程式为_________.(2)操作I的名称为_________,沉淀的主要物质为_________(填化学式).(3)蒸氨过程中涉及的反应类型_________(填编号).A.复分解反应B.化合反应C.分解反应D.置换反应(4)操作Ⅲ包含一系列操作:蒸发浓缩、_________、过滤、洗涤、干燥.(5)可循环利用的物质除了NH3外,还有_________(填化学式).答案:(1)CO2+H2O+2NH3=(NH4)2CO3;(2)过滤,CaCO3 ;(3)AB;(4)冷却结晶;(5)CO2,CaO.8.(8分)(2013•茂名)提纯某KCl样品(含有少量的MgCl2和K2SO4)的方案(所加试剂均过量)如下:样品溶液浊液滤液溶液回答下列问题:(1)步骤①和③的实验操作均用到的玻璃仪器有玻璃棒和_________.(2)步骤②得到的浊液中含有Mg(OH)2和BaSO4沉淀,写出生成BaSO4的化学方程式_________.(3)确定步骤③所加的K2CO3是否过量的方法是:在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若没有白色沉淀生成,则说明所加K2CO3_________.(4)步骤④得到的溶液的溶质除了KCl外,还含有_________(填化学式).若要得到KCl晶体,还要进行如下操作:将溶液倒入_________(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到_________时(填现象),停止加热,用余热使水分蒸干.分析:(1)溶解、过滤时均用到的玻璃仪器有玻璃棒和烧杯;(2)根据浊液的成分可以判断试剂A的名称,根据反应物、生成物及其质量守恒定律可以书写化学方程式;(3)氯化钡和碳酸钾反应能生成碳酸钡沉淀和氯化钾,该反应可以判断碳酸钾是否过量;(4)盐酸中的溶质是氯化氢,蒸发结晶一般在蒸发皿中进行.解答:解:(1)溶解、过滤时都要用到玻璃棒和烧杯.故填:烧杯.(2)步骤②得到的浊液中含有Mg(OH)2和BaSO4沉淀,说明试剂A 是氢氧化钡溶液,氢氧化钡和硫酸钾反应能生成硫酸钡沉淀和氢氧化钾,反应的化学方程式为:Ba(OH)2+K2SO4═BaSO4↓+2KOH.故填:Ba(OH)2+K2SO4═BaSO4↓+2KOH.(3)在加入K2CO3后的浊液中取少量上层澄清液于试管,然后滴加K2CO3溶液,若没有白色沉淀生成,则说明所加碳酸钾过量.故填:过量.(4)步骤④得到的溶液的溶质除了KCl外,还含有盐酸,盐酸中的溶质是氯化氢,化学式是HCl.故填:HCl.蒸发结晶时,用到的仪器是蒸发皿.故填:蒸发皿.加热蒸发并用玻璃棒不断搅拌,直到出现较多固体时,停止加热,用余热使水分蒸干.故填:出现较多固体.点评:本题主要考查杂质的去除、化学方程式的书写、蒸发结晶等方面的知识,要注意蒸发结晶操作过程中,停止加热的时间要掌握好.9、(2013•梅州)我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈_________色.(2)写出反应I的化学方程式_________;该反应的基本类型为_________.(3)操作a的过程是蒸发浓缩、_________、过滤.(4)上述工艺流程中可循环利用的物质是_________.分析:(1)根据氨气的水溶液显碱性分析;(2)根据反应写出反应的方程式,根据反应的特点分析反应的类型;(3)观察分析工艺流程,找出可循环利用的物质.解答:解:(1)NH3溶于水得到氨水,氨水显碱性,将无色酚酞溶液滴入氨水中,溶液呈红色;(2)由工艺流程可知,碳酸氢铵受热分解生成了氨气、二氧化碳和水,反应的方程式是:2NaHCO3Na2CO3+H2O+CO2↑.该反应由一种物质生成了三种物质,属于分解反应;(3)由工艺流程中可知,向饱和的食盐水中通入了二氧化碳,在加热碳酸氢钠时又生成了二氧化碳,所以,可循环利用的物质是CO2.故答为:(1)红;(2)2NaHCO3Na2CO3+H2O+CO2↑,分解反应;(3)CO2.点评:化学来源于生产、生活,又服务于生产、生活,本题很好的体现了这一理念;该题涉及化学方程式的书写,反应类型的判断等知识,要根据相关知识细心分析解答.10、(2013•珠海)粗盐中含泥沙、氯化钙、氯化镁等杂质,某同学自制的简易净水器(如图1)中放置物质的顺序错误,使净水效果不理想.(1)请按由上到下的顺序重新排列_________(填字母).调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:(2)如图2中步骤①②都需要进行_________操作,步骤④需要进行_________操作.(3)已知试剂X是碱溶液,则沉淀I为_________(写化学式),下列碱溶液不符合要求的是_________(填序号).A.氢氧化钠溶液B.氢氧化钡溶液C.氢氧化钾溶液D.氢氧化钙溶液(4)步骤②除去氯化钙的反应方程式是_________;步骤③中发生中和反应的化学方程式是_________.分析:(1)净化水的物质要有一定的顺序;(2)过滤可以把不溶于水的物质除去,蒸发食盐水可以得到食盐固体;(3)显碱性的物质能和氯化镁反应生成氢氧化镁沉淀;(4)碳酸钠能和氯化钙反应生成碳酸钙和氯化钠,氢氧化钠能和盐酸反应中和反应.解答:解:(1)按由上到下的顺序重新排列应该是:用小卵石除去较大的颗粒,再用石英砂除去较小的颗粒,再用活性炭除去色素和异味,最后是蓬松棉,起支撑作用.故填:BADC.(2)如图2中步骤①②都需要进行过滤操作,步骤④需要进行蒸发操作.故填:过滤;蒸发.(3)如果试剂X是碱溶液,碱溶液能和氯化镁反应生成氢氧化镁沉淀,氢氧化镁的化学式是Mg(OH)2.故填:Mg(OH)2.氢氧化钠溶液和氯化镁反应生成氢氧化镁和氯化钠,氢氧化钡和氯化镁反应生成氢氧化镁和氯化钡,氢氧化钙和氯化镁反应生成氢氧化镁和氯化钙,其中的氯化钙、氯化钡在加入碳酸钠后,能够转化成碳酸钙、碳酸钡沉淀;而氢氧化钾和氯化镁反应生成的氯化钾在加入碳酸钠后无法除去,所以氢氧化钾不符合要求.故填:C.(4)步骤②除去氯化钙的反应方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl,步骤③中发生中和反应的化学方程式是:NaOH+HCl═NaCl+H2O.故填:CaCl2+Na2CO3═CaCO3↓+2NaCl;NaOH+HCl═NaCl+H2O.11、(2012•佛山)合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如下:(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为_________.(2)制取氢气的反应过程为:C+H2O CO+H2,CO+H2O CO2+H2.上述两个化学方程式中表现氧化性的物质是_________(填化学式).(3)原料中N2、H2中常含有CO2和水蒸气,反应前要净化.净化的过程是_________.(4)写出N2、H2反应生成NH3的化学方程式_________.(5)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在﹣183℃时,可将空气中N2与O2分离.根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在_________℃.解:(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为78%或4/5;故答案为:78%(或4/5)(2)水在上述两个化学方程式中,提供氧元素,表现为氧化性;故答案为:H2O(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;故答案为:先把原料气通过NaOH溶液(或石灰水等碱液),再通过浓硫酸(或碱石灰等干燥剂)(4)氮气和氢气在有催化剂和高温高压的条件下生成氨气,故答案为:N2+3H22NH3(5)根据表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在﹣33.35℃;故答案为:﹣33.3512.(2012•广州)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下图1:(1)写出下列反应的化学方程式:反应①:_________;反应②:_________.(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需_________g 98%的硫酸和_________g水.实际操作时,用lOmL量筒取98%的硫酸(密度为1.84g/cm3),请在图2中画出所取硫酸的液面.(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入_________中(填仪器名称),然后_________(填操作名称),使反应充分进行.(4)试剂A可选用_________溶液(填一种物质的化学式).(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)_________.分析:(1)根据反应流程及反应物和生成物写出化学方程式(2)根据溶质质量分数的计算公式及公式变形分析求解(3)烧杯可用作较多试剂进行反应的容器(4)要除去铜粉中的铁粉,可加入稀硫酸(5)要得到更多的铜,可将反应过程中的铜全部回收解答:解:(1)氧化铜与硫酸反应生成硫酸铜和水,铜、木炭与硫酸不反应,化学方程式为:H2SO4+CuO═CuSO4+H2O过滤后的滤液中加入铁粉,硫酸铜和铁粉反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4═FeSO4+Cu(2)需要98%的硫酸的质量为=10g;,需要浓硫酸的体积为:=5.4mL.需要水的质量为40g﹣10g=30g;(3)较多量试剂的反应容器可在烧杯中,为了加快反应速率可用玻璃棒不断搅拌.(4)滤渣Ⅱ中含有剩余的铁粉,因此可加入硫酸除去(5)开始混合粉末中的铜没有和酸反应,进入滤渣Ⅰ中,为了回收更多的铜,可将滤渣Ⅰ中的铜也回收故答案为:(1)反应①:H2SO4+CuO═CuSO4+H2O反应②:Fe+CuSO4═FeSO4+Cu(2)10g;30g.所取硫酸的体积为5.4mL(如图所示)(3)烧杯;用玻璃棒不断搅拌.(4)H2SO4(CuSO4等合理即给分)(5)回收滤渣I中的Cu点评:对于流程图的题目关健是看明白流程图中各物质的转化关系,注意过量物质的去向,如何除去过量物质.13.(8分)(2012•梅州)粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如图所示:(1)Ca(OH)2溶液的pH_________(填“>”、“=”或“<”)7.步骤①反应的化学方程式为_________.(2)步骤③操作a的名称是_________.步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和_________.(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有_.分析:(1)Ca(OH)2溶液成碱性,pH大于7;Ca(OH)2溶液只能与粗盐水中的MgCl2反应,据此写出化学反应式;(2)经过①②后,要进行过滤实验除去沉淀;加入适量的盐酸可以除去滤液中多余的Na2CO3和NaOH;(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2分析.解答:解:(1)Ca(OH)2溶液成碱性,pH大于7;Ca(OH)2溶液只能与粗盐水中的MgCl2反应,化学反应方程式是:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓;故答案为:>;Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓.(2)经过①②后,生成沉淀,要进行过滤实验除去沉淀,所以步骤③操作a的名称是过滤;步骤①中过量的氢氧化钙和生成的氯化钙与步骤②中过量的碳酸钠反应碳酸钙沉淀、氯化钠、氢氧化钠.所以步骤④加入适量的盐酸可以除去滤液中步骤②加入的多余的Na2CO3和生成的NaOH;故答案为:过滤;NaOH.(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2.如果步骤①和步骤②的顺序颠倒,步骤②先反应溶液中就有过量的碳酸钠,然后完成步骤①,这时过量的氢氧化钙把上步中多余的碳酸钠除去,同时生成氢氧化钠,另外氢氧化钙与氯化镁反应还生成氯化钙,最后步骤④中加入适量的盐酸,反应掉生成的氢氧化钠,但不与生成的氯化钙反应,所以最后所得的精盐水中还含有CaCl2.故答案为:CaCl2.14、(2012•珠海)下面是工厂苛化法生产烧碱的示意图.请回答下列问题:(1)X的化学式为_________(2)生石灰可以由_________(填名称)高温煅烧而得,其反应的化学方程式为:_________(3)操作②的名称是_________;结晶得到的固体烧碱中可能含有少量的_________(写化学式);烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀_________溶液.(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止_________.分析: 由图示的过程可知利用氧化钙和纯碱制取氢氧化钙的过程是:氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙和氢氧化钠,过滤得氢氧化钠的溶液,进行蒸发操作后可得氢氧化钠固体,据此对过程进行分析判断即可.解答: 解:(1)由分析可知x 是水,化学式为H 2O ;(2)生石灰可以由碳酸钙高温分解制得,其方程式为:CaCO 3CaO+CO 2↑;(3)由分析知操作②是将溶液中的溶质氢氧化钠和水进行分离,所采用的操作是蒸发结晶,由于反应池中氢氧化钙过量,所以经过这样的操作后所得固体中可能含有少量的氢氧化钙;如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀硼酸溶液对碱液进行中和,从而减轻碱液对皮肤的腐蚀;(4)由于滤渣来自于氢氧化钠和氢氧化钙的溶液,所以经洗涤过滤后所得的滤液中一定会含有氢氧化钠和氢氧化钙,直接排放会导致浪费和污染环境;循环再利用,可有效的降低生产成本和防止环境污染;故答案为:(1)H 2O ;(2)碳酸钙;CaCO 3CaO+CO 2↑;(3)蒸发;Ca (OH )2;硼酸;(4)环境污染;煤、空气、水 水 点评: 此题是一道框题推断分析题,其主干就是工业上制取烧碱的方法,只要能依据氢氧化钠是由碳酸钠和氢氧化钙制取的原理进行分析,即可得相应的问题答案.15煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
