跟踪检测(五十八)实验方法(1)——物质的分离与提纯
高中化学实验专题—物质的分离、提纯和检验
高中化学实验专题(二)—物质的分离、提纯和检验一、物质的分离和提纯1.物质的分离和提纯可以分为以下四类:(1)固体与液体的分离提纯。
(2)液体与液体的分离提纯。
(3)固体与固体的分离提纯。
(4)气体与气体的分离提纯。
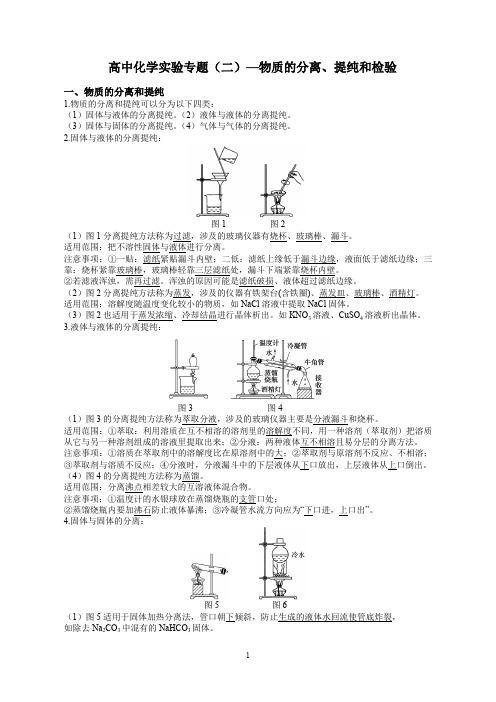
2.固体与液体的分离提纯:图1图2(1)图1分离提纯方法称为过滤,涉及的玻璃仪器有烧杯、玻璃棒、漏斗。
适用范围:把不溶性固体与液体进行分离。
注意事项:①一贴:滤纸紧贴漏斗内壁;二低:滤纸上缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。
②若滤液浑浊,需再过滤。
浑浊的原因可能是滤纸破损、液体超过滤纸边缘。
(2)图2分离提纯方法称为蒸发,涉及的仪器有铁架台(含铁圈)、蒸发皿、玻璃棒、酒精灯。
适用范围:溶解度随温度变化较小的物质,如NaCl溶液中提取NaCl固体。
(3)图2也适用于蒸发浓缩、冷却结晶进行晶体析出。
如KNO3溶液、CuSO4溶液析出晶体。
3.液体与液体的分离提纯:图3图4(1)图3的分离提纯方法称为萃取分液,涉及的玻璃仪器主要是分液漏斗和烧杯。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层的分离方法。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。
(4)图4的分离提纯方法称为蒸馏。
适用范围:分离沸点相差较大的互溶液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;②蒸馏烧瓶内要加沸石防止液体暴沸;③冷凝管水流方向应为“下口进,上口出”。
4.固体与固体的分离:图5图6(1)图5适用于固体加热分离法,管口朝下倾斜,防止生成的液体水回流使管底炸裂,如除去Na2CO3中混有的NaHCO3固体。
(2)图6的分离提纯法称为升华法。
物质的检验分离和提纯学习课件PPT(1)

2.常见物质的分离、提纯方法
方法 适用范围
装置 (1)“一 贴:
注意事项
滤纸紧贴漏斗内壁 滤纸低于漏斗口、液面
;二
不溶性固 过滤是把 体和液体
低:
低于滤纸边缘
烧杯靠
;
玻璃棒、玻璃棒轻靠三层滤
①
纸处、漏斗下端靠烧杯内壁
重新过滤 引流,防止液体外溅 (2) 若滤液浑浊,须
三靠:
过滤 进行分离
的方法
(3)玻璃棒作用:
黄色
透过蓝色钴玻璃
紫色
若看到
火
焰,则含有K+
稀硫酸或可 ④ Ba2+
加入SO42-后, 该沉淀在稀硝 酸中不溶解 ===BaSO4↓
溶性硫酸盐, 产生白色沉淀, Ba2++SO42- 并加入稀硝 酸
先生成白色絮 ⑤ Fe2+ NaOH溶液 状沉淀,沉淀
Fe2++2OH-=== Fe(OH)2↓
===4Fe(OH)3
Al3++3OH-=== Al(OH)3↓ Al(OH)3+OH-
Al3+
===AlO2-+2H2O
Al(OH)3+3H+ ===Al3++3H2O
2.常见阴离子的检验
离子
使用的试剂
反应现象
有关的反应方程 式
加入AgNO3溶 ①Cl
-
液,产生白色
AgNO3溶液、稀硝酸 沉淀,该沉淀
Ag++Cl-=== AgCl↓
Ba2++SO32-=== BaSO3↓ BaSO3+2H+===Ba2
++SO 2↑+H2O
⑦ SO4
2-
BaCl2溶液、
加入稀盐酸,无现 象,再加入BaCl2溶
Ba2++SO42-=== BaSO4↓
初中化学教案:化学物质的分离与提纯实验

初中化学教案:化学物质的分离与提纯实验一、实验目的本实验旨在通过一系列实验操作,使学生了解和掌握常见的化学物质分离与提纯的方法,培养实验操作技能和科学思维。
二、实验材料1.碗口瓶内装有混合溶液A(主要成分为盐和砂);2.针筒;3.滤纸;4.蒸馏水;三、实验步骤步骤一:固体与固体的分离将碗口瓶内的混合溶液A倒入滤纸上,用针筒滴加蒸馏水让其渗透到下方容器中。
观察后可以发现,在滤纸上残留白色的颗粒状颜料,这个颜料即为盐。
通过此步骤可以将盐与砂进行分离。
步骤二:固体与液体的分离——结晶法将过滤好的溶液取出,放置在温暖通风处,等待溶液慢慢蒸发。
随着溶剂蒸发,溶液中的固体会逐渐结晶,在容器底部形成结晶物。
将结晶物捞出,放在滤纸上晾干即可得到纯净的盐。
步骤三:液体与液体的分离——沉淀法取一定量溶液B(主要成分为盐水和沙水),加入少量铁粉悬浊液。
观察可以发现铁粉会迅速沉降,形成黑色沉淀。
通过此步骤可以将沙和盐水进行分离。
步骤四:液体与固体的分离——过滤法将混合溶液B倒入滤纸上,用滴管加入蒸馏水让其渗透至下方容器中。
经过滤后,残留在滤纸上的是黑色铁粉,而流过滤纸下方容器中的是盐水。
通过此步骤可以将铁粉和盐水进行分离。
四、实验注意事项1.实验操作时需佩戴安全眼镜和实验服;2.注意溶剂使用的量并避免过度使用;3.所有废弃物应按照规定进行正确分类处理。
通过本实验,学生能够了解到化学物质分离与提纯的基本原理和方法。
希望能够帮助学生更好地理解化学的实际应用,培养他们对科学实验的兴趣和探索精神。
物质的检验、分离和提纯

物质的检验、分离和提纯【考纲要求】能对常见的物质进行检验、分离和提纯,了解常见离子的检验方法。
网络展示一、物质的检验物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生和换一种说法:鉴定是指对于一种物质的定性检验实例:KSCN检验Fe3+、苯酚检验Fe3+、酸性KMnO4检验不饱和化合物、新制Cu(OH)2悬浊液检验醛类物质等。
鉴别是指对两种或两种以上物质进行辨认2 常见离子的检验(1).常见阳离子的检验(2).常见阴离子的检验33、几种重要有机物的检验(1)苯能与纯溴、铁屑反应,产生HBr白雾。
能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯。
(2)乙醇能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生有刺激性气味的乙醛。
乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上。
(3)苯酚能与浓溴水反应生成白色的三溴苯酚沉淀。
能与FeCl3溶液反应,生成紫色溶液。
(4)乙醛能发生银镜反应,或能与新制的蓝色Cu(OH)2加热反应,生成红色Cu2O沉淀。
二、物质的鉴别1、不用任何试剂鉴别多种物质①先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他的几种物质。
②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来。
③若以上两方法都不能鉴别时,可考虑两两混合法,记录混合后的反应现象,分析确定。
④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同,现象不同而进行鉴别。
2、只用一种试剂鉴别多种物质①先分析被鉴别物质的水溶性、密度、溶液酸碱性,确定能否选用水或指示剂(石蕊)进行鉴别。
②在鉴别多种酸、碱、盐的溶液时,可依据“相反原理”确定试剂进行鉴别。
即被鉴别的溶液多数呈酸性时,可选用碱或水解呈碱性的盐的溶液作试剂;若被鉴别的溶液多数呈碱性时,可选用酸或水解呈酸性的盐的溶液作试剂。
物质的检验、分离和提纯

物质的检验
二、物质检验的一般步骤
(1)对试样的外观进行观察。主要指状态和颜色的观察, 从而划定大致可能的离子范围。 (2)试样的准备。因检验反应一般在溶液中进行,所以 当试样是固体时,首先要进行试样溶液的配制过程。
(3)检验。每次均应移取少量溶液进行检验,绝对不能将 检测试剂直接加入到全部待检测溶液中
3、对溶液中所含的离子进行检验。
在设计检验离子程序时,要考虑离子之间的相互干扰。 如果存在离子之间的干扰,则要先排除干扰,再进行检验。
操作:在三支试管中分别加入少量试样溶液
(1)检验Fe2+ :
向第一支试管中滴入 2 滴KSCN 溶液,溶液不显红色。再向这 支试管中加入几滴新配制的氯水,溶液的颜色变为红色,说明
①任加试剂的鉴别题
一般是通过实验分组,一直分到两个未知物为一组, 只要鉴别了其中之一,另一个也就确定了。此类题可 任意选用试剂或方法完成之。
【例题】用实验方法鉴别HCl、MgSO4、NH4Cl、 Na2SO4、(NH4)2SO4、BaCl2六种溶液。
物质的鉴别
②只用一种试剂或方法的鉴别题
a:选用焰色反应等操作方法鉴别 b:根据溶解度、密度等物理方法鉴别 c:加一种化学试剂逐一鉴别 d:加一种化学试剂一次性鉴别 e:附加条件加一种化学试剂一次性鉴别 f:加一种试剂由少量到多量一次性鉴别 g:加一种试剂同时利用物理方法和化学方法鉴别
常 见 阴 离 子 的 检 验 方 法
物质的检验
六、常见有机物的检验方法
物质的检验
六、常见有机物的检验方法
物质的检验
六、常见有机物的检验方法
物质的鉴定
鉴定通常是指对于一种物质的定性检验,是根据物 质的化学特性,分别检出其阳离子、阴离子,从而得出 是什么物质。
化学实验基本方法——混合物的分离和提纯PPT课件 人教课标版

(3)检验蒸馏水中是 否含有Cl-离子
萃取—利用物质在互不相溶的溶剂里溶解度的不同,用 一种溶剂把物质从它与另一溶剂组成的溶液中提取出来 的方法 ▲萃取剂的选择条件:
1、萃取剂与原溶剂互不相溶。 2、溶质在萃取剂中有较大的溶解度
一部分有机物溶剂 Vs 无机溶剂 汽油 煤油 水 密度比水小 上层 植物油 苯 四氯化碳(密度比水大,下层) 水 思考:酒精能否用来萃取碘水中的碘?
化学上所指导的杂质不一定是有害或无价值的,如水 中含有一些矿物质和微量元素是对人体有益的。可 见,要视杂质性质和含量来评价其是否有害或在人 类活动中是否有利用价值。化学中的除杂质,主要 是因为杂质的存在会影响某物质的利用价值,如在 化学反应中杂质的存在可能会引起一些副反应,或 反应中杂质的存在可能会引起催化剂中毒,等等
5. 为了除去粗盐中的 Ca2+、Mg2+、 SO42-及泥砂, 可将粗盐溶于水, 然后进行下 列五项操作. 其中正确的操作顺序是( CD ) ①过滤;②加过量的NaOH溶液;③加适量 盐酸;④加过量Na2C03溶液;⑤加过量 BaCl2溶液. A ①④②⑤③ C ②⑤④①③ B ④①②⑤③ D ⑤②④①③
2、实验室里用氯酸钾和二氧化锰制取氧气,请问 如何把反应后剩下的物质分离开?
先溶解,然后过滤,最后蒸发
3、为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配 成溶液,然后先后加入KOH、K2CO3 、Ba(NO3)2 等 试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体, 其加入试剂的顺序正确的是( D )
分液--分离互不相溶、密度不同的液体混合物的方法
▲所用仪器:分液漏斗---了解结构 ▲操作注意: 1、使用前检查是否漏水 2、加入萃取剂后要先倒转分液漏斗用力振荡,放 气 后,再静置 3、分液时保持漏斗内与大气压一致,上层液体由 上口倒出,下层液体由下端流出且分液漏斗下端紧 贴烧杯内壁。 生活小常识:油汤洒到衣服上,用酒精、汽油洗涤。
《研究物质的实验方法》物质分离与提纯

《研究物质的实验方法》物质分离与提纯《研究物质的实验方法——物质分离与提纯》在我们的日常生活和科学研究中,经常需要对各种混合物进行分离和提纯,以获得纯净的物质。
这不仅是化学实验中的重要操作,也是许多工业生产过程中的关键步骤。
物质的分离与提纯方法多种多样,每种方法都有其适用的情况和特点。
首先,我们来了解一下过滤这种常见的分离方法。
过滤适用于分离固体和液体混合物,其中固体不溶于液体。
比如,我们要从泥沙和水的混合物中分离出泥沙,就可以使用过滤操作。
进行过滤时,需要用到滤纸和漏斗。
将滤纸对折两次,放入漏斗中,并用少量水润湿,使其紧贴漏斗内壁。
然后将混合物倒入漏斗,液体通过滤纸流下,固体则留在滤纸上。
过滤后的液体称为滤液,留在滤纸上的固体称为滤渣。
接下来是蒸发。
蒸发主要用于从溶液中提取溶质,也就是把溶液中的溶剂蒸发掉,使溶质结晶析出。
例如,从氯化钠溶液中获得氯化钠晶体,就可以采用蒸发的方法。
在蒸发过程中,要用玻璃棒不断搅拌溶液,防止局部过热导致液滴飞溅。
当蒸发皿中出现较多固体时,停止加热,利用余热将剩余的液体蒸干。
如果要分离两种互不相溶、密度不同的液体混合物,我们通常会采用分液的方法。
比如,分离水和油的混合物。
分液时需要用到分液漏斗,将混合物倒入分液漏斗后,静置一段时间,使液体分层。
下层液体从分液漏斗的下口放出,上层液体从上口倒出。
对于沸点不同的液体混合物,蒸馏是一种非常有效的分离方法。
例如,从酒精和水的混合物中分离出酒精。
蒸馏时,将混合物加热至其中一种液体的沸点,使其汽化,然后将蒸汽冷凝收集,就可以得到较纯净的液体。
在蒸馏装置中,温度计的位置、冷凝水的流向等都有严格的要求。
除了上述方法,萃取也是一种重要的分离和提纯物质的手段。
萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,将溶质从溶解度较小的溶剂中转移到溶解度较大的溶剂中的过程。
比如,用四氯化碳从碘水中萃取碘。
萃取时要选择合适的萃取剂,它与原溶剂互不相溶,且溶质在其中的溶解度要远大于在原溶剂中的溶解度。
实验室常用的物质分离和提纯的方法

实验室常用的物质分离和提纯的方法实验室常用的物质分离和提纯方法实验室是研究和开发新技术成果的重要场所,也是各种化学物质分离和提纯的地方。
分离和提纯是指从混合物中提取和精炼出单一或混合物质的过程。
物质分离和提纯常用于实验室实验,具有重要的理论和实践意义,它不但影响实验的准确度,而且也为深入研究实验结果提供了可靠的依据。
实验室常用的物质分离和提纯方法包括蒸馏、沸石精制、浓缩、离心分离、冷凝分离、结晶法、化学吸附、气相色谱法等。
1、蒸馏是把混合物中的某些成分分离出来的常用方法,从混合溶液中把固体的游离溶液以及操作温度比蒸气温度低的液体蒸馏出。
蒸馏法主要包括常压蒸馏、低温蒸馏和水蒸气蒸馏等。
2、沸石精制的原理是利用沸石的吸附性,分离混合液中的有机、无机溶剂,通常用于分离油溶液,也用于分离有机溶液中痕量的杂质吸附,具有较好的净化效果。
3、浓缩是从混合物中提取被浓缩物的方法,通常可以分为加热和加压浓缩,是实验室普遍采用的物质分离的方法。
4、离心分离是利用密度及浮性的区别,以质心离心力's作用将分子不同的混合物中的提纯出来的方法。
5、冷凝分离是取用被分离物体的升温或降温,利用物质在不同温度下的沸点差分离混合物中物质的方法,是一种节约能源的物质分离方法。
6、结晶法是在温度适当条件下,一定时间内给混合液加热,使其能够自晶化而使某一物质结晶,然后分离出其他混合物质的方法。
7、化学吸附是利用一定的吸附材料的剂量,其中的吸附剂(石墨和活性炭等)可以牢牢结合某些物质,将吸附物质从混合物中分离出来的方法。
8、气相色谱法是通过对混合液分子的质量和体积的测定,将组成分子不同的混合液中的单一物质分离出来的方法。
运用气相色谱技术分析物质组成,可以非常精确地计算每种物质的比例,从而确定混合物的构成及性质。
实验室中一般用于物质分离和提纯的上述常用方法,具有良好的效果,不仅对实验结果准确度具有重要影响,而且对实验结果的研究也有重要的理论意义和实践意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
跟踪检测(五十八)实验方法(1)——物质的分离与提纯1.(2017·全国卷Ⅰ)《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是()A.蒸馏B.升华C.干馏D.萃取解析:选B蒸馏指根据液体沸点的不同分离两种或多种互溶的液体混合物;升华是指固态物质受热直接变成气态物质,气态物质遇冷凝华为固态物质;干馏是指煤等在隔绝空气的条件下加强热发生一系列化学变化的过程;萃取是指用萃取剂将一种物质从其溶液中提取出来的过程;由题中所述操作及现象可知,该操作方法为升华。
2.(2016·北京高考)下列中草药煎制步骤中,属于过滤操作的是()解析:选C冷水浸泡中草药,使草药软化,便于熬制,不是过滤;加热煎制,主要是使草药的成分析出,不是过滤;把药渣去除,保留液体,是过滤的操作;灌装保存,只是把草药转移到容器中保存,不是过滤。
3.如图所示的分离混合物时常用的仪器,从左至右,对应的混合物分离操作方法正确的是()A.蒸馏、分液、蒸发、过滤B.蒸发、过滤、蒸馏、分液C.蒸馏、过滤、蒸发、分液D.蒸发、分液、蒸馏、过滤解析:选A蒸馏烧瓶用于蒸馏操作;分液漏斗用于分液操作;蒸发皿用于蒸发操作;普通漏斗用于过滤操作。
4.(2018·全国卷Ⅰ)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是()解析:选D A是生成乙酸乙酯的操作,B是收集乙酸乙酯的操作,C是分离乙酸乙酯的操作。
D是蒸发操作,在生成和纯化乙酸乙酯的实验过程中未涉及。
5.下列实验操作能达到相应实验目的的是()解析:选B向FeCl3、CuCl2的混合溶液中加入足量铁粉,FeCl3会和Fe反应生成FeCl2,A项不能达到实验目的;Br2和NaOH溶液反应生成易溶于水的NaBr和NaBrO,充分振荡、静置、分液可以除去杂质Br2,B项能达到实验目的;KNO3的溶解度随温度升高变化较大,而NaCl的溶解度受温度影响不大,要提纯KNO3,将含有少量NaCl杂质的KNO3固体溶于水,蒸发浓缩、冷却结晶,然后过滤即可得较纯净的KNO3,C项不能达到实验目的;滤液中含有过量的NaOH溶液,向滤液中加入适量盐酸后会有NaCl生成,D项不能达到实验目的。
6.实验室按照如图操作程序提纯某种物质,下列分析一定正确的是()A.操作Ⅰ一定是过滤,其目的是将固液分离B.可以提纯含少量氧化铁杂质的氧化铝C.可以提纯含少量氯化钠杂质的硝酸钾D.可以提纯含少量碘杂质的氯化钠解析:选C试样的溶解性未知,操作Ⅰ可以是过滤,也可以是溶解,A项错误;提纯含少量氧化铁杂质的氧化铝,应向试样中加入NaOH 溶液,B 项错误;提纯含少量氯化钠杂质的硝酸钾时应使用重结晶法:先向试样中加入适量的热水制成饱和溶液,然后冷却结晶、过滤即得较纯的KNO 3,其中操作Ⅰ是溶解,操作Ⅱ是结晶,操作Ⅲ是过滤,C 项正确;提纯含少量碘杂质的氯化钠时一般使用加热法,使I 2升华而除去,若按图示操作则是萃取分液法,除加水外,还应加入萃取剂,故D 项错误。
7.下列有关实验装置进行的相应实验,能达到实验目的的是()A .利用图1装置可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体B .利用图2装置可分离石油,得到汽油、煤油和柴油等各种馏分C .利用图3装置可分离CH 3CH 2OH 和CH 3COOC 2H 5D .利用图4和图1可进行粗盐提纯解析:选D 加热FeCl 3溶液,促进盐类水解,直接蒸干得到的是Fe(OH)3或Fe 2O 3,A 项错误;石油蒸馏时,温度计的水银球应放在蒸馏烧瓶的支管口处,B 项错误;乙醇和乙酸乙酯互溶,不能用分液法分离,C 项错误。
8.用下列装置进行相应实验,能达到实验目的的是( )解析:选B NH 4Cl 在加热条件下易分解,因此不能通过加热蒸干NH 4Cl 饱和溶液的方法制备NH 4Cl 晶体,A 项错误;CCl 4的密度比水的大,有机层在下层,B 项正确;盐酸易挥发,生成的CO 2中含有HCl 和水蒸气,C 项错误;Cl 2和水反应生成的HCl 会与NaHCO 3溶液反应,从而使Cl2被大量消耗,应通过饱和食盐水除去Cl2中的HCl,D项错误。
9.用如图所示的实验装置,选择适当的试剂B并进行如下实验,可以达到目的的是()A.试剂B为浓硫酸,除去CO2中混有的少量SO2气体B.试剂B为饱和食盐水,除去氯气中混有的少量氯化氢气体C.试剂B为水,收集NO、CO等难溶于水的气体D.试剂B为新制氢氧化铜悬浊液,检验空气中是否含有甲醛解析:选B A项,二氧化硫和浓硫酸不反应,所以不能达到洗气的目的,错误;B项,氯气和水的反应是可逆反应,所以食盐水中含有氯离子能抑制氯气的溶解,氯化氢极易溶于水,从而能达到洗气的目的,正确;C项,收集难溶于水的气体采用排水集气法收集,集气瓶中应该“短管进气”,错误;D项,甲醛和新制氢氧化铜悬浊液反应需要加热且应在碱性条件下,该反应未加热,错误。
10.(2017·天津高考)以下实验设计能达到实验目的的是()解析:选D除去NaHCO3固体中的Na2CO3,可加水溶解制成饱和溶液,通入足量CO2气体,结晶,过滤,加热至恒重得到的是Na2CO3,A项错误;制备无水AlCl3时,应将AlCl3溶液在HCl氛围中加热蒸发,B项错误;重结晶提纯苯甲酸时,应将粗品制成其热饱和溶液,趁热过滤,再冷却结晶,C项错误;鉴别NaBr和KI溶液,分别加入新制氯水后,用CCl4萃取,Br2的CCl4溶液呈橙色,I2的CCl4溶液呈紫红色,D项正确。
11.下列除杂方法正确的是()A.SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去B.NH4Cl固体中混有少量的单质I2,可用加热方法将I2除去C.CO2中含有SO2杂质,可以通过盛有饱和Na2CO3溶液的洗气瓶除去D.NaHCO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤除去解析:选D A项,SiO2和Al2O3都可以与NaOH溶液发生反应,因此SiO2中含Al2O3杂质不能加入足量NaOH溶液然后过滤除去,错误;B项,NH4Cl固体加热容易发生分解反应产生氨气和氯化氢,二者遇冷会重新化合形成NH4Cl,因此不能用加热方法将NH4Cl 固体中的I2除去,错误;C项,CO2、SO2都可以与饱和Na2CO3溶液发生反应,因此不能用饱和Na2CO3溶液除去CO2中含有的SO2杂质,错误;D项,NaHCO3溶液中含有Na2SiO3杂质,由于NaHCO3与CO2不能发生反应,而物质的酸性:碳酸>硅酸,可以通入足量的CO2,发生反应:Na2SiO3+2H2O+2CO2===2NaHCO3+H2SiO3↓,然后过滤除去H2SiO3,正确。
12.下列实验中,所采取的分离方法与对应原理都正确的是()解析:选B A项,应用溶解过滤的方法,错误;C项中原理是KNO3的溶解度受温度影响大,而NaCl的溶解度几乎不受温度影响,错误;D项中两者互溶,不能用分液的方法,错误。
13.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法错误的是()A.步骤①需要过滤装置B.步骤②需要用到分液漏斗C.步骤③需要用到坩埚D.步骤④需要蒸馏装置解析:选C步骤①需要分离液体和不溶性物质,需要过滤装置,故A项正确;步骤②需要分离水层和有机层,需要用到分液漏斗,故B项正确;步骤③需要蒸发溶液获得固体溶质,进行蒸发操作,不需要坩埚,故C项错误;步骤④需要蒸馏分离甲苯和甲醇,故D项正确。
14.如图表示从原混合物中分离出X 的两种方案,下列说法中不合理的是( )A .若含X 的混合物为溴水,可通过方案Ⅰ进行分离,加入试剂为CCl 4,充分振荡后液体分层,下层为X 的CCl 4溶液B .若含X 的混合物为BaSO 4、BaSO 3的混合物,可通过方案Ⅱ进行分离,加入试剂为稀硝酸,X 为BaSO 4C .若含X 的混合物为乙醇和乙酸乙酯的混合物,可通过方案Ⅰ进行分离,加入试剂为饱和NaOH 溶液,残留液中含有乙酸钠D .若含X 的混合物为Fe 、Al ,可通过方案Ⅱ进行分离,加入的试剂是过量的NaOH 溶液,1 mol X 与足量氯气完全反应时,转移3 mol 电子解析:选C 溴易溶于四氯化碳,微溶于水,四氯化碳的密度比水大,分液时在混合液的下层,该方法合理,故A 不符合题意;BaSO 3被稀硝酸氧化成BaSO 4,然后通过过滤得到BaSO 4,该方法合理,故B 不符合题意;分离乙醇和乙酸乙酯时,应该选用饱和Na 2CO 3溶液,否则乙酸乙酯与NaOH 溶液反应,该方法不合理,故C 符合题意;Al 可与NaOH 溶液反应,故最后得到的X 为铁,铁与氯气反应生成氯化铁,1 mol 铁与足量氯气完全反应时,转移3 mol 电子,该描述合理,故D 不符合题意。
15.化学是一门以实验为基础的科学。
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
(2)为除去粗盐中的MgCl 2、CaCl 2、Na 2SO 4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐――→Ⅰ――→Ⅱ――→氢氧化钠溶液Ⅲ――→Ⅳ――→过滤Ⅴ滤液――→稀盐酸Ⅵ――→蒸发、结晶、烘干Ⅶ精盐①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是______________________________________。
解析:(1)A中应长管进短管出;B中NH3不溶于CCl4,不会引起倒吸,且上层的水会吸收NH3,防止NH3逸出;C中石油分馏中,温度计的水银球应在蒸馏烧瓶的支管口处;D 中由于蒸出的乙酸乙酯中含有乙醇、乙酸,它们均易溶于水,当导管口插入液面以下时易发生倒吸,饱和食盐水应改为饱和Na2CO3溶液。
(2)除去粗盐中的可溶性杂质,实际上就是除去Mg2+(用NaOH溶液)、Ca2+(用Na2CO3溶液)、SO2-4(用BaCl2溶液),多余的Ba2+用Na2CO3溶液除去,故BaCl2溶液加在Na2CO3溶液之前,沉淀通过过滤除去,滤液中多余的OH-和CO2-3用稀盐酸除去。
过滤时用到的主要仪器:普通漏斗、玻璃棒、烧杯、铁架台等,题目中要求是玻璃仪器,填前三种。
答案:(1)B(2)①溶解②有影响③普通漏斗、玻璃棒、烧杯16.氢溴酸在医药和石化工业上有广泛用途。
如图是模拟工业制备氢溴酸粗品并精制的流程:根据上述流程回答下列问题:(1)混合①中发生反应的化学方程式为___________________________________。
