氢的同位素光谱
氘光谱实验报告

班级:电科142
姓名:薛国轩
学号:14461227
一、实验背景 二、实验目的 三、实验原理 四、实验仪器 五、实验内容
六、实验结论
氘??
实验背景
氘为氢的一种稳定形态同位素,也被称为重氢, 光谱线系的规律与原子结构有内在的联系, 元素符号一般为 D或2H。她的原子核由一颗质 原子光谱是研究原子结构的一种重要方法。 1885 子和一颗中字组成。在大自然的含量约为一般 年巴尔末发现了氢原子光谱规律,提出了巴尔末 氢的 7000 分之一,用于热核反应,被誉为“未 公式。1932年尤里根据里德伯常数随原子核质量 来的天然燃料”。
• 2、实验测量 • 连好线,右边是氘灯和电控箱,左边是光栅光谱仪,其中,
电控箱包括电源、信号放大、控制系统和光源系统。确认所 有连线正确连接后,打开电控箱的开关,在运行仪器操作系 统,分别进行氘光谱、钨灯光谱的测量。
• 调节反向电压的大小由小到大,观察光谱有没有出现失真现
象,如果出现失真则适当改变参数,并且降低反向电压的大 小。
实验结论
实验分析
氘光灯: 电压增大,波长不变,测量值增大 相同电压下,测量值随着波长边长而增大
钨光灯:
电压增大,波长不变,测量值增大
相同电压下,测量值随着波长变长而减小
谢谢观赏!!!
不同而变化的规律,对重氢赖曼系进行摄谱分析, 发现了氘。
实验目的
•掌握定量测定氘光谱的方法 •熟悉多功能光栅光谱仪的光学系统、
电子系统和软件系统
实验原理
• 在一块透明的光学玻璃平板上刻有大量的互相平行、
等宽等间距的刻痕,构成光栅。光栅课分为透射光栅, 平面反射光栅等。本实验ψk=Kλ
Ψk指第k级衍射角,(a+b)指的是反射光部分的速度 与漫反射部分的宽度,称为光栅常数,λ表示待测的 波长
光学多道和氢氘同位素光谱

光学多道和氢氘同位素光谱【摘要】:本实验主要利用光学多道分析仪研究氢氘光谱并得到氢氘光谱的能级图。
使用已知波长的氦光谱进行定标测量了氢光谱,并在此基础上测量氢氘同位素光谱,修正获得了氢氘光谱的波长值;利用这些测得值计算出了氢氘的里德伯常量分别为H R =109811.87cm -1,= 109840.39cm -1。
利用氢氘光谱的波长差计算得出了电子与质子质量之比为=1906.84。
关键词:光学多道分析仪、氢氘光谱,CCD ,光电倍增管一、实验引言:光谱是不同强度的电磁辐射按照波长的有序排列。
光谱学是研究各种物质的光谱特征,并根据这些特征研究物质结构、物质成分和物质与电磁辐射的相互作用,以及光谱产生和测量方法的科学。
光谱学在物理学各分支学科中都占有重要地位,而且在很多方面有着广泛的应用。
在光谱学史上,氢光谱的实验和理论研究都占有特别重要的地位。
1885年,巴耳末(J.J.Balmer )发现了可见光区氢光谱线波长的规律。
1892年,尤雷(H.C.Urey )等发现氢(H)的同位素氘(D)的光谱,氢氘原子对应的谱线波长存在“同位素位移”。
本实验利用光学多道分析仪,从巴尔末公式出发研究氢氘光谱,了解其谱线特点, 并学习光学多道仪的使用方法及基本的光谱学技术。
二、实验原理:(一、)在原子体系中,原子的能量状态是量子化的。
用1E 和2E 表示不同能级的能量,ε表示跃迁发出光子的能量,h 表示波尔兹曼常量,ν表示光子的频率,对于原子从低能级到高能级的跃迁我们有:21h E E εν==-,其中21E E hν-=(1) 由于原子能级的分立,频率ν也为分立值,在分光仪上表现为一条条分立的“线性光谱”,这些频率由巴耳末公式确定: H 原子:2212111H H R n n λ⎛⎫=- ⎪⎝⎭ (2) 其中1n 和2n 为轨道量子数,H R 为氢原子的里德伯常数。
当1n =2,2n =3,4,5……时,公式(2)对应氢原子巴耳末系。
氘原子光谱△
氢、氘原子光谱18世纪中叶有人已发现炽热气体的火焰发出的光谱是线状光谱,随后发现各种元素的受激原子发出的发射光谱或白光被原子气吸收时产生的吸收光谱也都是线状光谱。
到了19世纪末,分辩本领较大的衍射光栅出现以后,基尔霍夫首先指出一定元素的原子只能发射或吸收一些该元素特定频率的谱线。
一定元素的原子光谱线的排列具有明显的规律性,它反映了原子及其电子壳层结构的特性。
因此研究原子光谱的规律是了解原子结构的重要手段之一。
氢原子光谱是在所有原子光谱中最简单、最基本的光谱。
它有5个相互独立的光谱线系,即赖曼(Lyman)系、巴尔末(Balmer)系、帕邢(Paschen)系、布拉开(Blackett)和普丰特系。
每个线系中,各条谱线的强度和相邻谱线的间隔都向短波长方向有规律地递减。
在氢、氘原子光谱实验中,可以观察到由同位素效应引起的氢、氘原子光谱的巴尔末系前6条氢谱线的波长,并采用适当的辅助手段和个别常量,就能测得与公认值符合得很好的许多基本物理;如氢的巴尔末系的线系限,氢的里德伯常数,电离电势和电子的荷质比e/m等等,本实验还为我们提供了一些微观量的测定方法。
拍摄氢、氘原子光谱可以使用光栅光谱仪,它是光谱实验常用仪器之一。
应在了解其基本结构、工作原理的基础上,学会正确的使用方法。
【预习提要】氢原子光谱是最简单的原子光谱,用中等色散率的摄谱仪拍摄的底片上谱线的排列具有明显的规律性。
氘是氢的同位素,由于两者原子核质量的差异在光谱上导致它们的巴尔末系的相应各条谱线产生位移——同位素效应。
本实验根据同位素效应验证氘核质量2倍于氢核质量,从中了解原子光谱,反映原子结构和运动的特性。
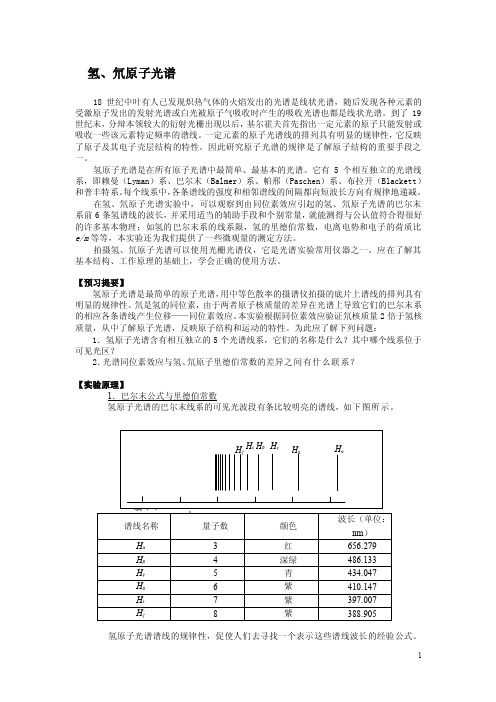
为此应了解下列问题:1.氢原子光谱含有相互独立的5个光谱线系,它们的名称是什么?其中哪个线系位于可见光区?2.光谱同位素效应与氢、氘原子里德伯常数的差异之间有什么联系?【实验原理】1.巴尔末公式与里德伯常数氢原子光谱的巴尔末线系的可见光波段有条比较明亮的谱线,如下图所示。
实验六 原子光谱实验—氢氘光谱的测量.

实验六 原子光谱实验—氢氘光谱的测量一、 实验目的(1)熟悉光栅光谱仪的基本原理,了解它的性能和使用方法。
(2)熟悉测量氢-氘和其他原子光谱的方法。
(3)计算氢和氘原子核的质量比。
(4)了解并观察钠、汞原子的主要光谱线。
二、 实验原理(1) 测量公式的导出:根据玻尔(Bohr )原子理论,一个电子绕正电荷为Ze 、质量为M z 的原子核作圆周运动时,其能量是量子化的,可表示为2Z 22220242n1R hcZ n 1h )4(Z e 2E -=πεμπ-= (6-0) 其中ZZ M m mM +=μ 为核与电子的折合质量,ZZ 32042Z Z 32042Z M m 11R M m 11c h )4(me 2M m M c h )4(me 2R +=+πεπ=+πεπ=∞ 称为里德堡(Rydberg )常数,ε0为真空介电常数,m 为电子质量,h 和c 分别为普朗克常数和真空中的光速,n=1,2,3…,称为能级量子数,而常数1-32042m 10973731ch )4(me 2R =πεπ=∞ 为忽略原子核运动时(即认为原子核质量M Z 趋于无穷)的里德堡常数。
当原子从高能级向低能级跃迁时,便辐射出光子,并满足能量守恒:)m1n 1(hcZ R h 222Z --=ν 其中ν为光子频率,n 为上能级量子数,m 为下能级量子数。
对于氢原子,Z=1,并且对于落在可见区的巴耳末线系m=2(参见图6-0),此时发射出的光谱以波数表示为)n141(R c 1~2H -=ν=λ=ν n= 3,4,5,… (6-1)图6-0 氢原子能级图其中R H 为氢原子的里德堡常数:HH H 3204232042H M m 11R M m mM c h )4(e 2c h )4(e 2R +=+πεπ=πεμπ=∞ (6-2) 同理,对于氢的同位素氘,设核的质量为M D ,其里德堡常数为DD M m 11R R +=∞ (6-3) 将式(6-3)除以式(6-2),有D H HDM m 1M m 1R R ++= 解出M D /M H ,得 )1R R (m M 1R R M M HD H H DH D --= (6-4) 式中M H /m 为氢原子核质量与电子质量之比,采用公认值1836.5。
光学多道实验报告

光学多道与氢、氘同位素光谱武晓忠201211141046(北京师范大学2012级非师范班)指导教师:何琛娟实验时间:2014.9.16摘要本实验通过光学多道分析仪来研究了H、D的光谱,观察并了解了H、D原子谱线的特征。
H和D的光谱非常相似,但是二者的巴尔末系的同一能级的光谱之间仍有波长差,用光电倍增管可以测量出这个差值。
通过实验我们也学习了光学多道分析仪的使用和基本光谱学技术关键词光学多道H、D光谱1、引言光谱是不同强度的电磁辐射按照波长的有序排列,而原子光谱是由原子中的电子在能量变化时所发射或吸收的一系列波长的光所组成的光谱。
由于氘原子和氢原子核外都只有一个电子,只是里德伯常量有一些差异,因此对应的谱线波长稍有差别。
我们可以在实验中通过测出对应的谱线λ和Δλ来得到二者的里德伯常量和电子与质子的质量比。
2、原理2.1 物理原理可知原子能量状态为一系列的分立值,有一系列的能级,并且当高能级的原子跃迁到低能级的时候会发射光子。
设光子能量为ε,频率为ν,高能级为E2,低能级为E1,则有:ε= hν=E2-E1 (1)从而有ν=E2−E1(2)h由于能量状态的分立,发射光子的频率自然也分立,这些光会在分光仪上表现为分立的光谱线,也就是“线状光谱”。
根据巴尔末公式,对氢原子有1λH =R H(1n12- 1n22) (3)R H为氢原子的里德伯常量。
当n1=2, n2=3,4,5,····时,光谱是巴尔末系,在可见光区域。
对氘原子,同样有1λD =R D(1n12- 1n22)(4)R D是氘原子的里德伯常量,当n1=2, n2=3,4,5,····时,光谱是巴尔末系。
则Δλ =λH-λD= (1R H - 1R D) (122- 1n2),n=2,3,4, (5)若忽略质子和中子的细微差别,我们可以得到H、D的里德伯常量关系为:R H=R∞m pm p+m e , R D=R∞2m p2m p+m e(6)又知R∞=109737.31cm−1,它是原子核质量为无穷大时候的里德伯常量则1 R H =2(m p+m e2m p+m e)1R D(7)1 R H - 1R D=m e2m p+m e1R DΔλ=m e2m p+m e [1R D∗1/(122- 1n2)]=m e2m p+m eλD(8)由于m e≪m p,则ΔλλD ≈m e2m p(9)因此只要在实验中测出对应谱线λ和Δλ即可得电子和质子质量比。
金刚石压腔结合拉曼光谱技术进行氢同位素分馏的实验研究

2 0 1 1年 3月
光
谱
学
与
光
谱
分
析
S e t o c p n p cr lAn l ss p c r s o y a d S e t a a y i
V 1 3 , . ,p 9 —9 o . 1 No 3 p 6 16 5 M ac r h,2 1 0l
金 刚 石 压 腔 结 合 拉 曼 光 谱 技 术 进 行 氢 同位 素 分 馏 的 实 验 研 究
王世 霞 , 海 飞 郑
北 京 大 学 造 山 带 与 地 壳演 化教 育 部 重 点 实 验 室 , 京 1 0 7 北 081
摘 要 应用水热金 刚石压腔结合拉曼光谱技术来进行 石膏和重水 间稳 定 同位 素分馏 的实验研究 。氢 同位 素 D与 H 的 质 量 差 百 分 比是 所 有 稳 定 同 位 素 里 最 大 的 ,由质 量 引起 的分 馏 更 容 易 发 生 , 容 易 在 实 验 中观 更 测; 石膏是浅部地壳重要的含水矿物 , 它与重水之 间的同位 素分馏效应对 矿物一 水体系 的同位 素平衡分馏研
1 1 实 验 装 置 .
1 实验 方 法
实 验 采 用 的高 温 高 压 装 置 ( 1 , 似 于 Ma- e 金 刚 图 )类 oB l l
石 压 腔 。
压 腔 的主 体 部 分 由一 对 金 刚 石 压砧 和 垫 片 组 成 。压 砧 的
题使得不 同实验结果闸存在显著差异 。 物相流体 问的氢 同 矿
第 3 卷 l
两物相问的重轻同位素基 团的拉曼谱峰强度 比值之商来表征
系列 的热力学 、动力学数据 已经广泛地应用 于成岩成矿 等地
氢氘光谱

实验五 氘原子光谱一.实验目的1.了解造成光谱的同位素移位的原因。
2.了解利用氢原子光谱的同位素移位测量质子与电子质量比的原理。
3.学会使用多功能光栅光谱仪。
二.实验器材氢氘灯 多功能光栅光谱仪 三.实验原理同位素是英国人索迪于1911年开始使用的。
1919年英国物理学家阿斯顿(F. W. Aston )制成了用来分离不同质量并测定粒子质量的粒子质谱仪,把研究同位素的方法提高了一大步。
阿斯顿利用质谱仪在71种元素之中,陆续找到了202种同位素之多,这为我们认识同位素,开始积累了大量资料。
为了寻找氢的同位素,人们前后用了十几年的时间,而没有得出肯定的结果。
1931年初,有人从理论上推导,认为应该有质量数为2的氢同位素存在,并且估算出2H:1H=1:4500的比例。
1931年年底,美国哥伦比亚大学的尤里教授和他的助手们,把四升液态氢在三相点14°K 下缓慢蒸发,最后只剩下几立方毫米液氢,然后用光谱分析。
结果在氢原子光谱的谱线中,得到一些新谱线,它们的位置正好与预期的质量为2的氢谱线一致,从而发现了重氢(deuterium ),即氘,符号D 。
自然界中许多元素都存在同位素,它们的原子核具有相同数量的质子,但中子数不同,在谱线上,同位素对应的谱线会发生移位,称同位素移位。
移位大小与核质量有关:核质量越轻,移位效应越大,因此氢具有最大的同位素移位。
据玻尔理论,原子的能量是量子化的,即具有分立的能级;当电子从高能级跃迁到低能级时,原子释放出能量,并以电磁波形式辐射。
氢与类氢原子的巴耳末系对应光谱线波数为)121()1()4(22230442nm m c h Z e m z e e -+=πεπσ则类氢原子的里德伯常数可写成()⎪⎪⎭⎫ ⎝⎛+=z e e Z mm c h Z e m R 1142320242πεπ∞→z m 即假定原子核不动,则有()ch z e m R e 32024242πεπ=∞因此有ze Z m m R R +=∞1R Z 随原子核质量m z 变化,对于不同元素或同一元素的不同同位素R Z 值不同,m z 对R z 影响很小,因此氢和它的同位素的相对波数很接近,在光谱上开成很难分辨的双线或多线。
同位素标记的实验技术原理

同位素标记的实验技术原理同位素标记的实验技术是一种利用同位素(不同质子数但具有相同中子数的原子)进行标记的实验技术。
同位素标记的原理是通过在研究物质中引入特定同位素的方法,利用同位素标记分子或化合物来研究它们在生化反应中的运动、转化和相互作用等过程。
同位素是一种具有相同的化学性质但具有不同原子质量的原子。
例如,氢的同位素有氘和氚;碳的同位素有碳-12、碳-13和碳-14等。
同位素标记的实验技术通过使用具有特定同位素的化合物或分子,来跟踪和测量这些标记物在生物学或化学实验过程中的变化。
同位素标记技术可以通过两种主要方式实现:稳定同位素标记和放射性同位素标记。
稳定同位素标记是指使用具有比较低的原子放射性的同位素进行标记。
常用的稳定同位素包括氢-2(氘)、氢-3(氚)、碳-13、氮-15和氧-18等。
这些同位素在分子或化合物中取代普通同位素,由于原子质量较大或较重,可以通过质量光谱分析或质谱法进行定量测定。
稳定同位素标记技术常用于研究代谢动力学、药物代谢、蛋白质和核酸合成等过程。
例如,利用稳定同位素标记葡萄糖可以跟踪其在体内的代谢途径,研究糖尿病等疾病的发病机制。
稳定同位素标记还广泛应用于食物科学、环境科学等领域的研究。
放射性同位素标记是指使用具有较高放射性的同位素进行标记。
放射性同位素标记技术常用的同位素有碘-131、碳-14、氚和钴-60等。
放射性同位素通过放射性衰变释放出高能射线,可以通过辐射测量仪器或放射自显影等方法进行定量测量。
放射性同位素标记技术主要应用于核医学、肿瘤学、生物学和环境科学等领域。
例如,利用放射性同位素碘-131可以进行甲状腺扫描和治疗;利用放射性同位素碳-14测定化合物的年龄,进行地质学和考古学的研究。
同位素标记技术的关键是选择合适的同位素和标记方法。
同位素选择应根据实验需要确定,例如稳定同位素标记常用质量较大的同位素,而放射性同位素标记则需要考虑放射性安全和实验条件。
对于稳定同位素标记,标记方法主要有直接标记和间接标记两种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表面张力的存在形成了一系列日常生活中的现象。
例如﹕空气中的小液滴往往呈圆球形状,截面非常小的细管內的毛细现象﹑肥皂泡现象﹑液体与固体之间的浸润与非浸润现象等。
表面张力与液体的性质(成分、杂质)、温度和相邻物质的化学性质有关。
液体表面张力的测定方法分静力学法和动力学法。
静力学法有焦利氏秤、毛细管上升法、白金环法、Wilhelmy 盘法、旋滴法、悬滴法、滴体积法、最大气泡压力法等; 动力学法有震荡射流法、毛细管波法等。
表面张力在工程技术、生物学、医学、微循环系统以及日常生活中,均有着广泛的应用。
