高考热点常考点选择题——同位素、原子结构
2022届高考化学(人教版新课标)一轮复习配套题库:第五章 第一讲 原子结构

第五章物质结构元素周期律第一讲原子结构一、选择题1.据新闻网报道:科学家首次合成第117号元素,被美国《时代》周刊评比为当Up和294117Up 年十大科学发觉。
假如第117号元素符号临时定为Up,下列关于293117的说法中正确的是()。
A.293117Up和294117Up是两种元素B.293117Up和294117Up互为同位素C.293117Up和294117Up质子数不同、中子数相同D.293117Up和294117Up质量数相同、电子数不同解析293117Up和294117Up是同种元素的两种核素,元素符号左上角的数字表示该核素的质量数,左下角的数字表示该核素的质子数,它们的质子数相同,中子数不同,互为同位素,A选项错误,B选项正确;293117Up和294117Up的质子数、电子数都是117,而质量数分别为293、294,中子数分别为176、177,C、D选项均错误。
答案 B2.下列叙述错误的是()。
A.13C和14C属于同一种元素,它们互为同位素B.1H和2H是不同的核素,它们的质子数相等C.14C和14N的质量数相等,它们的中子数不等D.6Li和7Li的电子数相等,中子数也相等解析本题主要考查同位素、核素以及同位素原子中各种微粒的数量关系。
A 项中13C和14C质子数相同,互为同位素;B项中1H和2H是氢元素的两种不同的核素,质子数均为1;C项中14C和14N质量数相同,但是中子数不等;D项中的6Li与7Li为锂元素的两种不同的核素,它们的质子数相等,核外电子数均为3,中子数不等,分别为3和4。
答案 D3.近年来我国政府强化了对稀土元素原料的出口管制,引起了美、日等国家的高度关注与不满。
所谓“稀土元素”是指镧系元素及第五周期ⅢB族的钇(39Y),它们被称为“工业味精”。
它们在军工生产、高科技领域中有极为重要的作用,下列有关“稀土元素”的说法正确的是()。
A.它们的原子核外均有5个电子层B.它们的原子最外层均含有3个电子C.它们均是金属元素D.76Y、80Y中子数不同,化学性质不同解析镧系元素属于第六周期,而周期序数等于电子层数,A错;过渡元素原子的最外层电子均只有1~2个,B错;76Y、80Y互为同位素,化学性质几乎相同,D错。
高三化学一轮复习——原子结构与核素、同位素

高三化学一轮复习——原子结构与核素、同位素知识梳理1.原子结构(1)原子的构成(2)原子内的等量关系①质量数(A)=质子数(Z)+中子数(N);②质子数=原子序数=核电荷数=核外电子数;图示:③阳离子:质子数=核外电子数+电荷数;④阴离子:质子数=核外电子数-电荷数。
(3)原子符号2.元素、核素、同位素(1)“三素”概念的辨析:(2)几种重要的核素及其应用U21H31H18 8O 核素23592用途核燃料用于考古断代制氢弹示踪原子[名师点拨]①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.特征电子数粒子(1)2e-微粒H2←H-←→Li+→Be2+(2)10e-微粒(3)18e-微粒[考在课外]教材延伸判断正误(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(√)(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同。
(√)(3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化。
(×)(4)中子数不同而质子数相同的微粒一定互为同位素。
(×)(5)通过化学变化可以实现16O与18O间的相互转化。
(×)(6)3517Cl与3717Cl得电子能力几乎相同。
(√)(7)21H+核外电子数为2。
(×)(8)两种粒子,若核外电子排布完全相同,则其化学性质一定相同。
(×)(9)13C与C60互为同素异形体。
(×)(10)所有的原子中都含有质子和中子。
(×)拓展应用(1)①11H、21H、31H分别是氢元素的三种________,它们互称为________。
②5626Fe2+的质子数为________,中子数为________,核外电子数为________。
高考化学一轮总复习第5章考点一原子结构核素和同位素微考点1元素核素和同位素的概念辨析(含答案)

高考化学一轮总复习:微考点1 元素、核素和同位素的概念辨析(2024·河北衡水高三检测)稀土元素钕(140 60Nd)是制造导弹合金材料的重要元素。
下列说法正确的是( B )A.140 60Nd和142 60Nd是不同核素,互为同素异形体B.140 60Nd和142 60Nd的核外电子排布相同,化学性质几乎相同C.140 60Nd原子的中子数与质子数之差为80D.14 g钕元素含有6 mol电子[解析]140 60Nd和142 60Nd是同种元素的不同核素,互为同位素,A错误;140 60Nd和142 60Nd的核外电子数均为60,核外电子排布相同,化学性质几乎相同,B正确;140 60Nd原子的中子数为80、质子数为60,二者之差为20,C错误;元素的相对原子质量是该元素的各种天然同位素的相对原子质量和所占的物质的量分数算出的平均值,14 g钕元素对应的钕原子的物质的量并非0.1 mol,含有的电子也不是6 mol,D错误。
【对点训练】1.(2024·郴州模拟)铋(Bi)在医药方面有重要应用,下列关于209 83Bi和210 83Bi的说法正确的是( C )A.两者互为同素异形体B.209 83Bi转化成210 83Bi是化学变化C.209 83Bi和210 83Bi的物理性质往往不同D.两者分别含有126和127个质子[解析]209 83Bi和210 83Bi质子数相同,中子数不同,二者互为同位素,A错误;209 83Bi转化成21083Bi中子数发生了变化,没有新物质的生成,不属于化学变化,B错误;同位素的化学性质相似,物理性质如放射性等有较大的差别,C正确;209 83Bi的中子数为209-83=126,210 83Bi 的中子数为210-83=127,两者的质子数都是83,中子数分别为126、127,D错误。
2.(2024·陕西西安模拟)据科学家推测,月球的土壤吸附着百万吨的32He,在地球上氦元素主要以42He的形式存在,下列有关32He和42He的说法正确的是( D )A.属于同一种核素B.质量数相同C.32He与42He互为同素异形体D.32He和42He互为同位素[解析]两者的中子数不同,质量数不同,属于不同的核素,故A错误;32He的质量数是3、42He的质量数是4,二者质量数不同,故B错误;32He和42He质子数相同,中子数不同,互为同位素,故C错误,D正确。
2010高考化学热点专题辅导---原子结构.doc
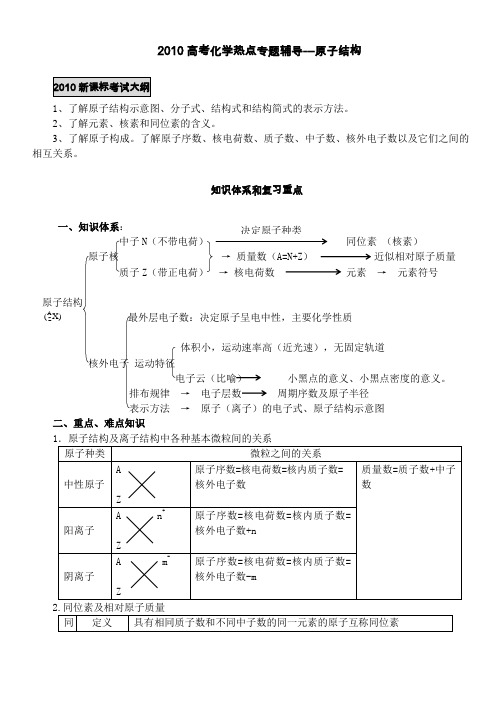
2010高考化学热点专题辅导---原子结构1、了解原子结构示意图、分子式、结构式和结构简式的表示方法。
2、了解元素、核素和同位素的含义。
3、了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
知识体系和复习重点一、知识体系:中子N (不带电荷) 同位素 (核素)原子核 → 质量数(A=N+Z ) 近似相对原子质量质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 最外层电子数:决定原子呈电中性,主要化学性质体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图二、重点、难点知识决定原子种类X)(A Z氯原子,的数目即为该原子的最外层电子数。
如、、、、4.核素与同位素关系(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
(2)同位素:同一元素的不同核素之间的互称。
(3)区别与联系:不同的核素不一定是同位素;同位素一定是不同的核素。
5、短周期元素中具有特殊性排布的原子(1)最外层有一个电子的非金属元素:H。
(2)最外层电子数等于次外层电子数的元素:Be、Ar。
(3)最外层电子数是次外层电子数2、3、4倍的元素:依次是C、O、Ne。
(4)电子总数是最外层电子数2倍的元素:Be。
(5)最外层电子数是电子层数2倍的元素:He、C、S。
(6)最外层电子数是电子层数3倍的元素:O。
(7)次外层电子数是最外层电子数2倍的元素:Li、Si 。
(8)内层电子总数是最外层电子数2倍的元素:Li、P。
(9)电子层数与最外层电子数相等的元素:H、Be、Al。
高考试题分类解析一、考查核素与同位素例1.(07年宁夏理综·9)下列叙述错误的...是A.13C和14C属于同一种元素,它们互为同位素B.1H和2H是不同的核素,它们的质子数相等C.14C和14N的质量数相等,它们的中子数不等D .6Li 和7Li 的电子数相等,中子数也相等解析:同位素是指质子数相同而中子数(或质量数)不同的统一元素的不同核素之间的称谓,故A 选项是正确的;1H 和2H 是同一元素的不同核素,它们的质子数均为1,因此B 选项正确;14C 的中子数为14-6=8,而14N 的中子数为14-7=7,故C 选项正确;6Li 和7Li 互为同位素,它们的中子数不同分别为3和4,因此D 选项错误。
高三鲁科化学一轮复习题库 原子结构 含解析

第五章原子结构与元素周期律第一讲原子结构一、选择题1.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用。
如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。
下列有关说法正确的是() A.34S原子核内中子数为16B.1H162O和1H182O的相对分子质量不同C.13C和15N原子的原子序数相差2D.2H+结合OH-的能力比1H+的更强解析A项中34S的中子数为34-16=18,不正确;B项中H2O的相对分子质量由H和O的质量数决定,两个分子中O的质量数不同,故B项正确;C项中原子序数之差由质子数决定,应该为1,C项不正确;D中2H+和1H+化学性质相同,故D项不正确。
答案 B2.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则(双选) () A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应解析在中学化学中只有氨气的水溶液才显碱性,因为短周期元素甲、乙、丙、丁的原子序数依次增大,所以甲是H,乙是N;甲和丙同主族,因此丙只能是Na,这说明丁属于第三周期,根据丁原子最外层电子数与电子层数相等,所以丁是Al。
同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,所以选项A正确,B不正确,还原性应该是Na>Al>H;Na属于活泼金属,其氧化物Na2O属于离子化合物,C不正确;乙、丙、丁的最高价氧化物对应的水化物分别为HNO3(强酸)、NaOH(强碱)、Al(OH)3(两性氢氧化物),因此选项D也是正确的。
答案AD3.2010年4月,科学家成功合成了一种拥有117个质子的新元素。
科学家用4820Ca轰击249 97Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。
2021届高三化学一轮复习——原子构成 核素 同位素(知识梳理及训练)

2021届高三化学一轮复习——原子构成 核素 同位素核心知识梳理 (一)原子结构1.原子结构模型的演变人类对原子结构的认识是逐渐深入的,每前进一步,都建立在实验研究的基础之上。
科学研究是揭示原子结构奥秘的重要手段。
原子结构模型的演变图如下:①为道尔顿实心球式原子模型;②为汤姆生葡萄干面包式原子模型;③为卢瑟福行星运转式原子模型;④为玻尔轨道式原子模型;⑤为近代量子力学原子模型。
2.构成原子的微粒及作用原子(A ZX )⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧ 质子(Z 个)——决定元素的种类中子[(A -Z )个] 在质子数确定后决定原子种类同位素核外电子(Z 个)——最外层电子数决定元素的化学性质3.微粒之间的关系(1)原子中:质子数(Z )=核电荷数=核外电子数; (2)质量数(A )=质子数(Z )+中子数(N );(3)阳离子的核外电子数=质子数-阳离子所带的电荷数; (4)阴离子的核外电子数=质子数+阴离子所带的电荷数。
4.质量数与原子质量、相对原子质量、摩尔质量在数值上的关系原子质量(g)m(126C)×112=相对原子质量=摩尔质量(g·mol-1)≈质量数5.表示原子结构的“两种方式”(1)A Z X着重描述原子核的结构。
例:(2)原子结构示意图着重描述核外电子排布情况。
例:(二)核素同位素1.元素、核素、同位素之间的关系2.同位素的“六同三不同”3.几种重要的核素(三)同素异形体与同素异形现象1.同素异形现象:同一种元素形成几种不同单质的现象。
2.同素异形体:由同一种元素形成不同单质,这些单质互称为同素异形体。
3.几种常见同素异形体:碳的同素异形体:金刚石、石墨、足球烯(C60)等;氧的同素异形体:氧气、臭氧;磷的同素异形体:白磷、红磷。
问题思考现有下列9种微粒:11H、21H、136C、146C、147N、5626Fe2+、5626Fe3+、168O2、168O3。
高考化学专题复习《物质结构与元素周期律》考点总结

高考化学专题复习《物质结构与元素周期律》考点总结高频考点一 原子结构与核外电子排布 1.原子结构 (1)原子的构成A ZX ⎩⎪⎪⎨⎪⎪⎧原子核⎩⎨⎧质子:Z 个⎩⎪⎨⎪⎧ 每个质子带一个单位正电荷相对质量约为1中子:A -Z 个⎩⎪⎨⎪⎧ 中子不带电相对质量约为1核外电子:Z 个⎩⎪⎨⎪⎧围绕原子核做高速运动每个电子带一个单位负电荷相对质量为一个质子中子的11 836(2)核素(原子)的表示及其数量关系 ①表示:表示质子数为Z 、质量数为A 、中子数为A-Z 的核素原子。
(3)阴、阳离子中的数量关系 ①质量数=质子数+中子数。
②阴离子::核外电子数=Z +n 。
阳离子::核外电子数=Z -n 。
(4)符号 b a X +ce d+中各数字的含义2.元素、核素、同位素 (1)“三素”关系同位素的“六同三不同”(2)几种重要的核素及其应用核素 235 92U14 6C 21H 31H 18 8O 用途核燃料 用于考古断代 制氢弹 示踪原子(3)H ⎩⎪⎨⎪⎧11H :名称为氕,不含中子21H :用字母D 表示,名称为氘或重氢31H :用字母T 表示,名称为氚或超重氢3.核外电子排布 (1)核外电子排布规律(2)原子结构示意图【典例剖析】【例1】(2022•山东卷)138O 、158O 的半衰期很短,自然界中不能稳定存在。
人工合成反应如下:16313a828b O+He O+X→;16315m828n O+He O+Y→。
下列说法正确的是( )A .X 的中子数为2B .X 、Y 互为同位素C .138O 、158O 可用作示踪原子研究化学反应历程D .自然界不存在138O 2、158O 2分子是因其化学键不稳定【答案】B【解析】根据质量守恒可知,结合题中的人工合成反应,推知X 微粒为62He ,Y 微粒为42He 。
A 项,X 微粒为62He ,根据质量数等于质子数加中子数可知,该微粒的中子数为4,A 错误;B 项,X 微粒为62He ,Y 微粒为42He ,二者具有相同的质子数而不同的中子数的原子,故互为同位素,B 正确;C 项,.由题干信息可知,138O 与158O 的半衰期很短,故不适宜用作示踪原子研究化学反应历程,C 错误;D 项,自然界中不存在138O 2与158O 2并不是其化学键不稳定,而是由于138O 与158O 的半衰期很短,很容易发生核变化,转化为气体其他原子,O=O 的键能与形成该键的核素无关,D 错误;故选B 。
高考化学一轮复习专题5微观结构与物质的多样性第一单元原子结构训练(含解析)

第一单元原子结构一、选择题1.下列各组中,互为同位素的是( )A.氕(11H)和氘(21H)B.O2和O3C.碘晶体和碘蒸气D.SO2和SO3答案:A2.(2020·温州选考模拟)重水(D2O)是重要的核工业原料,下列说法错误的是( ) A.重水是原子反应堆的导热剂B.氘(D)原子核内有1个中子C.H2O与D2O的物理性质不相同D.1H、D与16O、18O形成的水分子,有5种不相同的相对分子质量解析:选A。
原子反应堆的导热剂是钠钾合金;D项,1H162O(18)、1H182O(20)、D162O(20)、D182O(22)、HD16O(19)、HD18O(21),有5种不相同的相对分子质量。
3.科研人员最近发现放射性元素钬(166 67Ho)可有效治疗肝癌。
下列说法正确的是( ) A.该原子的相对原子质量为166B.该原子中含有的质子数为99C.该原子含有的电子数为67D.该原子的质子数比中子数多32解析:选C。
该原子的质量数为166,为该原子的相对原子质量近似整数值,A错误;该原子中含有的质子数为67,中子数为99,中子数比质子数多32,B、D错误;由原子中,原子序数=核电荷数=质子数=核外电子数,可知钬原子含有的电子数为67,C正确。
4.下列说法不正确的是( )①质子数相同的粒子一定是同种元素②同位素的性质几乎相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数⑥某种元素的相对原子质量取整数,就是质量数A.②③⑤⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥解析:选C。
粒子包括分子、离子、原子、质子、中子等,如H2O与Ne电子数、质子数均相同,故①错,④对;一种分子和一种离子,如果质子数相等,其电子数一定不相等,故③对;同位素化学性质几乎相同,物理性质不相同,故②错;针对某原子而言,一种元素往往有几种同位素原子,它们的质量数各不相同,故⑤、⑥错。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考热点常考点选择题——同位素、原子结构
今年关于原子结构的题数减少一半。
该题型包括粒子数目关系,同位素的计算,书写原
子结构示意图,判断同位素概念、组成。
要熟悉原子内微粒间的数量关系和核外电子排布规
律,弄清“五方符号”,能正确书写原子或离子结构示意图和原子组成符号,才能正确解答
有关问题。
*************************************************************************
1、(1992上海)硼有两种天然同位素105B 和115B ,已知硼元素的原子量为10.8。
下列对硼元
素中105B 的质量分数的判断正确的是 ( )
A.等于20%
B.略小于20%
C.略大于20%
D.等于80%
2、(1993上海)核内中子数为N 的R 2+
的离子,质量数为A ,则n 克它的氧化物中所含质子的物质的量为 ( )
A . 16+A n (A -N +8)
B . 16+A n (A -N +10)
C . (A-N+2)
D . A
n (A -N +6) 3、(1994上海)某微粒用R A Z
n +表示,下列关于该微粒的叙述中正确的是 ( ) A . 所含质子数=A -n B . 所含中子数=A -Z
C . 所含电子数=Z +n
D . 质子数=Z +A
4、(1995上海)11H 、21H 、31H 、H +、H 2是 ( )
A. 氢的五种同位素 B. 五种氢元素
C. 氢的五种同素异形体 D. 氢元素的五种不同微粒
5、(96)科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最
重的原子.关于该新元素的下列叙述正确的是 ( )
A 其原子核内中子数和质子数都是112
B 其原子核内中子数为277,核外电子数为112
C 其原子质量是12C 原子质量的277倍
D 其原子质量与12C 原子质量之比为277:12
6、 (1999年全国高考题)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的
平均原子量为192.22,这两种同位素的原子个数比应为 ( )
A.39︰61
B.61︰39
C.1︰1
D.39︰11
7、(1998上海)钛(Ti )金属常被称为未来钢铁。
钛元素的同位素Ti 4622、Ti 4722、Ti 4822、Ti 4922、
Ti
5022中,中子数不可能为 ( )
A . 30
B . 28
C . 26
D . 24
8、(1999上海)据报道,上海某医院正在研究用放射性同位素碘12553I 治疗肿瘤。
该同位素原
于核内的中子数与核外电子数之差是 ( ) A . 72 B . 19 C . 53 D . 125
9.(2000)136C -NMR (核磁共振)可以用于含碳化合物的结构分析。
136C 表示的碳原子
( )
A 核外有13个电子,其中4个能参与成键
B 核内有6个质子,核外有7个电子
C 质量数为13,原子序数为6,核内有7个质子
D 质量数为13,原子序数为6,核内有7个中子
10、(2000上海)据报道,某些建筑材料会产生放射性同位素氡22286Rn ,从而对人体产生伤害。
该同位素原子的中子数和质子数之差是 ( )
A . 136
B . 50
C . 86
D . 222
11、(04年京浙理综)本题中用大写字母代表原子核。
E 经α衰变成为F ,再经β衰变成为
G ,再经α衰变成为H 。
上述系列衰变可记为下式: 另一系列衰变如下: 已知P 是F 的同位素,则 ( )
A .Q 是G 的同位素,R 是H 的同位素
B .R 是E 的同位素,S 是F 的同位素
C .R 是G 的同位素,S 是H 的同位素
D .Q 是
E 的同位素,R 是
F 的同位素
12、(2002上海)已知自然界氧的同位素有16O 、17O 、18O ,氢的同位素有 H 、D ,从水分子
的原子组成来看,自然界的水一共有 ( )
A. 3种
B. 6种
C. 9种
D. 12种
13、(2003上海)13C —NMR (核磁共振)、15N —NMR 可用于测定蛋白质、核酸等生物大分子
的空间结构,KurtW ü thrich 等人为此获得2002年诺贝尔化学奖。
下面有关13C 、15N 叙述
正确的是 ( )
A . 13C 与15N 有相同的中子数
B . 13
C 与C 60互为同素异形体
C . 15N 与14N 互为同位素
D . 15N 的核外电子数与中子数相同
14、(2004辽宁)下列关于原子的几种描述中,不正确的是 ( )
A 18O 与19F 具有相同的中子数
B 16O 与17O 具有相同的电子数
C 12C 与13C 具有相同的质量数
D 15N 与14N 具有相同的质子数)
15、(2004上海)据报道,月球上有大量3He 存在,以下关于3He 的说法正确的是( )
A. 是4He 的同分异构体
B. 比4He 多一个中子
C. 是4He 的同位素
D. 比4He 少一个质子
16、(2004广东)下列各组物质中,互为同位素的是 ( )
A 、重氢、超重氢
B 、氧、臭氧
C 、红磷、白磷
D 、乙酸、丙酸
17.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg ,该同位素的原子
核内的中子数是 ( )
A. 12
B. 14
C. 16
D. 18 (05MCE2)
18.(04年天津理综)核磁共振(NMR )技术已广泛应用于复杂分子结构的测定和医学诊断
等高科技领域。
已知只有质子数或中子数为奇数的原子核有NMR 现象。
试判断下列哪
组原子均可产生NMR 现象 ( )
A .O 18 P 31 Sn 119
B .Al 27 F 19
C 12 C .元素周期表中V A 族所有元素的原子
D .元素周期表中第1周期所有元素的原子
19.(2000年上海高考题)氯只有Cl 35和Cl 37两各稳定同位素,它们在氯气中的原子数之比
Cl Cl 3735:为3:1。
则分子量为70、72、74的氯气分子数之比可能是 ( )
A .5:1:1 B.5:2:2 C.9:3:1 D.9:3:2
20.Se 是人体必需微量元素。
下列关于Se 7834和Se 80
34的说法正确的是 ( )
A . Se 7834和Se 80
34互为同素异形体
B . Se 7834和Se 8034互为同位素
C . Se 7834和Se 80
34分别含有
44个和46个质子 D . Se 7834和Se 80
34都含有34个中子 (05广东化学.1)
答案:1B 2A 3B 4D 5D 6A 7A 8B 9D 10B 11B 12C 13C 14C 15C
16A 17C 18C 19D 20B E F G H α β α P Q R S
β β α。
