种子活力的测定
种子生活力与活力测定

5.观察鉴定 一般鉴定原则是,凡是胚的主要构造及有关活营养
组织染成有光泽的鲜红色,为有生活力种子。禾本 科:观察盾片、胚芽、胚轴、胚根;双子叶:观察 子叶、胚芽、胚轴、胚根。
凡是胚的主要构造局部不染色或染成异常的颜色, 并且活的营养组织不染色部分超过允许范围,以及 组织软化的,为不正常种子。
2.原理
将离体胚在规定的条件下培养5~14 d。有生 活力的胚仍然保持坚硬新鲜的状态,或者吸 水膨胀、子叶展开转绿,或者胚根和侧根伸 长、长出上胚轴和第一叶;而无生活力的胚, 则呈现腐烂的症状。
(二)离体胚测定方法
1.试验样品 需用400粒种子。设定重复次数(如4×100或 8×50)。
a.胚根顶端不染色,花生为三分之一,蚕豆为三分之二, 其他种为二分之一。 b.子叶顶端不染色,花生为四分之一,蚕豆为三分之一, 其他为二分之一。 c.除蚕豆外,胚芽顶部不染色四分之一 。
瓜类: a.胚根顶端不染色二分之一。 b.子叶顶端不染色二分之一。 棉花: a.胚根顶端三分之一不染色。 b.子叶表面有小范围的坏死或子叶顶端三分之一
DPNH2 + TTC (辅酶IH2) (四唑)
DPN + TTCH + HCl (辅酶I) (甲 ) (氯化氢)
依据四唑染成的颜色和部位,即可区分种子红色的有生活力部分和无 色的死亡部分。
注意:四唑染色是一酶促反应,因此反应不仅受酶活性的影响,还受 底物浓度、反应温度、pH值等因素的影响。
平均生活力百分率(%)
最大容许范 围
1
2
3
99
2
5
98
3
6
97
4
7
96
5
种子活力测定方法

种子活力测定方法种子活力测定方法是种子品质评价的重要手段之一,其目的是评估种子的发芽力和萌发势。
种子活力与种子内蕴水分、呼吸能力、抗逆性等因素密切相关,是衡量种子质量的重要指标之一。
下面将介绍几种常用的种子活力测定方法。
1. 发芽力测定法发芽力是衡量种子活力的重要指标之一,一般指种子萌发成苗的能力。
发芽力测定是判断种子品质的主要方法之一。
其步骤如下:首先,准备一定数量的种子样品,待测种子数量应根据需要而定,但一般不少于100粒;然后,将种子样品放入适合发芽的培养介质中,如培养皿、培养箱等;接下来,将培养介质放置在适宜的温度条件下,通常在25 - 30之间;观察并记录下种子的发芽情况,一般记录发芽数、发芽率等参数;最后,根据发芽数和发芽率来判断种子的活力水平。
2. 胚乳酸测定法胚乳酸测定法是测定种子活力的一种间接方法。
其原理是在种子老化过程中,胚乳中的淀粉被分解产生酸,通过测定胚乳酸含量来评估种子的活力。
具体步骤如下:首先,准备一定数量的种子样品,通常取100粒;然后,将种子样品粉碎,并用适量的水浸泡片刻,使胚乳酸完全溶解;接下来,取一定体积的溶液,加入胚乳酸试剂;然后,用菲仪或pH计测定胚乳酸的浓度;最后,根据胚乳酸浓度来评估种子的活力水平,通常胚乳酸浓度愈高,表示种子活力愈低。
3. 电导率测定法电导率测定法是一种评估种子活力的简单、快速的方法。
其原理是测定种子浸泡液中的电导率,通过判断电导率的高低来评估种子的活力。
具体步骤如下:首先,取适量的种子样品,用一定体积的水浸泡一段时间,通常为4小时;然后,用电导计测定浸泡液中的电导率;最后,根据电导率高低来判断种子的活力水平,电导率愈高,表示种子活力愈低。
4. 呼吸强度测定法呼吸强度测定法是一种评估种子活力的方法,其原理是通过测定种子的呼吸强度来评估种子的活力。
具体步骤如下:首先,取一定数量的种子样品,并进行表面消毒处理;然后,将种子样品放入呼吸仪中,并测定呼吸强度;最后,根据呼吸强度来评估种子的活力水平,呼吸强度愈高,表示种子活力愈强。
实验三 种子活力测定

1.幼苗分级评定测定
(1)数取碗豆种子50粒,2次重复。
(2)取长宽高分别约为15cm、20cm、10cm的聚乙烯盒,加入湿润砂2cm,将种子播入砂中,再盖上湿砂3cm,加盖。
(3)在温度20℃及光照条件下培养。
(4)第5d数初期发芽数,计算发芽势。
(5)7d后取出幼苗洗净,然后进行幼苗评定。
②发芽日数发芽达90%所需日数或达50%所需日数测定,后者可适用于发芽率较低的种子样品。
③发芽指数
式中:
Gt在不同(7d)的发芽数;
Dt发芽日数;
∑总和。GI值与活力xx相关。
④活力指数
活力指数(VI)=GI×S
式中:
S一定时期内幼苗xx(cm);
GI发芽指数。
五、试验报告
1、实验目的、要求
2、主要仪器设备
2.发芽速度测定
(1)数取大麦种子100粒,4次重复。
(2)置于纸上发芽床,20℃培养。
(3)第2天起每天记载发芽总数,计算出当天新发芽的种子数,至第7天结束。
同时第7天每盒随机选取10株测量幼苗长度。
(4)分别计算:
①初期发芽率②发芽日数③发芽指数④活力指数。
其中:
①初期发芽率大麦采用4d发芽率,也可采用计算发芽势或初次计算发芽率。
3、实验结果
1)豌豆:
计算发芽势、发芽率及健壮幼苗百分率
2)大麦:
①初期发芽率②发芽日数③发芽指数④活力指数
4、实验中出现的问题及解决办法
先将种子分成发芽和未发芽两类,再将幼苗分成3级:
①健壮幼苗:
胚芽健壮,深绿色,初生根健壮或初生根少但有大量次生根。
②细弱幼苗:
胚芽短或细长,初生根少或细弱。
种子活力的测定
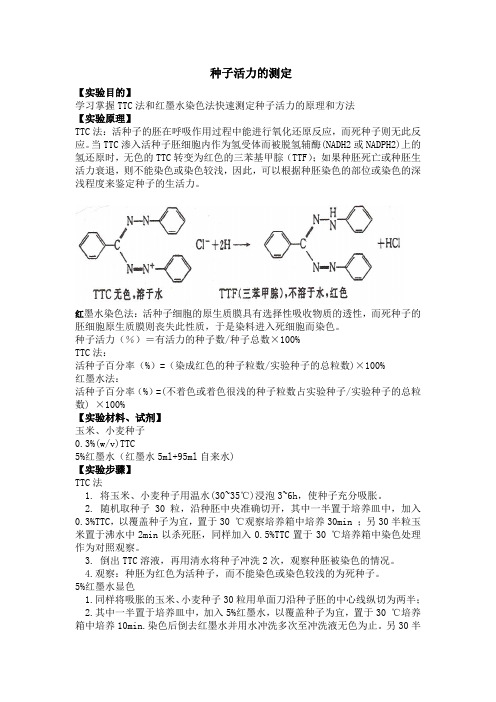
种子活力的测定【实验目的】学习掌握TTC法和红墨水染色法快速测定种子活力的原理和方法【实验原理】TTC法:活种子的胚在呼吸作用过程中能进行氧化还原反应,而死种子则无此反应。
当TTC渗入活种子胚细胞内作为氢受体而被脱氢辅酶(NADH2或NADPH2)上的氢还原时,无色的TTC转变为红色的三苯基甲腙(TTF);如果种胚死亡或种胚生活力衰退,则不能染色或染色较浅,因此,可以根据种胚染色的部位或染色的深浅程度来鉴定种子的生活力。
红墨水染色法:活种子细胞的原生质膜具有选择性吸收物质的透性,而死种子的胚细胞原生质膜则丧失此性质,于是染料进入死细胞而染色。
种子活力(%)=有活力的种子数/种子总数×100%TTC法:活种子百分率(%)=(染成红色的种子粒数/实验种子的总粒数)×100%红墨水法:活种子百分率(%)=(不着色或着色很浅的种子粒数占实验种子/实验种子的总粒数) ×100%【实验材料、试剂】玉米、小麦种子0.3%(w/v)TTC5%红墨水(红墨水5ml+95ml自来水)【实验步骤】TTC法1. 将玉米、小麦种子用温水(30~35℃)浸泡3~6h,使种子充分吸胀。
2. 随机取种子30粒,沿种胚中央准确切开,其中一半置于培养皿中,加入0.3%TTC,以覆盖种子为宜,置于30 ℃观察培养箱中培养30min ;另30半粒玉米置于沸水中2min以杀死胚,同样加入0.5%TTC置于30 ℃培养箱中染色处理作为对照观察。
3. 倒出TTC溶液,再用清水将种子冲洗2次,观察种胚被染色的情况。
4.观察:种胚为红色为活种子,而不能染色或染色较浅的为死种子。
5%红墨水显色1.同样将吸胀的玉米、小麦种子30粒用单面刀沿种子胚的中心线纵切为两半;2.其中一半置于培养皿中,加入5%红墨水,以覆盖种子为宜,置于30 ℃培养箱中培养10min.染色后倒去红墨水并用水冲洗多次至冲洗液无色为止。
另30半粒玉米置于沸水中2min以杀死胚,同样加入5%红墨水置于30℃培养箱中染色处理作为对照观察;3.观察:凡种胚不着色或着色很浅的为活种子,种胚与胚乳着色程度相同的为死种子。
实验一-种子活力测定

高级植物生理实验报告种子生理农学院农药学东保柱20132020542013年12月27日种子活力种子活力即种子的健壮度,是种子发芽和出苗率、幼苗生长的潜势、植株抗逆能力和生产潜力的总和,是种子品质的重要指标。
长期以来都用发芽试验检验种子的质量,生产实践表明,实验室的发芽率与田间的出苗率之间往往存在很大差距。
由于种子活力是一项综合性指标,因此靠单一活力测定指标判定其总活力水平或健壮度是不科学的。
实验 1 种子活力的测定种子发芽率、发芽势和发芽指数的测定(垂直板发芽法)一 原理种子在适宜的水分、氧气、温度条件下经一段时间可以萌发。
在最适宜条件和规定天数内,发芽的种子数与供试的种子的百分比,叫发芽率。
为了表示萌发速度与整齐度,反映种子活力程度,规定在短时间内能正常萌发的种子数叫发芽率(测定发芽与发芽天数可参看下述的《种子发芽试验的技术规定》)。
发芽数与发芽相应天数之比的和叫发芽指数。
二 材料与设备1 材料 :小麦种子。
2 设备:玻璃板 滤纸或湿沙 恒温箱 镊子3 药品: 1%次氯酸钠(NaClO ) 三 实验步骤1 选取完整健壮的种子10-15粒,三个重复,用1%次氯酸钠消毒0.5—1min,将种子均匀地排列在有滤纸的培养皿中,种子之间留有一定距离,加入适量蒸馏水,放于所需温度条件下萌发。
2 每天定时记录发芽粒数。
根据附表《种子发芽试验的技术规定》计算种子的发芽势、发芽率和发芽指数。
3 计算正常发芽的种子数 1、发芽率(%)= ×100供试种子数 2、发芽指数(∑=Dt GtGi )式中:Gi —发芽指数Gt ——在时间t 日发芽日数 Dt ——相应的发芽日数四 注意事项1 对于1—2天内全部萌发的迅速发芽类型种子,不适用上述公式计算,宜采用简化活力指数(见实验21)。
2 种子发芽试验的技术规定(附表)实验2 种子活力指数的测定一 原理萌发种子幼根的生长势是反映活力的一个较好生理指标,如将发芽指数与幼苗生长量联系起来(二者的乘机),以活力指数(Vl )来表示,可以作为种子的活力指标。
测定种子活力的原理

测定种子活力的原理
测定种子活力的原理通常是通过观察种子的发芽率来判断其活力。
具体流程如下:
1. 种子浸泡:将一定数量的种子浸泡在适当的液体介质中,一般使用蒸馏水或含有营养物质的溶液,例如无机盐溶液。
2. 排水:浸泡一段时间后,将种子从液体中取出,排除多余的水分,使其表面保持适当的湿度。
3. 培养:将处理好的种子均匀放置在适当的培养基上,栽培在恰当的环境条件下,例如适当的光照、温度和湿度等。
4. 观察发芽:在一定的时间内观察种子的发芽情况,记录发芽的数量,并计算发芽率。
5. 计算活力:根据发芽率计算种子的活力,一般活力指数越高,种子的存活能力越强。
这种测定种子活力的方法主要基于种子的萌发过程,种子在合适的环境下,通过吸收水分和养分,释放出生长所需的能量,逐渐发芽生长。
通过观察发芽率,可以评估种子的存活能力和潜在增长能力,从而判断种子的活力。
实验一 种子活力测定

实验一种子活力测定种子活力是指种子在一定条件下保持种子萌发和生长的能力。
种子的活力对种子的生长和发育起着重要的作用,因此对种子的活力进行测定是非常必要的。
种子活力测定通常使用的方法有以下几种:1. 萌发率测定法这是一种经典的种子活力测定方法,它是通过计算种子在确定条件下萌发的比例来反映种子的活力。
这种方法主要用于一些小种子的活力测定,如水稻、玉米等。
方法步骤:(1) 取一定量的种子,洗净,用温水浸泡约4小时。
(2) 取一张过滤纸,加入适量的水,将水吸满后放在皿子底部。
(3) 将浸泡好的种子均匀地摆放在过滤纸上,然后用水喷雾器喷适量的水,使过滤纸湿润。
(4) 将皿子盖好,放在恒温箱中,在温度为25℃±1℃ ,光照强度为5000Lux±500Lux的条件下培养2-7天。
(5) 观察种子萌发情况,计算种子的萌发率。
萌发率=(萌发种子数÷总种子数)×100%发芽指数是种子萌发能力的定量指标,可用于分析不同处理下种子的活力差异。
这种方法适用于大小适中的种子,如小麦、燕麦、大豆等。
(5) 每天在同一时间内数一次种子的萌发情况,记录下天数和萌发的种子数。
(6) 根据公式计算出发芽指数。
3. 活力指数测定法活力指数是反映种子整体活性的指标,它综合考虑了种子的萌发率、发芽率、生长状况等多个因素。
该方法适用于各种大小的种子。
(2) 将种子均匀地放置在含水浸透的滤纸上,并将其放入塑料袋中。
活力指数=((萌发种子数÷总种子数)×(发芽种子根长总和÷萌发种子数)×100)÷(总培养天数×总种子数)。
第五章___种子生活力与活力测定

色情况。
20 ml乳酸+20 ml苯酚+40 ml甘油+20 ml蒸馏水
注意
该药液有毒性,最好戴塑胶薄膜手套配 制,并在通风橱里操作。在使用时谨防 触及皮肤或衣服等。
Gansu Agricultural Universiry
第一节 种子生活力测定原理及方法
(4) H202 :加快酶活化和吸胀。一般用0.3%H202溶液 (5)杀菌剂和抗生素:延缓衰弱种子的劣变进程。
第一节 种子生活力测定原理及方法
2)种子预措
目的:采用适当的方法使胚的主要构造和(或)活的营
养组织暴露出来。
Gansu Agricultural Universiry
第一节 种子生活力测定原理及方法
方法:
刺穿:对经过预湿的种子或硬实种子,可利用解剖针或解
剖刀,刺穿种子的非主要部位,适用于小粒(牧草等)种子。
加速四唑还原成甲臜的速度;
或在两端横切,打开胚腔,并 切去小部分胚乳(配子体组织) 针叶树种子沿胚旁 边纵切
Gansu Agricultural Universiry
第一节 种子生活力测定原理及方法
(3)四唑染色
目的:通过染色反应,将胚和活的营养组织里的
健壮、衰弱和死亡部分的差异正确地显现出来。 染色程序: 将准备好的100×4种子放入适宜大小的培养皿或 烧杯中。 加入适宜浓度的四唑溶液,以淹没种子为度,移置 到一定温度的(黑暗或弱光)恒温箱内进行染色反应。
ISTA Working Sheets on Tetrazolium Testing, Volume I, 1st Edition, 2003 Volume I - Agricultural, Vegetable and Horticultural Species By N. Leist and S. Krämer Illustrated by J. Pfäfflin
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肇庆学院
生命科学学院生物科学系植物生理学课实验报告
08 年级生本班 B 组28 实验日期10.22
姓名杨丹平老师评定
______________________________________实验题目实验五种子活力的测定
一、实验目的:
掌握种子活力快速测定的几种方法。
二、实验原理:
1、活种子的胚在呼吸作用过程中能进行氧化还原反应,而死种子则无此反应。
当TTC
渗入活种子胚细胞内作为氢受体而被脱氢辅酶(NADH2或NADPH2)上的氢还原时,无色的TTC转变为红色的三苯基甲(TTF)。
2.、活种子进行呼吸作用呼吸空气中的O2,放出CO2。
CO2溶于水成为H2CO3,H2CO3
解离为H+和HCO3-,使得种子周围环境的酸度增加。
BTB法通过测定酸度的变化来判断种子活性。
BTB变色范围为PH6.0—7.6,酸性呈黄色,碱性呈蓝色,中间经过绿色(变色点为PH7.1)。
色泽差异显著,易于观察。
3红墨水染色法是根据活种子细胞的原生质膜具有选择性吸收物质的透性,而死种子的胚细胞原生质膜则丧失此性质,于是染料进入死细胞而染色。
三、实验仪器及材料:
1、仪器:电热恒温培养箱、培养皿、烧杯、镊子、单面刀
2、试剂:3%TTC溶液、0.1%BTB溶液、1%BTB琼脂凝胶
3、材料:玉米、绿豆吸胀种子
四、实验步骤:
1.浸种
种子在30—35℃温水中浸种5h
2.0.5%TTC显色实验
将吸胀的玉米种子30粒用单面刀沿种子胚的中心线纵切为两半,其中一半置于培养皿中,加入0.3%TTC,以覆盖种子为宜;将吸胀的绿豆种子去皮,随机选30粒置于培养皿中,加入0.3%TTC,置于30C观察培养箱中培养30min。
观察浸种胚是否为红色。
另30半粒玉米和已去皮的30粒绿豆置于沸水中2min以杀死胚,同样加入
0.5%TTC置于30C培养箱中染色处理作为对照观察。
计算活种子的百分率。
3.1%BTB染色
将吸胀的玉米种子30半粒和去皮的30粒绿豆种子分别整齐地埋于1%BTB琼脂凝胶两个培养皿中,平放,间距约1cm。
培养皿置于30C培养箱中培养1h,在光亮处下观察,种子附近呈现深黄色晕圈的是活种子,用沸水中杀死的种子分别进行对照。
4.5%红墨水显色
将吸胀的玉米种子30粒用单面刀沿种子胚的中心线纵切为两半,其中一半置于培养皿中,加入5%红墨水,以覆盖种子为宜;将吸胀的绿豆种子去皮,随机选30粒置于培养皿中,加入5%红墨水,以覆盖种子为宜,置于30C培养箱中培养10min.染色后倒去红墨水并用水冲洗多次至冲洗液无色为止。
凡种胚不着色或着色很浅的为活种
子,种胚与胚乳着色程度相同的为死种子。
另30半粒玉米和已去皮的30粒绿豆置于沸水中2min以杀死胚,同样加入5%红墨水置于30C培养箱中染色处理作为对照观察。
五、实验结果:
1、0.5%TTC显色实验
活种子百分率(%)=(染成红色的种子粒数/实验种子的总粒数)*100
玉米活种子百分率(%)=(20/33)*100=60.6%
绿豆活种子百分率(%)=(22/26) *100=84.6%
2.、1%BTB染色
种子活力(%)=(出现黄色晕圈的种子粒数/总种子数)*100
玉米种子活力(%)=(30/40) *100=75%
绿豆种子活力(%)=(24/36) *100=66.7%
3、5%红墨水显色
活种子的百分率为不着色或着色很浅的种子粒数占实验种子的总粒数的百分数。
绿豆活种子的百分率=0
玉米活种子的百分率=(15/27)*100=55.6%
六、结果分析:
1、从以上的数据可以看出,玉米地实验效果没有绿豆的好,那是因为绿豆吸胀种子
完整的,而玉米吸胀种子是被虫蛀过的,特别是胚的部位收到不同程度的损伤。
2、由实验结果推知,氯化三苯四氮唑(TTC)法简单、迅速、结果稳定,是测定种子活力最有效的
方法。
溴麝香草酚蓝(BTB)法试验虽能测定种子的活力,试验效果不及氯化三苯四氮唑(TTC)法。
3、在观察1%BTB染色实验时,死种子也出现黄色的晕圈,那是因为此种子死时释放酸
性物质从而影响实验结果。
七、作业
1、各种方法测定种子活力的结果是否相同?
答:不同。
用0.5%TTC显色实验和1%BTB染色实验方法是测试玉米和绿豆中有活力的种子而5%红墨水显色法是测试死种子的。
而且,用0.5%TTC显色实验是活种子的
胚在呼吸作用过程中能进行氧化还原反应,使无色的TTC转变为红色的三苯基
甲(TTF)。
1%BTB染色实验是活种子进行呼吸作用呼吸空气中的O2,放出CO2
使种子周围环境呈酸性而出现黄色。
5%红墨水显色法是死种子的胚细胞原生质膜则
丧失此性质,使染料进入死细胞而染色。
