严重不良事件报告表SAE国家食品药品监督管理局.doc
严重不良事件报告表
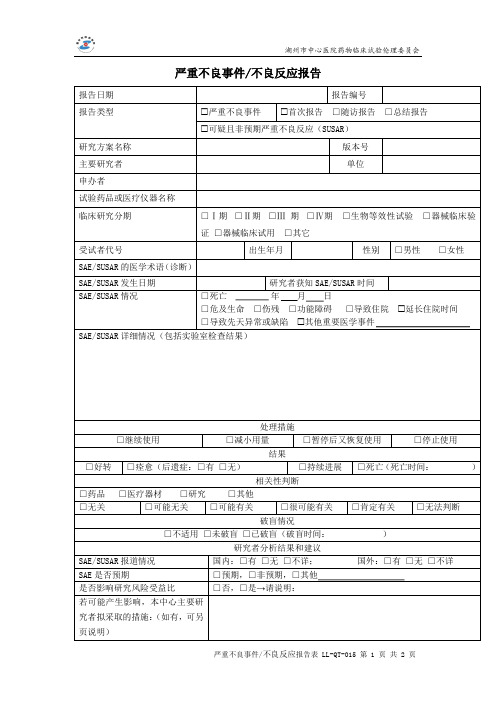
延长住院时间
□继续使用
处理措施
□减小用量
□暂停后又恢复使用
□停止使用
结果
□好转 □痊愈(后遗症:□有 □无)
□持续进展 □死亡(死亡时间:
Байду номын сангаас
)
□药品 □医疗器材 □研究
相关性判断 □其他
□无关
□可能无关
□可能有关
□很可能有关
破盲情况
□肯定有关
□无法判断
□不适用 □未破盲 □已破盲(破盲时间:
)
研究者分析结果和建议
证 □器械临床试用 □其它
受试者代号
出生年月
性别 □男性 □女性
SAE/SUSAR 的医学术语(诊断)
SAE/SUSAR 发生日期
研究者获知 SAE/SUSAR 时间
SAE/SUSAR 情况
□死亡
年月日
□危及生命 □伤残 □功能障碍 □导致住院
□导致先天异常或缺陷 其他重要医学事件
SAE/SUSAR 详细情况(包括实验室检查结果)
湖州市中心医院药物临床试验伦理委员会
严重不良事件/不良反应报告
报告日期
报告编号
报告类型
严重不良事件 首次报告 □随访报告 □总结报告
可疑且非预期严重不良反应(SUSAR)
研究方案名称
版本号
主要研究者
单位
申办者
试验药品或医疗仪器名称
临床研究分期
□Ⅰ期 □Ⅱ期 □Ⅲ 期 □Ⅳ期 □生物等效性试验 □器械临床验
是否需要修改研究方案? 是否需要修改知情同意书?
研究者签名
湖州市中心医院药物临床试验伦理委员会
是 □是
□否 □否
□计划更新 □计划更新
严重不良事件报告表(SAE)

□继续用药□减小剂量□药物暂停后又恢复□停用药物
SAE转归
□症状消失(后遗症□有□无)□症状持续
SAE与试验药的关系
□肯定有关□可能有关□可能无关□肯定无关□无法判定
SAE报道情况
国内:□有□无□不详;国外:□有□无□不详
SAE发生及处理的详细情况:
报告单位名称报告人职务/职称:报告人签名:
严重不良事件报告表(SAE)
新药临床研究批准文号:编号:
报告类型
□首次报告□随访报告□总结报告
报告时间:年月日
医疗机构及专业名称
电话
文名称:
药品注册分类及剂型
分类:□中药□化学药□治疗用生物制品□预防用生物制品□其它注册分类:剂型:
临床研究分类
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期
3.疾病:__________治疗药物:__________用法用量:_______________
SAE的医学术语(诊断)
SAE情况
□死亡______年___月___日
□导致住院□延长住院时间□伤残□功能障碍
□导致先天畸形□危及生命□其它
SAE发生时间:_______年___月___日
研究者获知SAE时间:_______年___月___日
□生物等效性试验□临床验证
临床试验适应症:
受试者基本情况
姓名拼音缩写:
出生日期:
性别:□男□女
身高(cm):
体重(Kg):
合并疾病及治疗:□有□无
1.疾病:__________治疗药物:__________用法用量:_______________
2.疾病:__________治疗药物:__________用法用量:_______________
SAE-报告模板

SAE发生时间:
研究者获知SAE时间:
对试验器械采取的措施
继续试验□观察后又继续□停用试验
SAE转归
□症状消失(后遗症□有□无)
症状持续
□死亡(死亡时间:______年___月___日)
SAE与试验器械的关系
□肯定有关可能有关□可能无关□肯定无关□无法判定
SAE发生及处理的详细情况:
报告单位名称:报告人职务/职称:报类型
首次报告□随访报告□总结报告
报告时间:
医疗机构及专业名称
电话:
申报单位名称
电话
试验用药品名称
中文名称:
英文名称:
受试者基本情况
姓名拼音缩写:
出生日期:
性别:男□女
身高(cm):
体重(Kg):
合并疾病及治疗:有□无
1.疾病:__________治疗药物:__________用法用量:_______________
2.疾病:__________治疗药物:__________用法用量:_______________
3.疾病:__________治疗药物:__________用法用量:_______________
SAE的医学术语(诊断)
SAE情况
□死亡______年___月___日
导致住院□延长住院时间□伤残□功能障碍
08-SAE的报告和处理

GCP 培训
如何操作具体项目?
项目培训 初次报告 随访报告 文档保存
GCP 培训
参加项目培训
研究者会议 基地启动会议 其它
GCP 培训
培训后需知道……
SAE在本具体项目中的定义范围,必须参照
伴有周围循环衰竭的过敏反应, 通过过量服用试验药物而企图自杀。
GCP 培训
Guidance for Hospitalisations “住院”的评价标准
√
-
an AE 不良事件 deterioration of the disease state under investigation 临床试验所研究的 疾病恶化 deterioration of a pre-existing condition 原有疾病的恶化
-
GCP 培训
Persistent or Significant Disability or Congenital anomaly or birth Incapacity 持续/严重的伤残或功能丧失 defect先天畸形或出生缺陷 – causes a substantial disruption of a person‟s ability to conduct normal life functions 不良事件确实导致患者正常生 活的能力受到破坏。 – need not be permanent 不一定是永久性的 如:脑血管意外、白内障 A congenital anomaly or birth defect which can be related to treatment given to one of the parents or to the mother during pregnancy 某种先天畸形或出生缺陷可能与 父/母一方或母亲在妊娠期间接 受的治疗有关 Please complete Pregnancy Form 请填写临床试验中的<妊娠报告表 >
严重不良事件(SAE)报告

严重不良事件(SAE)报告什么是严重不良事件?严重不良事件(SAE)是指发生在临床试验中可能会危及受试者生命或健康的不良事件。
与其他不良事件(例如轻微不适)不同,SAE往往需要立即上报给监管机构和该试验的伦理委员会。
SAE也可以发生在药品和医疗器械的正式营销中,这时也需要进行临床研究以确认安全性和有效性。
SAE报告的流程1. 紧急处理SAE在发生SAE之后,研究人员应立即采取措施,尽可能减少潜在的风险和继续伤害。
这包括为患者提供紧急治疗、停止试验药物的使用、暂停试验流程、调整试验流程或终止试验等。
2. 上报SAE在紧急处理后,研究人员需要尽快将SAE报告给监管机构和伦理委员会。
这通常需要按照监管机构特定的SAE上报表格或表格模板提交报告,例如中国FDA的SAE报告表格。
3. 追踪SAE进展在提交SAE报告之后,研究人员需要监测SAE患者的进展情况,同时将其汇报给监管机构和伦理委员会。
这些报告可以包括SAE的病因学、症状、严重程度和治疗方法等信息,以及治疗效果和不良反应的监测结果。
除此之外,要及时调整伦理委员会的决策和试验计划。
4. SAE报告/追踪的时间点在报告SAE时,有一定时间限制,这通常是在SAE发生后24小时内或发现亚组后7个日历日内内报告。
对于中国而言,采用了《食品药品安全法》和中国FDA对“在中国进行药物和医疗器械的临床试验管理规定”,规定紧急报告的时间为24小时内。
对于非紧急的SAE报告,则需要在30天内提交报告。
5. SAE报告的必要性SAE报告对于临床研究的推动起着重要作用。
SAE报告不仅有助于确保研究人员能够充分了解试验中不良反应的情况,而且可以促进试验的透明性和公平性,提高患者与公众对试验的信任和接受度。
同时也为监管机构和伦理委员会提供了必要的依据,以评估受试者安全和试验质量。
结论总之,SAE的发生需要及时采取处理措施并报告给监管机构和伦理委员会,提高试验的透明性和公平性。
临床试验SAE上报流程附SAE报告表

SAE上报单位:
1、国家局
2、省局
3、医院伦理
4、申办方
5、卫计委(暂未知联系
方式)
SAE向SFDA报告的相关汇报方式如下:
1.传真汇报给:CFDA注册司研究监督处 fax: 010-8836 3228
2.首选传真的方式。
如果遇到无法传真的情况,以EMS方式邮寄过去
(必须是EMS,不接受其他方式的快递,同时也不接受邮件的方式),
邮寄地址:国家食品药品监督管理局注册司研究监督处
北京市西城区宣武门西大街26号院2号楼
邮编:100053 联系人:李金菊(处长)/王闻
雅电话:0、
注:如果通过EMS邮寄,请保留传真失败记录,并保留EMS底单复印
件。
SAE向卫计委报告的相关汇报方式如下:
国家卫生和计划生育委员会医政医管局医疗安全与血液处陈兵
地址:北京市西城区北礼士路甲38号
电话:0
传真:0
严重不良事件报告表(SAE)
新药临床研究批准文号:编号:
报告单位名称:报告人职务/职称:报告人签名:。
严重不良事件报告表(SAE)

新药临床研究批准文号:药物编号:研究号:
报告类型
□首次报告□随访报告□总结报告
报告时间:_______年___月___日:
医疗机构及专业名称
电话
申办单位名称
电话
试验用药品名称
中文名称:
英文名称:
药品注册分类及剂型
分类:□中药□化学药□治疗用生物制品□其它注册分类:剂型:
临床研究分类
破盲情况
□未破盲□已破盲(破盲日期:)
SAE报道情况
国内:□有□无□不详;国外:□有□无□不详
SAE发生及处理的详细情况:
报告单位名称:柳州市妇幼保健院报告人职务/职称:报告人签名:
3.疾病:__________治疗药物:__________用法用量:______不良反应史:
相关重要信息(动植物过敏史等):
SAE的医学术语(诊断)
SAE情况
□死亡______年___月___日
□导致住院□延长住院时间□伤残□功能障碍
□导致先天畸形□危及生命□其它
SAE发生时间:_______年___月___日:
研究者获知SAE时间:_______年___月___日:
对试验用药采取的措施
□继续用药□减小剂量□药物暂停后又恢复□停用药物□不适用
SAE转归
□症状消失(后遗症□有□无)□症状持续□死亡
SAE与试验药的关系
□肯定有关□可能有关□可能无关□肯定无关□无法判定
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□临床验证
□生物等效性试验□其他:
临床试验适应症:
受试者基本情况
姓名拼音缩写:
出生日期:
性别:
□男□女
身高(cm):
年龄(岁):
严重不良事件报告表(SAE)

国内: □有 □无 □不详; 国外: □有 □无 □不详
SAE发生及处理的详细情况:
报告单位名称: 报告人职务/职称: 报告人签名:
2. 疾病:__________ 治疗药物:__________ 用法用量:_______________
3. 疾病:__________ 治疗药物:__________ 用法用量:_______________
SAE的医学术语(诊断)
SAE情况
死亡年月日
导致住院□延长住院时间□伤残□功能障碍
□ 导致先天畸形 □危及生命 □其它
严重不良事件报告表(SAE)
新药临床研究批准文号: 编号:
报告类型
□首次报告□随访报告 □总结报告
报告时间: 年 月 日
医疗机构及专业名称
电话:
申报单位名称
电话:
试验用药品名称
中文名称:
英文名称:
药品注册分类及剂型
分类:□中药 □化学药 □治疗用生物制品 □预防用生物制品 □其它 注册分类: 剂型:
临床研究分类
□Ⅰ期 ■Ⅱ期 □Ⅲ 期 □Ⅳ期
□生物等效性试验 □临床验证
临床试验适应症:
受试者基本情况
姓名拼音缩写:
出生日期:
性别: □男 □女
身高(cm):
体重(Kg):
合并疾病及治疗:□有 □无
1. 疾病:__________ 治疗药物:__________ 用法用量:_______________
SAE发生时间: _______年___月___日
研究者获知SAE时间: _______年___月___日
对试验用药采取的措施
□继续用药 □减小剂量 □药物来自停后又恢复 □停用药物SAE转归
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
报告单位名称:报告人职务/职称:报告人签名:
研究者获知SAE时间:_______年___月___日
对试验用药采取的措施
□继续用药□减小剂量□药物暂停后又恢复□停用药物
SAE转归
□症状消失(后遗症□有□无)□症状持续
SAE与试验药的关系
□肯定有关□可能有关□可能无关□肯定无关 □无法判定
SAE报道情况
国内:□有□无□不详; 国外:□有□无□不详
3. 疾病:__________ 治疗药物:__________ 用法用量:_______________
SAE的医学术语(诊断)
SAE情况
□死亡 ______年___月___日
□导致住院□延长住院时间 □伤残□功能障碍
□ 导致先天畸形□危及生命□其它
SAE发生时间:_______年___月___日
□生物等效性试验□临床验证
临床试验适应症:
受试者基本情况
姓名拼音缩写:
出生日期:
性别: □男 □女
身高(cm):
体重(Kg):
合并疾病及治疗:□有 □无
1. 疾病:__________ 治疗药物:__________ 用法用量:_______________
2. 疾病:__________ 治疗药物:__________ 用法用量:_______________
附件5.
严重不良事件报告表(SAE)
新药临床研究批准文号:编号:
报告类型ห้องสมุดไป่ตู้
□首次报告□随访报告□总结报告
报告时间:年月日
医疗机构及专业名称
电话
申报单位名称
电话
试验用药品名称
中文名称:
英文名称:
药品注册分类及剂型
分类:□中药 □化学药□治疗用生物制品□预防用生物制品□其它注册分类:剂型:
临床研究分类
□Ⅰ期□Ⅱ期□Ⅲ 期□Ⅳ期
