高三化学一轮复习 基本理论(一)---物质结构 元素周期律共60页PPT资料
高三一轮复习--元素周期律 ppt课件

D、Cl的最高正价为+7,
ppt课件
31
练习
试比较 O2- > F- > Na+ > Mg2+ > Al3+ 8 10 2 9 10 2 11 10 2 12 10 2
A B C 电子排布相同的离子,离子半径随着核电 D 荷数的递增而减小。
ppt课件 32
的半
径大小
核电荷数 电子总数 电子层数 13 10 2
ppt课件
16
Na
与冷水反 单质与水 应:
Mg
Al
与冷水反应缓 与酸反应: 慢,与沸水反 应迅速、与酸 (或酸) 迅速 剧烈 反应剧烈,放 反应 出氢气。 金属性:Na>Mg>Al
最高价氧 化物对应 水化物碱 性强弱
NaOH
Mg(OH)2
Al(OH)3
强碱
ppt课件
中强碱
两性氢 氧化物
17
7 元素非金属性强弱判断依据
三、元素周期表和元素周期律的应用
1.元素的位、构、性三者之间的关系及其应用
位置 反映 决定
反映 结构 决定 决定 反 映 性质
结构决定位置: 原子序数=核电荷数 周期序数=电子层数 主族序数=最外层电子数
ppt课件
22
结构决定性质:
最外层电子数=主族元素的最高正价数 =8-负价数
最外层电 子数和原 子半径 原子得 失电子 的能力 元素的金属 性、非金属 性强弱
1、根据非金属单质与H2化合的难易程度及生成氢化物的稳定性 来判断:单质越容易与氢气化合,生成的氢化物越稳定,对应元
素的非金属性越强。
2、根据非金属元素的最高氧化物对应水化物的酸性强弱来判断, 酸性越强,对应元素的非金属性越强 3、根据非金属单质间的置换反应来判断:非金属性强的元素构成 的单质可以将非金属性弱的元素构成的单质从它的盐溶液中置换
高考化学一轮总复习课件-元素周期律和元素周期表

“=”)。
②推测未知元素的某些性质
如:已知Ca(OH) 微溶,Mg(OH) 难溶,可
(3)启发人们在一定区域内寻找新物质
①半导体元素在金属与非金属分界线附近, 如:Si、Ge、Ga等。
②农药中常用元素在右上方,如:F、Cl、S、 P、As等。
③催化剂和耐高温、耐腐蚀合金材料主要是 过渡元素,如:Fe、Ni、Rh、Pt、Pd等。
[填一填]
>1.根据元> 素周期律比较下列各组性质,用
“>”或“<> ”填空>:(1)金属性:
K__________N<a________<__Mg,
非金属性:>F<______>_<___O__________S。
(2)碱性: >
<
Mg(OH)2_____>_____C>a(OH)2__________KO
期的右边,Z的原子序数可能为a+31。
元素周期表结构中隐含的两条规律
(1)同周期主族元素原子序数差的关系
①短周期元素原子序数差=族序数差。
②两元素分布在过渡元素同侧时,原子序数 差=族序数差。两元素分布在过渡元素两侧时, 四或五周期元素原子序数差=族序数差+10, 六周期元素原子序数差=族序数差+24。
第五章 物质结构 元素周期律
第16讲 元素周期律和元素周期表
1.掌握元素周期律的实质。 2.了解元素周期表(长式)的结构(周期、族)及其 应用。 3.以第三周期为例,掌握同一周期内 元素性质的递变规律与原子结构的关系。 4. 以ⅠA族和ⅦA族为例,掌握同一主族内元素性 质递变规律与原子结构的关系。 5.了解金属、 非金属在元素周期表中的位置及其性质的递变 规律。
非金属性 比较
本质
判断 方法
原子越易得电子,非金属性越强(与原子得电子数目无关) ①元素在周期表中的位置:右边或上方元素的非金属性强 ②与H2越容易化合,气态氢化物越稳定,非金属性越强
高考化学一轮总复习课件第五单元 物质结构 元素周期律 (共430张PPT)

考情 周期表的结构、元素周期律及其应用、元素“位—构—性”三者的关系、化学 回顾 键及元素化合物等。题型以选择题和推断题为主 课时 本单元内容共 3 讲, 课堂讲解可安排 3~4 课时的时间 安排
第1讲 原 子 结 构
一、原子结构 1.原子的构成
2.原子中各粒子之间的数量关系
1.任何微粒中, 质量数=质子数+中子数, 但质子数与电子数不一 定相等, 如阴、阳离子中。 2.有质子的微粒不一定有中子, 如 1H; 有质子的微粒不一定有电 子, 如 H+。 3.质子数相同的微粒不一定属于同一种元素, 如 F 与 OH-。 4.核外电子数相同的微粒, 其质子数不一定相同, 如 Al3+和 Na+、
( 3) 阳离子: 质子数=核外电子数+离子所带电荷数。 ( 4) 阴离子: 质子数=核外电子数-离子所带电荷数。 3.熟记常见的 10e-粒子和 18e-粒子
+ 10e-粒子: Ne、 HF、 H2O、 NH3、 CH4、 Na+、 Mg2+、 Al3+、 N������������ 、 H3O+、
+ F-等, N������������ 与 OH-等。
二、核素 1.元素: 具有相同⑧ 2.核素: 具有一定数目⑩ 用符号 3.同位素 概念: 互称为同位素。 相同而 不同的同一种元素的不同 表示。 即⑨ 和一定数目 的同一类原子的总称。 的一种原子。可
特征: ( 1) 具有相同存在形态的同位素, 化学性质几乎完全相同。 ( 2) 天然存在的同一元素各核素所占的原子百分数一般不变。
。
( 3) 电子式着重描述原子构成的物质中最外层电子的成键情况。 如: · ������ ·。
届高三化学一轮复习五物质结构元素周期律二节元素周期律PPT课件

=主族序数=最 外层电子数 (O、F 除外)
应 元素原子失 用 电子能力
逐渐减弱
逐渐增强
基础自知主识梳理 典例解析方法 考点能力突破
元素原子得 电子能力 元素的金属性 和非金属性
离子的氧化性 和还原性
最高价含氧酸酸性 最高价碱的碱性 气态氢化物稳定性 气态氢化物还原性 单质置换氢气 的难易程度
逐渐增强
。
基础自知主识梳理 典例解析方法 考点能力突破
二、元素周期律
1.定义 元素的性质随着原子序数的递增而呈周期性变化的规律。 2.实质 元素原子核外电子排布的周期性变化。
基础自知主识梳理 典例解析方法 考点能力突破
3.元素周期表中主族元素性质的递变规律
同周期(左→右) 同主族(上→下)
结
电子层数 相同
CH3OH、CH3F、H2N—NH2 等 ②阴离子:S2-、HS-、Cl-、O22③阳离子:K+、Ca2+
①Na+、NH4+、H3O+ ②F-、OH-、NH2③同位素如 11H、12H、13H
3.寻找10电子微粒和18电子微粒的思维方法 (1)10电子微粒:
(2)18电子微粒:
基础知识梳理 典考例点解研析析方突法破 考点能力突破
考点一原子核外电子排布的特殊规律及电子数相等的粒 子
1.核外电子排布的特殊规律(短周期元素) (1)最外层有 1 个电子的元素:H、Li、Na。 (2)最外层有 2 个电子的元素:He、Be、Mg。 (3)最外层电子数等于次外层电子数的元素:Be、Ar。 (4)最外层电子数是次外层电子数 2 倍的元素:C;是次外层 3 倍的元 素:O;是次外层 4 倍的元素:Ne。 (5)电子层数与最外层电子数相等的元素:H、Be、Al。 (6)电子总数为最外层电子数 2 倍的元素:Be。 (7)次外层电子数是最外层电子数的 2 倍的元素:Li、Si。 (8)内层电子总数是最外层电子数 2 倍的元素:Li、P。
高考化学一轮复习物质结构、元素周期律(2)课件
A 比较Br和I的非金属性:向FeI2溶液中,加入少量溴水 B 比较Cl和I的非金属性:向FeI2溶液中,通过量氯气 C 比较Cl和Br的非金属性:向FeBr2溶液中,通少量氯气 D 比较Cl和Br的非金属性:向FeBr2溶液中,通过量氯气
练一练
判断正误,正确的划“√”,错误的划“×”:
(1)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强。 (× ) (2)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强, (× )
总结
元
原 子 序 数 递 增
素 性 质 呈 周 期 性
变
化
表现
1、原子半径周期性变化
2、元素化合价周期性变化
3、元素金属性、非金属性 周期性变化
实质:原子核外电子排布的周期性变化
巩固提高
1、(2015·福建卷·10)短周期元素X、Y、Z、W在元素周 期表中的相对位置如右下图所示,其中W原子的质子数是其 最外层电子数的三倍。下列说法不正确的是( A ) A. 原子半径:W>Z>Y>X B. 最高价氧化物对应水化物的酸性:X>W>Z C. 最简单气态氢化物的热稳定性:Y>X>W>Z D. 元素X、Z、W的最高化合价分别与其主族 序数相等
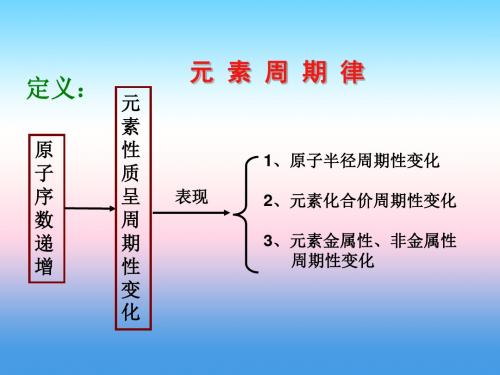
定义: 元
素
数
周
递
期
增
性
变
化
元素周期律
表现
1、原子半径周期性变化
2、元素化合价周期性变化
3、元素金属性、非金属性 周期性变化
高考要求
1. 理解元素周期律的实质及应用。 2.掌握原子半径、离子半径的比较。 3.掌握元素化合价的变化规律。 4.掌握元素金属性、非金属性强弱的表现和递变规律。
第15讲物质结构元素周期律高三化学一轮复习课件

递变性
碱金属 (Li→Cs)
卤素(F→I)
与水反应越
来越 ___剧__烈___, 与氧气反应 越来越_剧__烈_, 产物越来越
与H2反应条 件要求越来 越_高___,生 成氢化物的 稳定性越来
复杂,还原 越_差_(_或__弱_)___
性逐渐 氧化性逐渐
___增__强_____ __减_弱_____
碱金属(Li→Cs)最高价氧化物的水化物碱性逐渐_增_强__
1.元素周期律:随着原子序数的递增,元素的性质呈现周期性变化 的规律。元素的性质包括原子半径、主要的化合价、金属性和非金 属性。元素性质的周期性变化是元素原子核外电子排布的周期性变 化生物必然结果。
2.金属性和非金属性 (1)元素金属性强弱的判断依据:
①金属单质与水(或酸)反应产生氢气的难易程度,与水(或酸)反应产 生氢气越容易,则元素的金属性越强;
物对应的水化物中化学性质明显不同于其他三种酸的是
(用酸的分子式表
示)。
四、板书设计
第15讲 物质结构 元素周期律(二)
(三)元素周期律 1.元素周期律 2.金属性和非金属性 (四)元素周期表 1.元素周期表的结构 2.元素性质与原子结构 3.“位、构、性”之间的关系
4.微粒半径大小的比较
(五)元素周期表的应用
相似性
碱金属
卤素
原子结构
最外层均为 __1__个电子
最外层均为 __7__个电子
元素性质
都具有强的 __金__属_性___,最
高正价都是 _+__1_价
都具有强的 非金属性 ,最
高正价都是 _+__7_价(F除外)
递变性
碱金属 (Li→Cs)
卤素(F→I)
电子层数逐渐_增__多_ 核电荷数逐渐_增__多_
高三化学第一轮复习教案基本概念和基本理论:元素周期律和周期表
高三化学第一轮复习教案基本概念和基本理论:元素周期律和周期表一、备考目标:1、掌握元素周期表的结构、元素周期律2、 学会用等量代换原理寻找等电子微粒3、比较各种简单微粒半径的大小.4、理解原子结构与元素周期律和周期表之间的内在联系。
二、要点精讲(一)元素周期表的结构:(1)周期:具有相同电子层的一系列元素列为一个周期:周期序数=原子核外电子层数(2)族:具有相同最外层电子数(主族)或价电子数(副族)的一系列元素称为一族.第一周期 (2种)三个短周期 第二周期(8种)第三周期(8种)七个周期 第四周期(18种) (七个横行) 三个长周期 第五周期(18种) 第六周期(32种) 一个不完全周期 第七周期(21种) 七个主族(ⅠA - ⅦA ) 十六个族 七个副族(ⅠB-- ⅦB ) (十八个纵行) 一个八族(Ⅷ)(含3个纵行)一个零族(稀有气体)主族元素:由长、短周期元素组成的族.主族序数=最外层电子数=元素最高正化合价 (非金属元素:8-|负化合价|).或 (非金属元素: 最高正化价+|负化合价| = 8零族元素:原子最外层电子已达稳定结构,故稀有气体在通常情况下难以发生化学反应:但与F 2可在一定条件下反应,生成如XeF 4等化合物,所以其惰性是相对的。
副族元素:全部由长周期元素组成的族.副族序数=价电子数=最高正化合价价电子:用来参与化学反应的最外层电子以及次外层或倒数第三层的部分电子.(二)性质递变规律:(1)同周期元素递变性:Na Mg Al与冷水反应: 剧烈 缓慢与热水反应: 更剧烈 明显且溶液呈碱性 元素周期表元素种数与H+(酸溶液)反应: 很剧烈剧烈较为缓和Mg(OH)2 Al(OH)3与酸(H+)反应:可溶(Mg(OH)2+2H+=Mg2++2H2O) 可溶(Al(OH)3+3H+=Al3++3H2O) 与碱(OH-)反应: 不溶可溶(Al(OH)3+OH-=AlO2-+2H2O)Si P S Cl与H2化合条件高温下,很少部分化合高温加热光照或点燃氢化物稳定性极不稳定不稳定较不稳定稳定最高氧化物 SiO2 P2O5 SO3 Cl2O7及其水化物 H4SiO4 H3PO4 H2SO4 HClO4酸性弱酸中强酸强酸最强的酸(水溶液中) 结论: Na Mg Al Si P S Cl金属性逐渐减弱, 非金属性逐渐增强(2)同主族元素递变性:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O周期非金属性逐渐增强1 金非稀2 属金有3 性属气4 逐性体5 渐逐元6 增渐素7 强增强小结:元素周期表中同周期,则主族元素性质的递变规律(三)构、位、性的相互关系性质位同化学性质同位近化学性质近主族最外层电子数=最高正价(除O、F)左→右递变性核电荷数和核外电子数决定电子得失能力主族序数=最外层电子数周期序数=电子层数(四)(五)比较微粒半径的大小无论是原子还是离子(简单)半径,一般由原子核对核外电子的吸引力及电子间的排斥力的相对大小来决定.故比较微粒半径大小时只需考虑核电荷数、核外电子排斥情况.具体规律小结如下:1. 核电荷数相同的微粒,电子数越多,则半径越大.即同种元素:阳离子半径<原子半径<阴离子半径如:H+<H<H-; Fe>Fe2+>Fe3+Na+<Na; Cl<Cl-2. 电子数相同的微粒,核电荷数越多则半径越小.即具有相同电子层结构的微粒,核电荷数越大,则半径越小.如:(1)与He电子层结构相同的微粒:H->Li+>Be2+(2)与Ne电子层结构相同的微粒:O2->F->Na+>Mg2+>Al3+(3)与Ar电子层结构相同的微粒:S2->Cl->K+>Ca2+3. 电子数和核电荷数都不同的微粒:(1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增.(2)同周期:原子半径从左到右递减.如Na>Cl(3)同周期元素的离子半径比较时要把阴阳离子分开.同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径.如Na +<Cl -如第三周期,原子半径最小的是Cl,离子半径最小的是Al 3+(4)如既不是同周期,又不是同主族,比较原子半径时,要寻找到合适的中间者.如Ge 、P 、O 的半径大小比较,可找出它们在周期表中的位置,( )中元素为中间者.(N ) O(Si ) PGe因为Ge >Si >P >N >O,故Ge >P >O(六)周期表的应用:(1)根据周期表中的位置寻找元素及新物质(农药、半导体、催化剂等)(2)预测元素的性质:① 比较不同周期,不同族邻位元素的性质;② 推知未知元素的某些性质;(3)判断气态氢化物的分子构型和分子极性:① 第ⅣA 族:4RH ——正四面体,非极性分子② 第ⅤA 族:3RH ——三角锥形,极性分子,3NH 溶于水呈弱碱性③ 第ⅥA 族:R H 2——折线形(V 型),极性分子,水溶液呈弱酸性(除O H 2)④ 第ⅦA 族:HR ——直线形,极性分子,水溶液呈强酸性(HF 为弱酸)三、知识点小结1、等电子微粒2、比较各种微粒半径的大小3、推断元素在元素周期表的位置典题分析:例1、(2008四川)下列叙述中正确的是( )A .除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B .除点周期外,其他周期均有18个元素C .副族元素中没有非金属元素D .碱金属元素是指ⅠA 族的所有元素解析:本题考查了元素周期表的有关知识。
高考化学一轮复习公开课PPT专题一物质结构元素周期律PPT
考向二 同分异构体、同素异形体、同位素概念辨析
[命题素材]
同分异构体
同素异形体
同位素
分子式相同,结构不同 同种元素组成的结构不同 质子数相同,中子数
概念 的化合物之间互为同分 的单质之间互为同素异形 不同的同原子间互为同位素
对象 一般为有机化合物之间
单质之间
化学性
相似,一定条件下可以相
解析 A 项,中子数为 18 的氯原子应表示为3157Cl,错误;B 项,N2 分子中 N 与 N
之间形成叁键,结构式为 N≡N,错误;C 项,Na+的结构示意图为
,错
误;D 项,H2O 为共价化合物,每个 H 原子和 O 原子之间共用一个电子对,正确。 答案 D
高考化学一轮复习教学PPT-专题一物 质结构 元素周 期律PPT -PPT执 教课件 【推荐 】
元素周期表结构的应用
[题目设计] 2.根据“族与周期的关系”推导下列1~20号元素(填元素符号)。
(1)主族序数与周期数相同的元素有________。 (2) 主 族 序 数 是 周 期 数 2 倍 的 元 素 有 ________ , 主 族 序 数 是 周 期 数 3 倍 的 元 素 有 ________。 (3)周期数是主族序数2倍的元素有________,周期数是主族序数3倍的元素有 ________。 答案 (1)H、Be、Al (2)C、S O (3)Li、Ca Na
高考化学一轮复习教学PPT-专题一物 质结构 元素周 期律PPT -PPT执 教课件 【推荐 】
3.原子结构示意图
高考化学一轮复习教学PPT-专题一物 质结构 元素周 期律PPT -PPT执 教课件 【推荐 】
电子层 质子数
高考化学一轮复习教学PPT-专题一物 质结构 元素周 期律PPT -PPT执 教课件 【推荐 】
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 例题2:镭是元素周期表中第ⅡA族元素, 下列关于镭的叙述不正确的是
• A 镭比钙的金属性更强 • B 在化合物中呈+2价 • C 镭是一种放射性元素 • D 氢氧化镭呈两性
• 2.核外电子排布: • (1)分层 • 层数 1 2 3 4 5 6 7 (n) • 符号 K L M N O P Q
• 离核由近到远,能量由低到高
• (2)电子的排布规律 • ①2n2 • ②最外层不超过8 • ③次外层不超过18 • ④能量最低原理
• 例题1.已知元素X、Y的核电荷数分别是a和 b,它们的离子Xm+和Yn-的核外电子排布相同, 则下列关系式正确的是
• (A)a=b+m+n
• (B)a=b-m+n
• (C)a=b+m-n
• (D)a=b-m-n
• 例题2. X元素的阳离子和Y元素的阴离子具 有与氩原子相同的电子层结构,下列叙述 正确的是
• (A)X的原子序数比Y的小 • (B)X原子的最外层电子数比Y的大 • (C)X的原子半径比Y的大 • (D)X元素的最高正价比Y的小
• 例题1:下列说法不正确的是[ ] • A.人们已经知道有112种元素,所以自然
界只有112种原子
• 因此氢原子与氧原子能结合成18种水分子 •
• D.O2和O3是由氧元素组成的两种同位素
• 例题2:某元素的一种同位素X原子的质量数 为A,含N个中子,它与1H原子组成HmX分 子,在ag HmX分子中含质子的物质的量是
• 例题3:已知溴在自然界中有两种同位素,这两 种同位素原子大约各占一半,已知溴的核电荷数 为35,溴元素的相对原子质量为80,则溴的这 两种同位素的中子数分别为
• A.79,81
• B.44,46
• C.45,46
• D.44,45ቤተ መጻሕፍቲ ባይዱ
• 例题4:两种微粒的质子数、电子数均相等, 它们不可能是
• A.一种阳离子和一种阴离子 • B.一种单质分子和一种化合物分子 • C.一种分子和一种离子 • D.一种原子和一种分子
• ①XYZ3、 ②X2YZ2、 • ④X2Y2Z2、 ⑤X2Y2Z4、 • 都存在的一组分子是
③X2YZ3、 ⑥X4Y2Z2中,
• A.①② B.④⑥ C.③⑤ D.②④
• 3、原子半径、离子半径大小比较: • (1)原子半径: • ①同周期主族元素的原子从左至右分别渐小。 • ②同主族元素的原子从上到下渐大。 • (2)离子半径: • ①一看电子层数(n) • 例如:Li+<Na+<K+;F-<Cl-<Br-。 • ②二看质子数(z) • 例如:O2->F->Na+>Mg2+>Al3+。 • ③三看电子数(e): • 阳离子<中性原子<阴离子 • 价态越高,阳离子半径越小。 • 例如:Fe3+<Fe2+<Fe;Cl<Cl-;H+<H<H-。
• 例题:元素X、Y、Z都是短周期元素,X的 阳离子,Y的阳离子和Z的阴离子都具有相 同的电子层结构,Y的阳离子半径小于X的 阳离子半径,则元素X、Y、Z的原子序数 由小到大的顺序依次是( )
• A.Z、Y、X
• B.Y、Z、X
• C.Y、X、Z
• D.Z、X、Y
• 二、元素周期律 • 1.定义:元素的性质随着原子序数的递增
而呈周期性的变化。
• 随原子序数的递增: • (1)最外层电子排布 • (2)原子半径。 • (3)化合价 • 起着周期性变化。
• 三、元素周期表:
• 1.结构:
• (1)七个横行即七个周期。
• 其中三短,(1、2、3周期)
•
三长,(4、5、6周期)
•
一不全。(第7周期)
周期数: 1 2 3 4 5 6 7 元素种类 2 8 8 18 18 32 26
• (2)18个纵列共16个族。 • 7主(A):IA-VIIA • 7副(B):IB-VIIB • VIII族(共3个纵列) • 1个零族。
• 原子结构与周期表的关系 ①主族: • 最高化合价=主族序数=最外层电子数
(价电子数) • 最低负价=主族序数–8 ②原子序数=核电荷数=核外电子数 ③周期序数=电子层数 ④主族序数=最外层电子数
还原性增强
• 3.周期表的应用:
• (1)预测元素的性质(由递变规律推 测)
• 不常见的主族元素(如砹、碲、铋、铅、 铟、镭、铯等),或尚未发现的主族元 素,推测该元素及其单质或化合物所 具有的性质。
• 例题1:已知元素砷As的原子序数为33, 下列叙述正确的是
• A 砷元素的最高化合价为+3 • B 砷元素是第四周期的主族元素 • C 砷原子的第3电子层含有18个电子 • D 砷的氧化物的水溶液呈强碱性
• 2.周期表的递变规律: (1)同一周期由左至右: ①原子半径减小 ②金属性减弱,非金属性增强; ③最高价氧化物对应水化物酸性增强,碱性减弱 ④气态氢化物稳定性增强,
其还原性减弱
(2)同一主族由上至下: ①原子半径增大 ②金属性增强,非金属性减弱。 ③最高价氧化物的水化物酸性减弱、碱
性增强; ④气态氢化物稳定性减弱
• 例题3.下列分子中所有原子均满足最外层8 电子结构的( )
• A.BeF2 • C.PCl5 • E.SF6
B.BF3
D.NF3 F.COCl2(光气)
• 例题 4:X、Y、Z三者均为短周期元素,已知X 元素有一种同位素不含中子,Y元素原子的最 外层电子数是次外层电子数的2倍,Z元素原子 的最外层电子数是次外层电子数的3倍。下列 化学式
• 1.10电子微粒:
• (1)分子:Ne、HF、H20、NH3、CH4。 • (2)阳离子:Mg2+、Na+、Al3+、NH4+、H30+ • (3)阴离子:N3-、O2-、F-、OH-、NH2-。 • 2.18电子微粒
• (1)分子:SiH4、PH3、H2S、HCl、Ar • F2 、 H2O2、N2H4、C2H6、CH4O
• (2)阳离子:K+、Ca2+、
• (3)阴离子S2-、HS-、Cl- 、 O22- 、 HO2-
基本理论
专题一 物质结构、元素周期律
• 一、原子结构: • 1.原子的组成:
• 思考: • (1)决定元素种类是什么因素? • (2)决定原子种类是什么因素? • (3)决定元素化学性质的主要因素是什么?
