Kumada偶联反应只是课件
偶联反应 课件

Miyaura, N. Cross-Coupling Reactions: A Practical Guide. Springer: 2002. Steven, V. L.; Thomas, A. W. Angew. Chem. Int. Ed. 2003, 42, 5400.
5
The general catalytic cycle
The Evolution of Cross-Coupling Reactions
偶联反应
2010年诺贝尔化学奖
2
偶联反应的用途
3
Comments
• …until the discovery and development of cross-coupling reactions starting in the 1970s, there were no simple, general direct methodologies known for C-C formation between unsaturated species … --- Peter J. Stang • …total synthesis has benefited enormously from the palladium-catalyzed crosscoupling reactions… --- K. C. Nicolaou • … somebodies in this field would win the
OPSS Lectures:
Preactivation [M]
R R' R X
Reductive Elimination [M]
R R'
Oxidative Addition [M]
R X
金属参与的现代有机合成反应(麻生明)课件class no. 3
Br
R
Ph Pd(PPh 3)4
R (17)
H
COOR Kto3luPeOn4e-3, H1020OoC
H COOR
Ph
O CONMe 2 CH 2N2/Pd(OAc) 2
Ph
B
O CONMe 2
Et2O
O CONMe 2 B
O CONMe 2
H2O
Ph
Pd(PPh 3)4
Ph
B(OH) 2
Kto3luPeOn4e-3, H1020OoC
8
Ph
9%
Bu
Ph 9
RPdXLn + NaOMe RH + PdL4
RPdOMeLn - CH2O
RPdHLn
Hex
Cl
+
BX2
Cl
Cl PdY (PPh3)2
Hex Cl
Cl
Cl
(9)
10
11
12
Y = OAc, OMe
Yes
Cl
No
RX Pd (0)
R'' R
16
RP dXL2 13
R'' 15 PdRL2
[ Pd ] LiCl
(36)
1. LDA 2. Tf2NPh
OT f
Me3Sn SiMe 3
SiMe 3
O
91 %
95:5
PdL4, LiCl 100 %
95:5 29
1. i-Pr2NMgBr 2. Tf2NPh
OT f
Me3Sn
SiMe 3
SiMe 3
63 %
97:3
PdL4, LiCl
偶联反应ppt总合演示文稿

1.反应对水不敏感; 2.可允许多种活性官能团存在; 3.可以进行通常的区域和立体选择性的反应; 4.硼试剂易于合成,稳定性好; 5.这类反应的无机副产物是无毒的且易于除去,可以保证其适用于实验室且可以用 于工业 化生产。
-CHO、-COCH3、-COOC2H5、-OCH3、-CN、-NO2、-F等官能团。
偶联反应ppt总合演示文稿
第1页,共48页。
偶联反应ppt总合
第2页,共48页。
概要
偶联反应基本概念 偶联反应基本类型
偶联反应基本应用
第3页,共48页。
基本概念
历史上碳基的研究获得的6次诺贝尔奖:
• 1912 Grignard Reaction,Victor Grignard(1871-1935), France
• 1950 Diels-Alder Reaction, Otto Paul Hermann Diels (1876- 1954), Kurt Alder(1902- 1958), Germany
• 1963 Ziegler-Natta catalyst, Karl Waldemar Ziegler ( 1898 – 1973), Germany, Giulio Natta (1903 - 1979), Italy
是有机合成中很重要的一个偶联反应,目前总数占到现在所有交叉偶联反应的一半以上。
1977 年Kosugi等首次报道了有关过渡金属钯催化的Stille反应。
➢最早发现的stille偶联反应是锡与酰氯的反应.
Kosugi, M.; Shimizu, Y.; Mifita, T. Chem. Lett. 1977, 1423.
N2+Cl- +
NaOH
Kumada偶联反应

应用
• 格氏试剂发生的自偶联反应很早就已知道。
关于格氏试剂与卤代烃之间偶联反应的研 究最早是在1971年,当时 Tamura 和 Kochi 发展了用银铜、和铁催化剂催化的 交叉偶联反应。
• 1972年,Kumada 等ቤተ መጻሕፍቲ ባይዱ道了格氏试剂(苯基
溴化镁)与芳卤或乙烯基卤在镍催化剂 NiCl2(dppe)2 作用之下交叉偶联为苯乙烯 的反应。
• 同年,Corriu 等发现苯基溴化镁与β-溴
苯乙烯在乙醚溶剂中和另一镍催化剂—— 乙酰丙酮合镍(II)催化之下,可得反-二苯 乙烯。
• 此后,1975年 Murahashi 等将此反应拓展
至钯催化。
Kumada偶联反应
• Kumada(交叉)偶联反应(熊田偶联;
Kumada coupling),又称Kumada-Corriu (交叉)偶联反应
• 烷基或芳基格氏试剂与芳卤或乙烯基卤在
镍或钯催化下的交叉偶联反应。反应产物 为苯乙烯衍生物。
反应机理
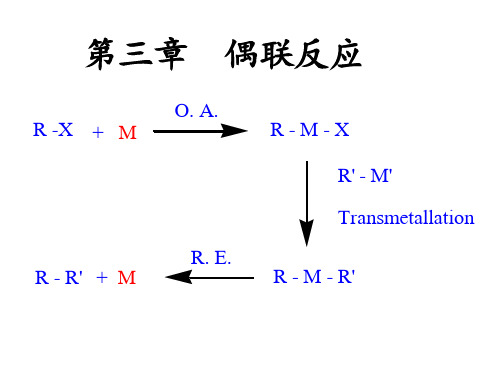
从右上顺时针旋转依次为:氧化加成、转金属、顺反异构化、还原消除。
金属有机化学 NO.3偶联反应

76%
>99
:
98
:
1
R
HC C - C - R' + Bu3SnH OH
AIBN
R' OH RC H
(27)
H SnBu3
AIBN
H
OH
R
+ Bu3SnH
(28)
OH
R SnR3
HC CCOOR + R'3SnH
OAc Tos
n - Bu3SnH AIBN
ROOC H
H +
SnR'3
major
SnMe3 (24)
(CH2)nX
1. Bu3SnMgCH3
R
cat. CuCN H 2. E+
RH (25)
E SnBu3
1. [Me3SnCu]Y R'OOC R
HR
R
COOR'
+
(26)
2. H+
H SnMe3 R'OOC SnMe3
Y = PhS (-48oC) 85%
2
Y = Br (-78oC)
n-C4H9 BX2 + Br
C6H13-n
C4H9
C6H13-n
49 % ( purity: 98 % )
(1) 催化量的钯 (2) 反应是区域及立体专一性的
(Regio- and Stereo-specific) (3) 碱的存在
Bu
Br
Bu
Me +
B (Sia)2
Ph
9%
Ph
8
9
RPdXLn + NaOMe RH + PdL4
kumada偶联反应的特点

kumada偶联反应的特点Kumada偶联反应是有机合成领域中常用的偶联反应之一,其特点是高效、宽广的底物适用性和产物多样性。
本文将从反应机理、反应条件和应用领域三个方面来详细解释Kumada偶联反应的特点,并进行扩展描述。
1. 反应机理:Kumada偶联反应是通过金属催化剂介导的反应,通常使用钯(Pd)作为催化剂。
首先,Pd(0)络合物与有机卤化物底物反应生成活性的Pd(0)物种,然后与有机铜试剂(通常是有机铜卤化物)反应生成Pd(II)配合物。
接着,Pd(II)配合物与另一个有机卤化物底物发生反应,生成Pd(IV)中间体。
最后,Pd(IV)中间体经过还原或消除反应生成偶联产物,并再生活性的Pd(0)催化剂。
2. 反应条件:Kumada偶联反应的反应条件相对温和,通常在常温下进行。
反应溶剂可以选择乙醇、二甲基亚砜(DMSO)等常见有机溶剂。
此外,反应过程中通常需要加入碱来中和形成的有机酸,常用的碱有碳酸钠、碳酸钾等。
3. 底物适用性:Kumada偶联反应对于底物的适用性非常广泛。
它可以将有机卤化物和有机铜试剂偶联成C-C键,形成芳香烃、烯烃、炔烃等多种有机化合物。
此外,Kumada偶联反应还可以实现对取代基的控制,例如通过选择不同的有机卤化物和有机铜试剂,可以引入不同的取代基,从而合成多样化的化合物。
4. 反应产物多样性:Kumada偶联反应可以合成多种有机化合物,包括但不限于芳香烃、烯烃、炔烃等。
通过选择不同的有机卤化物和有机铜试剂,可以引入不同的取代基和功能团,从而获得多样性的产物。
此外,Kumada 偶联反应还可以用于环构建反应,合成环状化合物。
扩展描述:Kumada偶联反应作为一种重要的偶联反应,在有机合成中有着广泛的应用。
首先,Kumada偶联反应可以用于合成药物分子。
许多药物分子中含有芳香烃结构或烯烃结构,Kumada偶联反应可以有效地构建这些结构,为药物的合成提供了一种可靠的方法。
偶联反应课件

PPT学习交流
16
Suzuki偶联反应的应用
3.含敏感功能团的芳基硼酸(酯)参与Suzuki偶联反应
含有易水解的基团(酯基,氰基等),可以在无水情况下反应
O B
Pd(3)P 4 Ph + ArX
O
K 3P4 O
CHO
PPT学习交流
14
Suzuki偶联反应的应用
普通操作 在水的存在下,加入催化剂、碱和有机溶剂,加热回流一段合理
的时间完成反应,但反应体系必须全程严格控制在无氧的环境下。
1.普通体系Suzuki偶联反应
PPT学习交流
15
Suzuki偶联反应的应用
2.大位阻芳基硼酸参与Suzuki偶联反应
收率低
解决措施:
PPT学习交流
11
有机硼试剂的合成 1.通过金属有机试剂制备单取代芳基硼酸
1.1.通过Grinard试剂制备单取代芳基硼酸
1.2.通过有机锂试剂制备单取代芳基硼酸
PPT学习交流
12
有机硼试剂的合成
2.通过二硼烷频哪酯制备芳基硼酸酯
对于分子中带有酯基、氰基、硝基、羰基等官能团的芳香卤代物来说, 无法通过有机金属试剂来制备相应的芳基硼酸。
Substrate Coupling Partner ......?) Coupling Product Metal Halide
(Organic (Organometallic Electrophile) Nucleophile)
R = Alkyl, aryl, vinyl, allyl, alkynyl, benzyl R' = Alkyl, aryl, vinyl, allyl, alkynyl, benzyl, acyl X = I, Br, Cl, OTf, OTs M = Mg, Zn, Cu, Sn, Si, B,...... Cat. = Pd, Ni, others Cu Fe......
最新Kumada偶联反应课件PPT

• 但无论什么风格,苏轼首肯的是有自然之姿的作品。 他十分注重书法的神采、骨力、意韵等,他赞美颜 真卿的字“清雄”、“清远”,评论永禅师的书法 “骨气深稳,体兼众妙,精能之至,反造疏淡”, 评论张旭草书“颓然天放,略有点画处,而意态自 足,号称神逸”,评禇遂良的字“清远萧散”,评 欧阳修的字“神采秀发,膏润无穷”,评秦少游的 字“有东晋风味”,都可看出他在书法风格上的美 学追求,他追求这样一种“清水出芙蓉,天然去雕 饰”的冲和淡远、自然萧散的风格。这种风格和中 国古代从清真到平淡的自然风尚是一致的。
• 此后,1975年 Murahashi 等将此反应拓展
至钯催化。
苏轼书法浅析
——苏轼书法, 到底好在哪里?
• 苏轼(1037年1月8日-1101年8月24日), 字子瞻,又字和仲,号东坡居士,眉州眉山 (今四川眉山市)人,中国北宋文豪,“唐 宋八大家”之一。其诗,词,赋,散文,均 成就极高,且善书法和绘画,是中国文学艺 术史上罕见的全才,也是中国数千年历史上 被公认文学艺术造诣最杰出的大家之一。其 散文与欧阳修并称欧苏;诗与黄庭坚并称苏 黄,又与陆游并称苏陆;词与辛弃疾并称苏 辛;其画则开创了湖州画派。现存诗3900余 首,代表作品有《水调歌头·中秋》、《赤 壁赋》、《念奴娇·赤壁怀古》、【游山西 村】等
• 苏轼在书法美学思想方面强调笔墨寓意深刻,透露 出深厚的文人学养。追求含蕴丰富的意境。并能将 线条、文辞与意境完美结合起来。崇尚一种“清水 出芙蓉,天然去雕饰”的冲和淡远、自然萧散的艺 术风格。
谢谢观看!
用笔之法:
• 一:不刻意求工 • 二:偏侧锋 • 三: 横细竖粗 • 四:笔力凝重
文辞完美地结合起来。苏书追求 一种“清水出芙蓉,天然去雕饰” 的冲和淡远、自然萧散的风格, 其书法美学思想对后世影响深远”之首,其成就十分显著。 苏书从“二王”、颜真卿、柳公权、褚遂良、徐浩、 李北海、杨凝式各家吸取营养,在笔墨寄情、意境 营造和风格评价方面颇多新意,体现出丰富的美学 思想,对后世影响深远。依笔者浅见,苏轼书法的 美学思想主要体现在以下三方面:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 同年,Corriu 等发现苯基溴化镁与β-溴
苯乙烯在乙醚溶剂中和另一镍催化剂—— 乙酰丙酮合镍(II)催化之下,可得反-二苯 乙烯。
• 此后,1975年 Murahashi 等将此反应拓展
至钯催化。持,我们努力做得更好!谢谢
Kumada偶联反应
反应机理
从右上顺时针旋转依次为:氧化加成、转金属、顺反异构化、还原消除。
应用
• 格氏试剂发生的自偶联反应很早就已知道。
关于格氏试剂与卤代烃之间偶联反应的研 究最早是在1971年,当时 Tamura 和 Kochi 发展了用银铜、和铁催化剂催化的 交叉偶联反应。
• 1972年,Kumada 等报道了格氏试剂(苯基
