第四章 多组分系统热力学
第4章 多组分热力学

前面所讨论的是:单组分单相(两相)系统或多 组分组成恒定的系统。 但常见系统绝大部分是:多组分变组成系统。因 此必须研究处理多组分系统。
多组分系统除了两个变量之外,还需确定各组分 的物质的量才能确定系统的状态。 多组分系统分为:单相、多相
本章主要讨论多组分单相系统。
1
第四章 多组分系统热力学
B
dA SdT pdV BdnB
B
•适用条件 W ' 0 ,单相系统
31
2.多组分单相系统的热力学公式
•广义定义
B
U nB
S ,V ,nC
H nB
S , p,nC
A nB
T ,V ,nC
G nB
T , p,nC
保持特征变量和除B以外其它组分不变,某热力
学函数随其物质的量 nB的变化率称为化学势。
2 偏摩尔量相对于某一组分而言,本身是强度量;
3 偏摩尔量与浓度有关,与系统的总量无关。
4 偏摩尔量 X B ( nX,B )下T ,标p,n必C 须是
。T , p, nC
15
2.偏摩尔量
•偏摩尔量的物理意义
•两种理解 1 在恒温恒压下,于极大量的某恒定组成的系统中加
入1mol组分B时所引起系统广度量X的改变量。
混合物的摩尔体积:
Vm
xB M B /
B
Vm xBVB
B
21
5.吉布斯—杜亥姆方程
X
X
dX
( T
) p,nB
dT
(
p
)T ,nB
dp
B
X BdnB
•恒温恒压多组分系统
dX X BdnB
B
第四章 多组分系统1

B B B B B
B
(2)
此式与前式相减得:
n dX 0 除以 n= n → x dX 0
等TP,
B
B
B
B
B
B
B
——吉布斯-杜亥姆方程
B
例:
二组分系统, nAdX A nB dX B =0
或
xAdX A xB dX B =0
5.偏摩尔量间函数关系
H B = U B p VB
G=G(T,P,nA,nB,……nk)
G G ) P ,n dT + ( )T , n dP dG= ( T P
+
B A
k
G ( )T , P,nC dnB nB
G G 组成不变:有 ( ) P,n S, ( )T ,n V T p
dG=-SdT+VdP+
B
G 定义式:μ B= ( )T , P ,nC nB
X 引起系统容量性质 dX 的改变值 ( )T , p ,nC nB
注意:
1)必须在等 TP 下的偏微商
其它条件下不是偏摩尔量
X XB =( )T , p ,nC nB
GB
X ( )T ,V ,nC ≠ X B nB
G ( )T ,V ,nC nB
=
G ( )T , p ,nC nB
k
Z Z dp dZ= ( ) p ,nA ,nB ,n C nk dT + ( ) p T Z Z )T , p ,nA ,nC nK dnB +( ) p ,nB ,n C nk dnA + ( nB nA Z + ……+ ( )T , p ,nA ,nB , nk 1 dnk nk
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
hx04多组分系统热力学

VB def
V n B T , p,nC(CB)
U B def
U n B T , p,nC(CB)
H B def
H n B T , p,nC(CB)
SB def
S n B T , p,nC(CB)
AB def
A n B T , p,nC(CB)
GB def
G n B T , p,nC(CB)
上一内容 下一内容 回主目录
返回
2024/7/4
4.2.2 偏摩尔量的定义
(4) 偏摩尔量是两个广度性质X、nB之比,因此它是一强度性质,与体积的量无关。
上一内容 下一内容 回主目录
返回
2024/7/4
4.2.3 偏摩尔量的加和公式
已知
k X
dX
B=1
nB
T , p,nC(CB)
dnB
量和除B以外的其他组分不变时,热力学函数对B 物质的量求偏导。
上一内容 下一内容 回主目录
返回
2024/7/4
4.3.2 化学势的定义
把化学势的广义定义代入热力学函数的微分式:
dU TdS pdV BdnB B
dH TdS Vdp BdnB B
dA SdT pdV BdnB B
溶剂,含量少的称为溶质。
上一内容 下一内容 回主目录
返回
2024/7/4
4.1.2 多组分系统的组成表示法
1. B的物质的量浓度
cB def
nB V
溶质 B 的物质的量与溶液体积V 的比
值称为溶质 B 的物质的量浓度,或称为溶
质 B 的浓度.
物质的量浓度的单位 mol ×m-3
或
mol ×dm-3
第四章 多组分系统1

3.物质的量浓度cB(molarity, Substance amount concentration )
cB
def
nB V
溶质B的物质的量与溶液体积V的比值称为溶质 B的物质的量浓度,或称为溶质B的浓度,单位是 。 mol m3,但常用单位是 mol dm3
4.质量分数wB(mass fraction)
偏摩尔焓
T ,p ,n C
偏摩尔熵
T ,p ,n C
偏摩尔亥姆霍兹函数
T ,p ,n C
偏摩尔吉布斯函数
T ,p ,n C
设X代表多组分系统中任一广度性质 X = f ( T, p, n1, n2,…)
X X X X dX dn1 dn2 dT p dp n n T p,ni T ,ni 1 T , p , n j 1 2 T , p , n j 2
B
另一方面,由于恒温、恒压下 X =
å
B
n BX B ,则
B
dX =
邋n BdX B +
B
X B dn B
因此:在等T,p条件下:
å
n B dX B = 0 或
B
å
x B dX B = 0
B
此即吉布斯 − 杜亥姆方程。该方程指出,系统中各组分的 偏摩尔量并非完全独立,而是相互依存的。 (1) 对二元溶液
G B = H B - T S B = U B - T S B + T S B = A B + pV B
G (抖 B
p ) = VB T
G (抖 B
T )p = - S B
A nB AB
物理化学4 多组分体系热力学 1

几点说明
(1)偏摩尔量只对体系中某组分才具有的,对整体而 言无所谓偏摩尔量的概念; (2)只有体系的广度性质才有偏摩尔量(质量除外) ; (3)偏摩尔量本身是强度性质; (4)注意右下角标的条件; (5)任何偏摩尔量都是T、p、组成的函数; (6)纯物质的偏摩尔量就是摩尔量; (7)偏摩尔量可能是负值。 (8)偏摩尔量是1mol B对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
分类
气态混合物:空气 混合物液态混合物:甲醇 + 乙醇 固态混合物:Cu + Ni 气态溶液:萘溶解于高压CO 2中 非电解质溶液:糖水 − − − 本章 溶液液态溶液 电解质溶液:盐水 - - -电化学 固态溶液:单体溶解于聚合物中 − − − 又称固溶体
§4-2 化学势 化学势μ μB
• 4-2-1 化学势定义 • 4-2-2 平衡判据与平衡条件 • 4-2-3 理想气体的化学势表达式
4-2-1 化学势定义
混合物或溶液中,组分B的偏摩尔吉布斯函数 GB在化学热力学中有特殊的重要性,又把它叫 做化学势,用符号μB表示。
∂G µ B = GB = ∂nB T , p ,nc≠B
dX = ∑ X B dnB
B =1 k
( 2)
• 可得Gibbs-Duhem方程:
∑ n dX
B B=1
k
B
=0
∑ x dX
B B=1
k
B
=0
Gibbs-Duhem方程的意义: (1) 某一偏摩尔量的变化可从其它偏摩尔量的变 化中求得。 (2) 对一个含有K个组分的均相体系,K个偏摩 尔量Xi中,只有 K-1个是独立的。
如果在溶液中不按比例地添加各组分,则溶液浓 度会发生改变,这时各组分的物质的量和偏摩尔量均 会改变。 根据集合公式
第4章多组分系统热力学分解

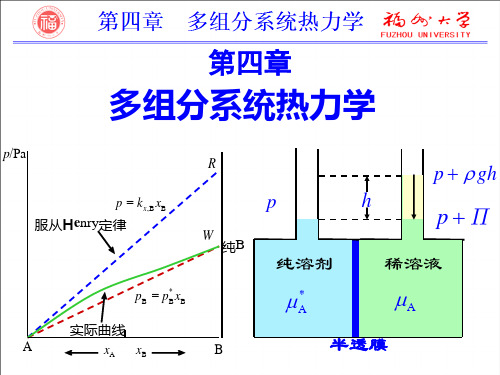
p/Pa
R
p gh
p
p = kx,B xB 服从Henry定律
h
W
pP
稀溶液
纯B
纯溶剂
* A
* pB = pB xB
A
半透膜
A
实际曲线 xA xB
B
基本内容
§ 4.1 § 4.2 § 4.3 § 4.4 § 4.5 § 4.6 § 4.7 § 4.8 § 4.9 偏摩尔量 化学势 气体组分的化学势 逸度及逸度因子 拉乌尔定律和亨利定律 理想液态混合物 理想稀溶液 活度与活度因子 稀溶液的依数性
GB 骣 ¶G 琪 =琪 桫 ¶n B
T ,p ,n C
因此:
T ,n B
禳 骣 镲 ?G 镲 琪 = 睚 琪 ?nB 镲 镲 铪p桫 禳 镲 抖 骣G 镲 琪 = 睚 琪 桫p 抖 n 镲 B 镲 铪 骣 ¶V 琪 =琪 桫 ¶n B
T ,p ,n C T ,n B
T ,n B T ,p ,n C
V nBVm , B nCVm ,C
理想混合溶液
★将0.5摩尔的水与0.5摩尔的乙醇混合,溶液体积:
V≠(0.5×18.09十0.5×58.35)cm3 =38.22cm3 =37.2cm3
实际混合溶液 V nBVm n V ,B C m,C
★乙醇与水溶液混合的体积与浓度的关系
多组分系统可以是单相的也可以是多相的。
但对多组分多相系统可以拆解为多个多组分单相系统来研究。
多组分单相系统:是由两种或两种以上物质以分子大小粒
子相互均匀混合成一相的系统。
混合物——系统中的各组分以同等条件予以研究 溶 液——系统中的组分区分为溶剂和溶质予以研究
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 多组分系统热力学4.1 有溶剂A 与溶质B 形成一定组成的溶液。
此溶液中B 的浓度为c B ,质量摩尔浓度为b B ,此溶液的密度为。
以M A ,M B 分别代表溶剂和溶质的摩尔质量,若溶液的组成用B 的摩尔分数x B 表示时,试导出x B 与c B ,x B 与b B 之间的关系。
解:根据各组成表示的定义()/B BB cBB B BB R RR BA B A Bx n n x c x MV M n x M M M x ρρρ===⎛⎫⎪⎝⎭=+-∑∑∑()()BBB A A B B A B A B x x c x M x M M M M x ρρ==++-⎡⎤⎣⎦()001BB B B cc c A A A AR Rn n x b m x M x M x M →→====-∑∑4.2 D-果糖()6126C H O B 溶于水(A )中形成的某溶液,质量分数0.095B w =,此溶液在20℃时的密度31.0365/Mg m ρ-=。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为()B B B B BB A B A A B B A B B A m nx M x M w m m nx M nx M M x M M ===+++-()()0.09518.0152180.15720.095180.157218.01520.0104B B B B B B A w M x M w M M ⨯==---⨯-=()()331.0365100.010418.01520.0104180.157218.01520.547BB A BA B x c M M M x mol dm ρ-⨯⨯==+⨯-+-⎡⎤⎣⎦=⋅()()10.01040.583110.010418.0152B B B A x b molKg x M -===--⨯4.3 在25℃,1 kg 水(A )中溶有醋酸(B ),当醋酸的质量摩尔浓度b B 介于10.16mol kg -⋅和12.5mol kg -⋅之间时,溶液的总体(){}(){}2311/1002.93551.832/0.1394/B B V cm b mol kg b mol kg --=+⋅+⋅(1) 把水(A )和醋酸(B )的偏摩尔体积分别表示成b B 的函数关系。
(2) 11.5B b mol kg -=⋅时水和醋酸的偏摩尔体积。
解:根据定义,,,,,,A AAB B B B B T P n T P n T P n b V V V n b n ⎛⎫⎛⎫⎛⎫∂∂∂==• ⎪ ⎪⎪∂∂∂⎝⎭⎝⎭⎝⎭1,,1AB B T P n b kg n -⎛⎫∂= ⎪∂⎝⎭()31131/151.8320.2788/D D V cm mol b mol kg cm mol ---⎡⎤=⨯+⋅⎣⎦{}2111000/18.015218.01521002.9350.1394/1000B B B BA AB V n V V kgb V V n b mol kg ---==⎡⎤=-⎢⎥⎣⎦g {}2131A V 18.0681 1.0025/B b mol kg cm mol --⎡⎤=-⋅⋅⎢⎥⎣⎦当11.5B b mol kg -=⋅时[]31351.8320.2788 1.552.25B V cm mol cm -=+⨯⋅=231318.06810.0025 1.518.0625A V cm mol cm -⎡⎤=-⨯⋅=⎣⎦4.4 60℃时甲醇的饱和蒸气压是84.4 kPa ,乙醇的饱和蒸气压是47.0 kPa 。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 °C 时此混合物的平衡蒸气组成,以摩尔分数表示解:质量分数与摩尔分数的关系为()B BB B B B A w M x M w M M =--求得甲醇的摩尔分数为0.546.06880.589832.0420.514.0268B x ⨯==+⨯根据Raoult 定律()()()()()()()()()3333332510.589883.40.589883.410.589847.00.7184x CH OH P CH OH y CH OH x CH OH P CH OH x CH OH P C H OH ***=+-⨯=⨯+-⨯=()2510.71840.2816y C H OH =-=4.5 80 °C 是纯苯的蒸气压为100 kPa ,纯甲苯的蒸气压为38.7 kPa 。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 °C 时气相中苯的摩尔分数()0.300y =苯,求液相的组成。
解:根据Raoult 定律()()()()()()()()1x P y x P x P ***=--苯甲苯苯苯甲苯苯甲苯()()()()()()()()0.30038.71000.30038.71000.142y P x P y P P ****⨯==+⨯-⎡⎤+-⎣⎦=苯甲苯苯苯苯甲苯苯()()10.858x x =-=甲苯苯4.6 在18 °C ,气体压力101.352 kPa 下,1 dm 3的水中能溶解O 2 0.045 g ,能溶解N 2 0.02g 。
现将 1 dm 3被202.65 kPa 空气所饱和了的水溶液加热至沸腾,赶出所溶解的O 2和N 2,并干燥之,求此干燥气体在101.325 kPa ,18 °C 下的体积及其组成。
设空气为理想气体混合物。
其组成体积分数为:()00221O ϕ=,()00279N ϕ=解:显然问题的关键是求出O 2和N 2的Henry 常数。
18 °C ,气体压力101.352 kPa 下,O 2和N 2的质量摩尔浓度分别为()3120.045 1.40610131.9988molb O mol kg kg --==⨯⋅ ()4120.027.13910128.0134molb N mol kg kg --==⨯⋅这里假定了溶有气体的水的密度为11mol dm -⋅(无限稀溶液)。
根据Henry 定律,1 dm 3被202.65 kPa 空气所饱和了的水溶液中O 2和N 2的质量摩尔浓度分别为()()()()2222322121410.21202.651.40610101.3255.905210x b y O P y O P b O b O k P mol kg ---⨯===⨯=⨯⋅,()()()()2222422121310.79202.657.13910101.3251.12810x b y O P y N P b N b N k P mol kg ---⨯===⨯=⨯⋅,()33530.5905 1.128108.314291.15101.3251041.11041.1nRT V P m cm ---+⨯⨯⨯==⨯=⨯=()()()()422322 5.9052100.52361.12310y b O y N b N --⨯===⨯22O()()0.6560.343y N y O ==22,4.7 20 °C 下HCl 溶于苯中达平衡,气相中HCl 的分压为101.325 kPa 时,溶液中HCl 的摩尔分数为0.0425。
已知20 °C 时苯的饱和蒸气压为10.0 kPa ,若20°C 时HCl 和苯蒸气总压为101.325kPa ,求100 g 笨中溶解多少克HCl 。
解:设HCl 在苯中的溶解符合Henry 定律()()()()()()()11101.325100.04250.03831101.325p x P HCl x HCl x HCl P HCl k HCl P HCl -===⨯=,()()()()()()()()1n HCl n benzene x HCl x HCl n HCl n HCl n benzene x HCl =⇒=+-()()()()()()()()1x HCl n benzene M HCl m HCl n HCl M HCl x HCl M benzene ==-()0.0383110036.461.85910.383178.114m HCl g⨯==-4.8 H 2, N 2与100 g 水在40 °C 时处于平衡,平衡总压为105.4 kPa 。
平衡气体经干燥后的组成分数()00240H ϕ=。
假设可以认为溶液的水蒸气压等于纯水的蒸气压,即40 °C 时的7.33kPa 。
已知40 °C 时H 2, N 2在水中的Henry 系数分别为7.61 GPa 及10.5 GPa ,求40 °C 时水中溶解H 2, N 2在的质量。
解:假设(1)H 2, N 2在水中的溶解符合Henry 定律;(2)气相可看作理想气体。
在此假设下()()()()2222x x P H k x H P N k x N ==,()()()()()()()222222223P H H P H P N P P H O P N N ϕϕ==+=-,()()()()22223255P P H O P P H O P N P H --⎡⎤⎡⎤⎣⎦⎣⎦==, ()[]6262105.47.33 5.15481057.6310x H -⨯-==⨯⨯⨯()[]6263105.47.33 5.60410510.510x N -⨯-==⨯⨯⨯()()()()()()()2222222n N n H x N n H n N n H O n H O =≈++()()()222n H x H n H O ≈()()()()222261005.154810 2.015957.6818.015m H x H n H O M H g μ-≈=⨯⨯⨯=()()()()222261005.6041028.013871.418.015m N x N n H O M N g μ-≈=⨯⨯⨯=4.9 试用Gibbbs-Duhem 方程证明在稀溶液中若溶质服从Henry 定律,则溶剂必服从Raoult 定律。
证明:设溶质和溶剂分别用B ,A 表示。
根据Gibbbs-Duhem 方程B B A A x d x d μμ=-(const. T and const. p )。
溶质B 的化学势表达式为ln lnBB B B B B P RT a RT P μμμ*=+=+B x B B P k x =, ,ln lnx B B B B B B B k x RT a RT P μμμ*=+=+,()B B BRTd dx constT and const P x μ⋅⋅=ln B A B A AA B Ax RT RTd dx dx RT x x x x μ=-==ln A A A RT x μμ=+AA A A A AAP a x P x P P ==⇒=即溶剂A 服从Raoult 定律。
