免疫疗法抗性与突变有关Mutations Linked to Immunotherapy Resistance
Nature:一文揭示182个癌症免疫疗法潜在靶点(附详细清单)

Nature:一文揭示182个癌症免疫疗法潜在靶点(附详细清单)在过去10年里,以检查点抑制剂和过继细胞疗法为代表的免疫治疗兴起,彻底改变了某些类型癌症的治疗。
然而,一个不可忽视的事实是,现有的免疫疗法只能在一小部分患者中产生持久的响应,并不是对所有肿瘤类型都有效。
为了使这类革命性的疗法能够挽救更多癌症患者的生命,一些科学家团队致力于进一步研究癌症的内在免疫逃逸机制,以期发现更多可用的免疫治疗靶点。
来源:Nature9月23日,发表在Nature杂志上的一项研究中,由多伦多大学分子遗传学教授Jason Moffat带领的团队取得了一项突破进展。
他们成功绘制了调控癌细胞逃避免疫系统杀伤的基因图谱,鉴定出了182个核心的癌症固有免疫逃逸基因。
该研究成果为开发可为更多患者以及不同肿瘤类型所用的免疫疗法铺平了道路。
绘制参与癌症固有CTL逃逸的核心基因和通路图谱(来源:Nature)具体来说,研究中,科学家们在6种从遗传学角度不同的肿瘤模型中寻找调节免疫逃逸的基因,这些模型源自乳腺癌、结肠癌、肾癌和皮肤癌。
癌细胞与被工程改造可杀伤它们的T细胞被置于培养皿中。
最初的杀伤结果作为基线。
接下来,研究人员使用基因编辑工具CRISPR逐个关闭癌细胞中的每个基因,并分析与基线杀伤结果的差异。
最终,研究人员找到了182个核心的癌症固有免疫逃逸基因(具体见下表),这些基因的缺失可使癌细胞对T细胞的攻击更加敏感或更加耐药。
许多被发现的基因先前未被报道与免疫逃逸有关。
表1 182个核心固有免疫逃逸基因数据来源:Nature“这真的非常令人兴奋。
因为这意味,我们的数据集中包含了非常丰富的新的生物学信息。
”论文共同一作Keith A. Lawson博士说。
值得一提的是,这项研究还获得了一些颠覆先前认知的发现。
比如,此前,参与自噬的基因被认为是免疫逃逸的关键,因此有观点认为,通过靶向自噬基因,可提高癌症对免疫疗法的敏感性。
但该研究显示,成对的删除某些自噬基因反而会使癌细胞抵抗T细胞的杀伤。
基因突变对肿瘤免疫治疗的影响

基因突变对肿瘤免疫治疗的影响在医学领域中,对肿瘤的治疗一直是一个难题。
随着科技和医学的不断发展,肿瘤免疫治疗成为了一个备受关注的新领域。
然而,尽管肿瘤免疫治疗已经取得了某些进展,但它仍面临着许多挑战,其中之一就是基因突变的影响。
基因突变是肿瘤疾病的一个常见问题,它会对免疫治疗的成功产生不良影响。
免疫治疗通过抑制肿瘤细胞并加强人体免疫系统来治疗肿瘤疾病。
这对于基因突变的肿瘤患者来说通常效果不佳,因为基因突变会影响免疫治疗的效果。
基因突变会影响肿瘤细胞的免疫原性,从而减弱免疫系统对肿瘤的攻击性。
这是因为基因突变会改变肿瘤细胞分泌的蛋白质和其他化合物。
这些改变会减少肿瘤细胞表面上的抗原,这些抗原是免疫系统攻击肿瘤细胞所需的。
此外,基因突变也会对肿瘤微环境产生影响。
肿瘤微环境是肿瘤细胞周围的组织和细胞的集合,它对肿瘤细胞的生存和增殖起着重要的作用。
基因突变会改变肿瘤微环境中的化合物和细胞类型,这将使得肿瘤细胞更加难以被免疫系统攻击和消灭。
基因突变还可能影响肿瘤细胞的生长因子信号通路,这会导致肿瘤细胞对免疫治疗产生抗性。
如何克服基因突变对免疫治疗的影响是当前的主要挑战之一。
一些研究人员已经开始尝试使用免疫治疗以及其他形式的治疗来影响肿瘤微环境。
这些方法的目的是使肿瘤微环境更有利于免疫细胞攻击肿瘤细胞。
除此之外,研究人员还在探索基因编辑技术的潜力。
这些技术可以编辑肿瘤细胞中的基因,以改变肿瘤细胞的行为并增强其免疫原性。
基因编辑技术对肿瘤免疫治疗的研究热度不断上升,相信它有望为肿瘤免疫治疗带来新的突破。
然而,需要注意的是,基因编辑技术目前仍处于确立安全性和效能的初期阶段。
此外,基因编辑技术的费用比较高,仍存在着许多需要克服的障碍。
另一个重要的方法是使用多种抗肿瘤药物的组合治疗。
这些方法可以用来减轻基因突变对免疫治疗的影响,同时还可以增强肿瘤细胞受到的攻击和破坏。
这样一来,肿瘤细胞会变得更加易于被免疫系统识别和消除。
基因突变与药物抗性的关系

基因突变与药物抗性的关系基因突变与药物抗性之间存在密切关联,突变可以引发药物耐药性的发展。
本文将探讨基因突变对药物抗性的影响,并探讨相关的研究和应用。
一、基因突变的概念和影响基因突变是指DNA序列发生的改变,这些改变可能发生在一个或多个基因上,并且会导致蛋白质产生异常。
这些异常可能影响细胞的正常功能和代谢过程。
基因突变对药物抗性的影响主要体现在以下几个方面:1. 突变导致药物靶点变异:药物通常通过与靶点相互作用来发挥作用。
然而,基因突变可以导致靶点的序列变异,使药物难以与其结合,从而减弱药物的疗效。
2. 突变诱导药物转运蛋白改变:药物转运蛋白负责将药物从细胞内部转运出去。
基因突变可以导致转运蛋白的结构或功能异常,使药物无法从细胞内有效地排出,从而增加了细胞对药物的暴露时间,降低了药物的疗效。
3. 突变增强DNA修复和解毒机制:基因突变可能使细胞的DNA修复和解毒机制得到增强,从而使细胞对药物的损伤能力降低,导致药物失去对细胞的杀伤作用。
4. 突变导致药物代谢途径改变:细胞内的代谢途径负责将药物转化为更易排出的代谢产物。
基因突变可能改变代谢途径,使药物代谢减缓,降低其疗效。
二、基因突变和药物抗性的研究进展近年来,随着高通量测序等技术的发展,人们对基因突变和药物抗性之间关系的研究取得了重要进展。
以癌症为例,研究人员通过对肿瘤样本进行基因测序,并与患者用药情况进行关联分析,发现了一些特定基因突变与药物抗性之间的紧密联系。
这些研究结果为个体化药物治疗提供了重要的依据。
此外,基因突变与药物抗性的研究还涉及到药物的研发和筛选。
通过对已知的基因突变进行分析,科学家可以设计并筛选出对特定基因突变具有更高选择性和疗效的药物。
这为药物研发提供了新的思路和方法。
三、基因突变和药物抗性的临床应用了解基因突变与药物抗性之间的关系对临床应用和治疗方案的制定具有重要意义。
个体化医疗已成为当前医学的热点方向,通过对患者基因突变的检测,可以预测其对某些药物的敏感性或抗性。
基因突变与免疫系统解读自身免疫性疾病

基因突变与免疫系统解读自身免疫性疾病基因突变与免疫系统:解读自身免疫性疾病基因突变是指生物个体基因发生错误或变异,导致DNA序列的改变或基因功能的损失。
这些突变可以对免疫系统产生重要影响,进而引发自身免疫性疾病。
本文将探讨基因突变与免疫系统的关系,以及突变如何诱发自身免疫性疾病的机制。
一、基因突变与免疫系统的关联基因突变是免疫系统性疾病的重要因素之一。
一些免疫相关基因的突变可以导致免疫系统失调,进而引发自身免疫性疾病。
以类风湿性关节炎(RA)为例,研究发现HLA-DR4基因突变与RA的发病风险相关。
HLA-DR4突变会导致T细胞与抗原的异常相互作用,最终激活自身免疫反应,导致RA的发生。
此外,基因突变还可以影响免疫系统中的信号传导通路,导致自身免疫性疾病的发生。
例如,研究表明,在系统性红斑狼疮(SLE)患者中,IRF5基因突变可以导致炎症相关信号传导通路的错误激活,从而诱发免疫系统异常。
二、突变诱发自身免疫性疾病的机制基因突变引起的自身免疫性疾病机制复杂多样。
一种机制是突变导致免疫系统对自身组织发生错误的免疫应答。
这通常涉及到自身抗原的认知和T细胞活化过程。
例如,在糖尿病中,胰岛素抗原被错误地识别为外来抗原,进而激活T细胞,导致胰岛细胞的破坏。
另一种机制是突变引发的免疫调节失调。
免疫系统正常情况下能够区分自身和非自身抗原,并保持免疫平衡。
然而,基因突变可能导致免疫调节失常,使得免疫系统对自身组织产生破坏性反应。
在多发性硬化症中,基因突变导致免疫调节细胞功能异常,无法抑制自身免疫反应,从而引发中枢神经系统的损伤。
此外,突变还可以直接影响免疫细胞的功能,使其对病原体或自身抗原产生异常反应。
例如,IL-10基因突变可以导致炎症介质的过度释放,引发炎症反应,导致免疫系统异常,增加患自身免疫性疾病的风险。
三、基因突变与免疫治疗研究的前景基因突变的识别对于预防和治疗自身免疫性疾病具有重要意义。
了解基因突变与免疫系统之间的关系,可以帮助研究人员设计针对特定突变的个体化治疗方案。
肿瘤免疫治疗的耐药机制
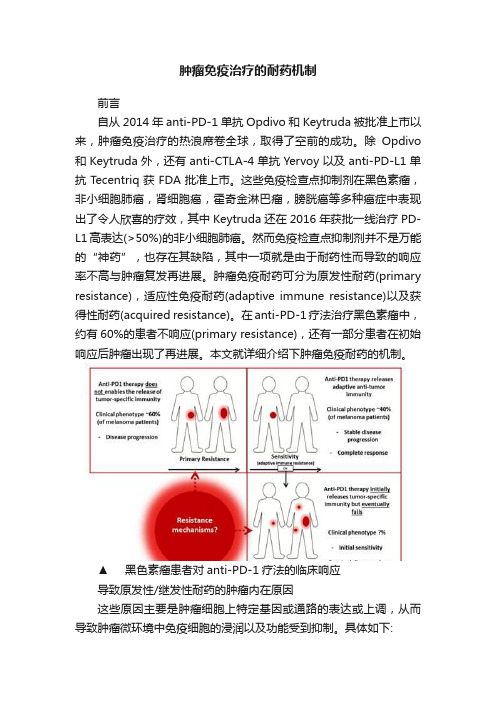
肿瘤免疫治疗的耐药机制前言自从2014年anti-PD-1单抗Opdivo和Keytruda被批准上市以来,肿瘤免疫治疗的热浪席卷全球,取得了空前的成功。
除Opdivo 和Keytruda外,还有anti-CTLA-4单抗Yervoy以及anti-PD-L1单抗Tecentriq获FDA批准上市。
这些免疫检查点抑制剂在黑色素瘤,非小细胞肺癌,肾细胞癌,霍奇金淋巴瘤,膀胱癌等多种癌症中表现出了令人欣喜的疗效,其中Keytruda还在2016年获批一线治疗PD-L1高表达(>50%)的非小细胞肺癌。
然而免疫检查点抑制剂并不是万能的“神药”,也存在其缺陷,其中一项就是由于耐药性而导致的响应率不高与肿瘤复发再进展。
肿瘤免疫耐药可分为原发性耐药(primary resistance),适应性免疫耐药(adaptive immune resistance)以及获得性耐药(acquired resistance)。
在anti-PD-1疗法治疗黑色素瘤中,约有60%的患者不响应(primary resistance),还有一部分患者在初始响应后肿瘤出现了再进展。
本文就详细介绍下肿瘤免疫耐药的机制。
▲黑色素瘤患者对anti-PD-1疗法的临床响应导致原发性/继发性耐药的肿瘤内在原因这些原因主要是肿瘤细胞上特定基因或通路的表达或上调,从而导致肿瘤微环境中免疫细胞的浸润以及功能受到抑制。
具体如下:▲导致免疫疗法耐药的肿瘤内在原因•MAPK通路的激活与或PTEN表达的缺失而引起的PI3K通路的增强。
癌基因信号通过MAPK通路导致VEGF与IL-8的产生,从而抑制T细胞的招募与功能。
此外,在多种肿瘤中,肿瘤抑制基因PTEN表达缺失从而PI3K通路增强,这与IFNγ,颗粒酶B的基因表达量降低以及肿瘤浸润CD8+ T细胞的数目减少是高度相关的。
•WNT/β-catenin信号通路的持续表达。
癌基因信号通过稳定β-catenin导致WNT信号通路持续激活,从而将T细胞排除在肿瘤之外。
癌症与免疫细胞突变关系分析

癌症与免疫细胞突变关系分析患癌症是当今世界面临的严重健康问题之一。
癌症的发生与多种因素有关,包括基因突变和免疫系统的异常激活等。
在最近的研究中,科学家们发现免疫细胞的突变与癌症的发展密切相关。
本文将分析癌症与免疫细胞突变之间的关系。
首先,了解什么是癌症和免疫细胞突变是理解两者之间关系的首要步骤。
癌症是由于基因突变导致的细胞分裂和生长异常而引起的疾病。
它可以影响几乎任何组织和器官,包括肺、乳房、胃和肝脏。
然而,癌症细胞有机会逃避机体免疫反应,并且可以通过抑制免疫系统的功能来继续生长和扩散。
免疫细胞突变是指免疫细胞内部基因组发生的变化。
这些突变可能导致免疫细胞的功能紊乱和失调,从而无法有效识别和攻击肿瘤细胞。
其次,免疫细胞突变对癌症的发展和治疗起着重要作用。
正常情况下,免疫细胞具有识别和杀伤肿瘤细胞的能力。
然而,当免疫细胞发生突变时,它们的功能可能受到抑制,从而无法有效消除肿瘤细胞。
一项研究发现,肿瘤中免疫细胞的突变可以导致肿瘤逃避免疫系统的攻击,并且这些突变与抗肿瘤免疫疗法的抵抗性有关。
因此,免疫细胞突变可能是癌症发展和治疗的重要因素。
近年来,免疫细胞突变已经成为癌症研究的热点。
科学家们通过对肿瘤组织和免疫细胞进行基因测序,发现在肿瘤组织中存在着大量的免疫细胞突变。
这些突变可以改变免疫细胞的功能和活性,从而影响它们的消灭癌细胞能力。
此外,研究人员还发现,不同类型的癌症与免疫细胞突变的频率和类型有关。
例如,黑色素瘤和肺癌患者中的免疫细胞突变较为常见。
这些研究结果表明免疫细胞突变与不同类型的癌症之间存在着紧密的关联。
此外,免疫细胞突变还与免疫治疗的疗效相关。
免疫治疗是目前治疗癌症的一种新方法,它通过激活机体免疫系统来攻击和消灭肿瘤细胞。
然而,研究发现,免疫细胞突变可能会降低免疫治疗的疗效。
具体来说,免疫细胞突变降低了免疫治疗药物在肿瘤细胞上的作用,进而降低了治疗效果。
因此,了解免疫细胞突变对免疫治疗的影响,对于优化治疗方案具有重要意义。
肺癌的免疫治疗方法
肺癌的免疫治疗方法肺癌是全球范围内最常见且致命的恶性肿瘤之一。
传统的治疗方法,如手术、放疗和化疗,在一定程度上改善了患者的生存状况,但对于许多晚期肺癌患者来说,效果仍然有限。
近年来,免疫治疗的出现为肺癌治疗带来了新的希望,显著提高了患者的生存率和生活质量。
免疫治疗是一种通过激活或增强人体自身免疫系统来对抗肿瘤的治疗策略。
它的作用机制与传统治疗方法有很大的不同。
在正常情况下,人体的免疫系统能够识别并清除异常细胞,包括癌细胞。
然而,癌细胞往往会通过各种机制逃避免疫系统的监视和攻击,从而得以生长和扩散。
免疫治疗的目的就是打破这种免疫逃逸,重新激活免疫系统对癌细胞的识别和杀伤能力。
目前,用于肺癌治疗的免疫治疗方法主要包括免疫检查点抑制剂、肿瘤疫苗和细胞免疫治疗等。
免疫检查点抑制剂是目前应用最为广泛的免疫治疗药物。
其中,最为常见的是 PD-1/PDL1 抑制剂和 CTLA-4 抑制剂。
PD-1(程序性死亡受体 1)和 PDL1(程序性死亡配体 1)是一对免疫检查点分子。
当PD-1 与 PDL1 结合时,会抑制 T 细胞的活性,使免疫系统无法有效地攻击癌细胞。
PD-1/PDL1 抑制剂通过阻断 PD-1 与 PDL1 的结合,解除T 细胞的抑制状态,从而激活免疫系统对肿瘤的攻击。
CTLA-4(细胞毒性 T 淋巴细胞相关抗原 4)也是一种免疫检查点分子,主要作用于免疫反应的早期阶段。
CTLA-4 抑制剂可以促进 T 细胞的活化和增殖,增强免疫系统的抗肿瘤能力。
在肺癌治疗中,PD-1/PDL1 抑制剂已经显示出了显著的疗效。
对于晚期非小细胞肺癌患者,尤其是那些没有驱动基因突变(如 EGFR、ALK 等)的患者,PD-1/PDL1 抑制剂可以作为一线治疗方案,或者在化疗后作为二线治疗。
多项临床研究表明,与传统化疗相比,PD-1/PDL1 抑制剂能够显著延长患者的总生存期和无进展生存期,提高患者的生活质量。
而且,PD-1/PDL1 抑制剂的副作用相对较小,主要包括疲劳、皮疹、腹泻等,多数患者可以耐受。
基因突变和免疫系统的相关性
基因突变和免疫系统的相关性随着科技的发展和生物技术的提升,对于基因的研究也越来越深入,相应的也有越来越多的基因疾病被发现并研究。
在这些研究中,基因突变被发现与免疫系统有着密不可分的关系。
下面我们就来探讨一下基因突变与免疫系统的相关性。
什么是基因突变?基因突变是基因的某些位置发生变异或缺失,它们对基因的正常功能产生了影响,从而导致某些疾病的发生。
例如先天性免疫缺陷病、自身免疫疾病等。
基因突变可以分为无意义突变,错义突变和无义突变,其中无意义突变是指碱基改变后,不会对基因表达产生任何影响;错义突变是指碱基改变后,所编码的蛋白质的氨基酸序列发生变化,从而使其功能发生改变;无义突变是指某一点上的碱基发生了变化,造成编码信息的截止或产生过早的终止密码子,使得相应的编码区域无法表达出蛋白质。
基因突变与免疫系统的关系基因突变与免疫系统的关系比较密切,因为免疫系统是我们身体内的一套天然的“保护装置”,确保我们远离疾病。
当人体遭受外界病原体侵袭时,免疫系统会立刻启动抵御机制,通过白细胞对抗病原体并消灭细胞内异常物质。
如果免疫系统发生突变,它的保护作用就会受到影响,从而容易引起各种免疫系统异常疾病,如自身免疫疾病、先天性免疫缺陷病等。
自身免疫疾病自身免疫疾病是免疫系统失常造成机体正常组织受到破坏的一种疾病。
在自身免疫疾病的病因中,许多都是由于基因突变及其导致的一系列情况所引起。
例如类风湿关节炎、系统性红斑狼疮、硬皮病等疾病,都是由于免疫细胞攻击人体自身正常细胞而引起的。
先天性免疫缺陷病先天性免疫缺陷病是由于基因突变引起的一种免疫系统缺陷性疾病。
先天性免疫缺陷病有很多种,常见的先天性免疫缺陷病有严重联合免疫缺陷病、Wiskott-Aldrich综合征等。
这类疾病一般是因为免疫细胞的生成或功能异常,或者免疫激活酶的缺失或不完整,导致机体无法抵御病原体入侵而引起疾病的发生。
基因突变在免疫系统疾病的治疗中的应用基因突变在免疫系统疾病的治疗中也有着广泛的应用。
探索基因突变与免疫治疗抵抗的关联
探索基因突变与免疫治疗抵抗的关联基因突变与免疫治疗抵抗的关联基因突变是指DNA序列发生改变的现象,它在肿瘤发展和进展过程中发挥重要作用。
近年来,免疫治疗作为一种新兴的抗癌方式,取得了显著的突破。
然而,部分患者对免疫治疗显示抵抗性。
本文将探索基因突变与免疫治疗抵抗的关联,为寻找更有效的治疗策略提供参考。
一、基因突变对免疫治疗的影响1.1 靶向免疫检查点的治疗方法免疫检查点抑制剂可以释放免疫系统的抑制状态,从而增强肿瘤的抗原特异性免疫应答。
然而,基因突变可能影响免疫检查点的表达水平或功能,导致患者对该治疗方法的抵抗。
1.2 基因突变与免疫逃逸某些基因突变能够改变肿瘤细胞的免疫原性,使免疫系统无法识别和攻击恶性肿瘤细胞。
这种免疫逃逸现象成为免疫治疗抵抗的一个重要原因。
二、探索基因突变与免疫治疗抵抗的关联2.1 体质遗传差异对免疫治疗效果的影响基因突变可导致肿瘤的异质性,使得免疫治疗效果存在个体差异。
一些患者可能通过基因突变增强了肿瘤抗原的表达,从而提高了免疫治疗的敏感性。
而另一些患者则因为基因突变导致肿瘤样细胞免疫原的失活或变异,降低了免疫治疗的疗效。
2.2 微环境对基因突变和免疫治疗抵抗的调控肿瘤微环境是肿瘤细胞与其周围环境的相互作用,能够影响肿瘤的进展以及对治疗的反应。
基因突变与肿瘤微环境的相互作用可能导致肿瘤抗原的表达、免疫细胞浸润和肿瘤逃逸的改变,从而影响免疫治疗的效果。
2.3 突变负荷与免疫治疗的关系突变负荷是指肿瘤细胞基因组中突变的数量和类型。
高突变负荷被认为是免疫检查点治疗的预测指标,突变负荷越高,预后越好。
而某些特定的基因突变可能与免疫治疗的抗性相关。
三、引导基因突变与免疫治疗抵抗相关研究3.1 预测基因突变与免疫治疗抵抗的生物标志物寻找和验证基因突变与免疫治疗抵抗相关的生物标志物,有助于预测患者对于免疫治疗的敏感性。
这将有助于个体化治疗策略的制定。
3.2 结合基因突变与其他治疗策略基因突变因其多样性和复杂性,导致抗肿瘤治疗难度较大。
癌症基因突变与免疫治疗的关系研究
癌症基因突变与免疫治疗的关系研究癌症是当今世界面临的一个重大健康问题。
据统计,每年有数百万人因癌症死亡。
虽然传统的癌症治疗已经取得了一定的进展,但是其成功率仍然非常低。
这是由于癌症细胞的高度异质性和适应性。
但是,最近的研究表明,免疫治疗对于各种癌症的治疗效果非常好。
这篇文章将关注癌症基因突变和免疫治疗的关系。
癌症基因突变的定义癌症基因突变是指在癌症细胞的基因组中发生的异常变化。
这些变化通常会影响基因的功能,导致细胞变异,并产生癌症病理特征。
基因突变可以发生在多个基因和通路上。
有很多因素可以导致基因突变,如辐射、烟草、酒精和化学物质等。
但是,最近的研究表明,在体内产生的内源性因素也可以导致基因突变。
例如,DNA复制错误和DNA修复缺陷都可以导致基因突变。
癌症基因突变与癌症免疫治疗的关系癌症免疫治疗是一种利用宿主免疫系统来攻击和杀死癌症细胞的新型治疗方法。
免疫治疗的效果优于传统的化疗和放疗,并且没有一些副作用。
虽然免疫治疗的机制并不完全清楚,但是最近的研究表明,癌症基因突变与免疫治疗的效果有着密切的关系。
癌症细胞在进化过程中不断发生基因突变,导致它们的基因组高度异质性。
由于癌症细胞中存在大量的变异抗原,这些抗原通常从正常组织发生基因突变的位置产生。
这些变异抗原被称为肿瘤新抗原,它们与正常组织的抗原有所不同。
免疫系统可以将肿瘤新抗原识别为外国生物,然后攻击癌症细胞。
由于每个癌症细胞都有不同的基因突变,因此免疫治疗可以攻击多种癌症类型,而不像传统治疗只针对某个癌症。
许多临床试验表明,与肿瘤新抗原负载量较高的肿瘤相比,肿瘤新抗原负载量较低的肿瘤对免疫治疗的反应较弱(例如免疫检查点抑制剂)。
当癌症细胞中的基因突变较少时,免疫系统可以将癌症细胞视为自己的一部分,并放弃攻击它们。
另外,根据基因突变的类型,肿瘤新抗原的质量和数量可以有所不同。
例如,错义突变通常会导致更质量更好的肿瘤新抗原,而非同义突变则会导致质量较差的肿瘤新抗原。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫疗法的抗性与突变有关图片注释:一个癌细胞(白细胞)正在被两个免疫细胞(红色)攻击文章来源:美国国家癌症研究所许多黑色素瘤患者的肿瘤在经过一阶段的检查点抑制剂免疫药物治疗后,肿瘤都缩小了。
但尽管持续治疗,最终他们的肿瘤再次生长。
一项新的研究已确认:遗传机制或许要对以上现象负责,这些患者中至少一部分人的遗传机制有了治疗抗性。
研究人员发现来自三名黑色素瘤晚期患者的肿瘤突变使肿瘤对检查点抑制剂-pembrolizumab (Keytruda®)产生抗性。
尤其是突变使肿瘤避免被识别以及被免疫细胞所攻击。
James Gulley,医学博士,美国国家癌症研究所the Genitourinary Malignancy Branch负责癌症研究的主管,表示:在2016年7月13号发表在新西兰医学杂志的研究结果具有重大意义,因为检查点抑制剂现在用于多种癌症的治疗。
这项研究的作者写到:了解肿瘤是如何获得检查点抑制剂的抗性是关键。
它将帮助指导靶向治疗的开发从而抵消抗性。
免疫检查点免疫系统包含几个所谓的用来阻止免疫反应变得过于强烈的检查点蛋白质。
比如,T细胞表面的PD-1受体蛋白和其他细胞的PD-L1或PD-L2蛋白结合,从而抑制免疫反应。
癌细胞和一个肿瘤周围环境的细胞有时表达PD-1来阻止免疫攻击。
靶向PD-1或PD-L1的几种免疫检查点抑制剂阻止结合从而允许免疫系统攻击肿瘤细胞。
PD-1和PD-L1的抑制剂已经被美国食品药品监督管理局批准用于治疗几种类型的癌症。
P embrolizumab就是被批准用于患有晚期黑色素瘤和晚期肺癌的一种PD-1抑制剂。
尽管用PD-1抑制剂治疗造成大约三分之一的黑色素瘤晚期患者的肿瘤减小或完全消失,但尽管持续治疗,肿瘤又再次生长或复发,并达到了这些患者的四分之一。
为了调查肿瘤对PD-1抑制剂的抗性是如何产生的,医学博士,加利福尼亚大学洛杉矶分校Jonsson综合癌症中心博士Antoni Ribas和他的同事们对4名初期对permbrozumab反应并在治疗1~2年后复发的转移性黑色素瘤患者的基因进行了排序。
针对每一名患者,他们对比了在治疗前和复发后所采集的肿瘤活检的突变,从而确认治疗后所获得的改变以及有可能造成治疗抗性的改变。
加利福尼亚大学洛杉矶分校-加利福尼亚理工学院医学科学培训计划的博士生Jesse Zaretsky,也就是这次研究的第一作者,解释说:在全部的4名患者中,90%以上的突变在两个活检中都被发现,这使研究团队集中精力在对复发肿瘤来说独特的少部分的突变。
抗性机制免疫系统抑制剂释放免疫系统的“制动器”,允许T细胞变得活跃并且分泌被称为γ-干扰素的细胞因子。
γ-干扰素抑制癌症细胞的生长,通过一个信号通道需要JAK蛋白。
在被研究患者4名中的2名复发的肿瘤里有着JAK1或JAK2的突变,基因也就是JAK蛋白编码。
在这两种情况下,突变产生了一个缩短的、无功能的蛋白。
研究人员通过来自获得JAK变异患者的细胞株发现:变异的JAK2蛋白破坏了γ-干扰素信号通道。
这些细胞也已经减少了基因的传播,而这些基因的产物则可允许T细胞识别并消除癌症细胞。
作者还发现γ-干扰素没有抑制JAK2变异肿瘤源性细胞或不是缺乏JAK1就是缺乏JAK2黑色素瘤细胞株的生长。
Gulley博士表示:“这或许不是唯一的抗性机制,但这是我们如何克服检查点抑制剂抗性的一块额外的拼图。
”从第3名患者的活检遗传分析发现:在复发肿瘤的B2M基因存在突变。
B2M 细胞释放细胞表层的蛋白,而免疫细胞是用蛋白来识别并清除癌细胞。
Zaretsky解释说:“在其他的研究中,B2M变异已经被证明会促进肿瘤对免疫治疗的抗性。
而这些新的发现似乎证实了以前的研究。
”因此,研究人员得出以下结论:JAK1,JAK2和B2M变异通过允许肿瘤细胞避免被免疫细胞识别和攻击来促进Pembrolizumab抗性。
研究人员在4四名患者身上没有发现任何与PD-1抑制剂抗性有关的遗传异常,这表明肿瘤复发可能获取抗体通过的是一非基因机制。
Zaretsky说“案例四是有一个真正的谜”。
更多相关信息:现在研究团队正致力于克服免疫点抑制剂抗体的研究。
Zaretsky说:“我们开始建立细胞株变异的模型和小白鼠模型,以便我们能够研究他们与免疫系统的互动,开始测试其他的疗法或者PD-1抑制剂结合的治疗从而尝试克服抗性。
”Gulley博士表示:“因为该发现仅反映四名患者PD-1抑制剂的抗体机制,后续的研究需要确定这些机制是如何在其他黑色素瘤患者之间流行的。
”我们不知道是否这些已确认的变异代表着已具有抗性病人的80%,还是10%,但我们可以确认的一点是免疫细胞识别或杀死癌细胞的抗性是至少是又一种机制。
Mutations Linked to Immunotherapy Resistance From : the National Cancer InstituteFor many patients with melanoma whose tumors shrink after treatment with a class of immunotherapy drugs called checkpoint inhibitors, their tumors eventually grow back despite continued treatment. A new study has identified genetic mechanisms that may be responsible for this acquired treatment resistance in at least some of these patients. The researchers found mutations in tumors from three patients with advanced melanoma that allowed the tumors to become resistant to the immune checkpoint inhibitorpembrolizumab (Keytruda®). Specifically, the mutations enabled the tumors to avoid recognition and attack by immune cells.The results, reported July 13 in The New England Journal of Medicine, are of "significant interest" because checkpoint inhibitors are now used to treat several kinds of cancer, said James Gulley, M.D., Ph.D., chief of the Genitourinary Malignancy Branch in NCI’s Center for Cancer Research.Understanding how tumors acquire resistance to checkpoint inhibitors is critical, the study authors wrote, and may help guide the development of targeted therapies that could counteract resistance.Immune CheckpointsThe immune system includes several so called checkpoint proteins that keep immune responses from becoming too strong. For example, binding of the protein PD-1 on T cells to the protein PD-L1 or PD-L2 on other cells suppresses the immune response. Cancer cells and cells in the environment surrounding a tumor sometimes expressPD-L1, preventing immune attack.Several immune checkpoint inhibitors target PD-1 or PD-L1, preventing them from binding and thereby allowing the immune system to attack tumor cells. Inhibitors of PD-1 and PD-L1 have been approved by the Food and Drug Administration to treat several cancer types. Pembrolizumab is a PD-1 inhibitor that is approved to treat some patients with advanced melanoma and advanced lung cancer.Although treatment with PD-1 inhibitors causes tumors to shrink (or disappear entirely) in approximately one-third of patients with advanced melanoma, the tumor grows back (or relapses) despite continued treatment in up to one-quarter of these patients.To investigate how tumor resistance to PD-1 inhibitors arises, Antoni Ribas, M.D., Ph.D., of the UCLA Jonsson Comprehensive Cancer Center and his colleagues sequenced the DNA of tumors from four patients with metastatic melanoma who initially responded to pembrolizumab but then relapsed after 1 to 2 years of treatment. For each patient, they compared mutations in tumor biopsies taken before treatment and after relapse to identify alterations that were acquired after treatment and may have contributed to treatment resistance.In all four patients, more than 90% of mutations were found in both biopsies, which allowed the research team to focus on the few mutations that were unique to the relapsed tumors, explained the study’s first author, Jesse Zaretsky, an M.D.–Ph.D. student in the UCLA-Caltech Medical Scientist Training Program.Mechanisms of ResistanceImmune checkpoint inhibitors "release the brakes" on the immune system, allowing T cells to become active and secrete a cytokine called interferon gamma. Interferon gamma suppresses the growth of cancer cells through a signaling pathway that requires JAK proteins.Two of the four patients studied had mutations in either JAK1 or JAK2, the genes that code for JAK proteins, in their relapsed tumors. In both cases the mutation generated a shortened, nonfunctional protein.Using cell lines from the patient who acquired a JAK2 mutation, the researchers found that the mutated JAK2 protein disrupted the interferon gamma signaling pathway. These cells also had reduced expression of genes whose products allow T cells to recognize and eliminate cancer cells.The authors also found that interferon gamma did not inhibit growth ofthe JAK2-mutant tumor-derived cells or melanoma cells lines that lackedeither JAK1 or JAK2.“This may not be the only mechanism of resistance,” Dr. Gulley said, but “this is one additional piece of the puzzle of how we could overcome resistance to checkpoint inhibitors.”Genetic analysis of biopsies from the third patient revealed a mutation inthe B2M gene in the relapsed tumor. B2M helps cells express proteins on the cell surface that immune cells use to recognize and eliminate cancer cells.Acquired B2M mutations have been shown in other studies to promote tumor resistance to immunotherapy, Zaretsky explained, and these new findings appear to confirm the earlier research.Thus, the researchers concluded that mutations in JAK1,JAK2, and B2M promote resistance to pembrolizumab by allowing tumor cells to avoid recognition and attack by immune cells.The researchers did not identify any genetic abnormalities related to PD-1 inhibitor resistance in the fourth patient, suggesting that the relapsed tumor may have acquired resistance through a nongenetic mechanism. “Case four is a true mystery,” said Zaretsky.Learning MoreThe research team is now building on this research to find ways of overcoming checkpoint inhibitor resistance."We’re starting to model these mutations in cell lines and mouse models so we can study their interaction with the immune system and begin testing other therapies, or combinations of therapies with PD-1 inhibitors, to try and overcome the resistance," Zaretsky said.Because the findings only reflect mechanisms of PD-1 inhibitor resistance in four patients, additional studies will be needed to determine how prevalent these mechanisms are in other melanoma patients, said Dr. Gulley."We don’t know if these identified mutations will represent 80% of patients that develop resistance or 10%, but what we do know is that resistance to immune cell recognition or killing is at least one mechanism."。
