巧解铝及其化合物的计算题
铝及其化合物练习题

铝及其化合物练习题丁继荣一.选择题:1.铝在空气中能够稳定存在的原因是()A.铝的活泼性差B.铝的还原性差C.铝与氧气不反应D.铝表面有氧化膜2.最不适宜于制作炊事用具的金属是()A.Fe B.Zn C.Al D.Cu3.氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质()A.酸性B.碱性C.两性D.氧化性4.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是()①NaHCO3 ②Al2O3 ③Al(OH)3④AlA.③④B.②③④C.①③④D.全部5.下列反应的离子方程式书写正确的是()A.钠和冷水反应Na+2H2O=Na++2OH-+H2↑B.金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑C.金属铝溶于盐酸中2Al+6H+=2Al3++3H2↑D.铁跟稀硫酸反应2Fe+6H+=2Fe3++3H2↑6.取两份等量的铝粉,分别与足量的盐酸、氢氧化钠溶液反应,在相同状态下产生的气体体积之比是()A.1:1 B.1:2 C.1:3 D.3:27.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有()A.AlO2-B.Cu2+C.Al3+D.Mg2+8.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为·L-1,c(Cl-)为·L-1。
要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为()A.40mL B.72mL C.80mL D.128mL9.向MgSO4和Al2(SO4)3混合溶液中, 逐滴加入NaOH溶液。
下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) ()全部转化成BaSO4沉淀,此时铝元素的主要10.把Ba(OH)2溶液滴入明矾溶液中,使SO-24存在形式是()A.Al3+ B.Al(OH)3 C.AlO-D.Al3+和Al(OH)3211.现有铝和过氧化钠的固体混合物样品,加入稀盐酸使混合物完全溶解,所得溶液中c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中铝元素与氧元素的质量比为() A.3∶4 B.9∶32 C.9∶16 D.9∶812.X溶液滴入Y溶液和Y溶液滴入X溶液现象不同的是()A B C DX溶液MgCl2溶液MgCl2溶液AlCl3溶液AlCl3溶液Y溶液NaOH溶液氨水NaOH溶液氨水13.把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是()A.盐酸的体积为80 mLB.a的取值范围为0<a<50C.n(Mg2+)< molD.当a值为30时,b值为二.填空题:14.取铝锌合金溶于足量硫酸中,完全反应后收集到(标准状况)氢气,则由铝和锌分别产生的氢气的体积比为____________。
高考化学—铝及其化合物推断题的综合压轴题专题复习附答案

高考化学—铝及其化合物推断题的综合压轴题专题复习附答案一、铝及其化合物1.Al2O3是铝的重要化合物,有着广泛的应用。
以下是Al2O3的实验室制备流程图。
根据题意回答下列问题:(1)实验室制备过程中,废铝材料先用Na2CO3溶液浸洗的目的是_____;A试剂是____________(填物质名称)。
(2)两条途径中有一条明显不合理,它是_______(填“途径1”或“途径2”),合理的方案是______。
(3)某同学从多、快、好、省的原则考虑,认为综合途径1和2,可以既节约药品又节省时间来实现由“废铝材料”制备“Al2O3”,该同学的实验设计流程是(模仿上面流程图设计)__________。
(4)若要从滤液中得到NaCl晶体,其实验操作是_____。
(5)得到的Al2O3中可能含有Na2CO3杂质,请设计实验检验杂质:(写出所需试剂、实验步骤和结论)_________。
(6)现有含Na2CO3杂质的Al2O3样品,为了测定Al2O3的纯度,请你设计实验方案,列出计算式:_____(式中含有a、b等字母)。
【答案】除去铝材表面的油腻稀盐酸途径2 将稀盐酸改成通入过量CO2蒸发结晶、趁热过滤、干燥取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有取样品质量为b,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag。
计算式为:106a 1-197b【解析】【分析】从废铝材中提取氧化铝,途径1先用稀盐酸反应生成氯化铝,再与Na2CO3溶液发生双水解生成氢氧化铝,再灼烧分解生成氧化铝;途径2氧化铝先与氢氧化钠生成偏铝酸钠,再与盐酸生成氢氧化铝,再灼烧分解生成氧化铝,据此分析解答。
【详解】(1)废铝材料先用Na2CO3溶液浸洗的目的是除去铝材表面的油腻,A为稀盐酸,故答案为:除去铝材表面的油腻;稀盐酸;(2)途径2不合理,因为盐酸的量不好控制,改进的方法是将稀盐酸改成通入过量CO2,故答案为:途径2;将稀盐酸改成通入过量CO2;(3)综合途径1和2,可以既节约药品又节省时间来实现由“废铝材料”制备“Al2O3”,应该用铝材先分别生成氯化铝和偏铝酸钠,两者再发生双水解生产氢氧化铝,流程为:;(4)氯化钠的溶解度受温度影响小,若要从若要从滤液中得到NaCl晶体,操作为:蒸发结晶、趁热过滤、干燥,故答案为:蒸发结晶、趁热过滤、干燥;(5)得到的Al2O3中可能含有Na2CO3杂质,检测的方法为:取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有,故答案为:取少量样品溶于水,取上层清液,加入氯化钡溶液,若出现白色沉淀,则证明有Na2CO3,反之则没有;(6)现有含Na2CO3杂质的Al2O3样品,为了测定Al2O3的纯度,可采用方案为:取样品质量为b,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag;BaCO3沉淀质量为ag,则n(BaCO3)=ag197g/mol=a197mol=n(Na2CO3),则m(Na2CO3)=a197mol 106g/mol=106ag197,Na2CO3的纯度=106a197b,Al2O3的纯度=106a1-197b;故答案为:取样品质量为m,加水溶解后,加入足量的氯化钡溶液,沉淀完全以后,过滤、洗涤和干燥,称量(恒重)得沉淀ag;计算式为:106a1-197b。
铝及其化合物练习题及答案

铝及其化合物练习题及答案【典型例题】类型一:铝与NaOH溶液的反应例题1 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入铝粉的质量为()A.5.4 g B.3.6 g C.2.7 g D.1.8 g【答案】A【解析】2Al+6HCl=2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑由反应方程式可知,若在等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比1∶3,现在产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,对于NaOH来说是不足量的,所以与盐酸反应的铝粉质量为2.7 g,与NaOH 反应的铝粉质量为5.4 g。
【总结升华】因为铝与NaOH溶液反应是一个较为特殊的反应,所以当铝与NaOH溶液在同一题目中出现时,往往要用到2Al+2NaOH+2H2O=2NaAlO2+3H2↑这一关系来解。
举一反三:【变式1】取两份等质量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同情况下产生的气体体积之比是()A.1∶1 B.1∶2 C.1∶3 D.3∶2【答案】A【变式2】下列关于金属元素特征的叙述正确的是()(1)金属元素的原子只有还原性,离子只有氧化性;(2)金属元素在化合物中只显正价;(3)金属性越强的元素相应的离子氧化性越弱;(4)价电子越多的金属原子金属性越强;(5)离子化合物一定含金属元素A、(1)(2)(3)B、(2)(3)C、(1)(4)(5)D、全部【答案】B【解析】(1)对于变价金属中,较低价态的金属离子既有氧化性,又有还原性,如Fe2+。
(2)金属元素的原子只具有还原性,故在化合物中只显正价。
(4)金属性的强弱要看失电子的难易。
(5)离子化合物不一定含金属元素,如NH4Cl。
类型二:Al2O3、Al(OH)3的性质与制法例题2 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是()①Al ②NaHCO3③Al2O3④Mg(OH)2⑤Al(OH)3A.①②③⑤B.①④⑤C.②③⑤D.①③④【答案】C【解析】注意审题,题目要求是“化合物”,防止错选A。
高考化学压轴题之铝及其化合物推断题(高考题型整理,突破提升)含答案解析
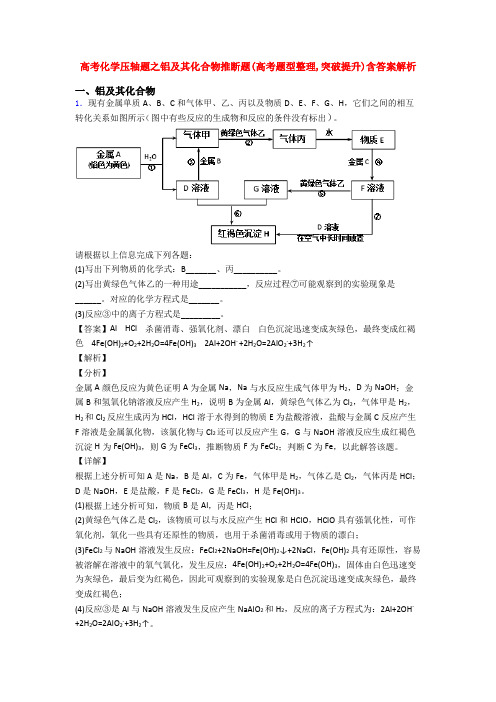
高考化学压轴题之铝及其化合物推断题(高考题型整理,突破提升)含答案解析一、铝及其化合物1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
2020-2021化学铝及其化合物推断题的专项培优 易错 难题练习题(含答案)含答案

2020-2021化学铝及其化合物推断题的专项培优易错难题练习题(含答案)含答案一、铝及其化合物1.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:请回答下列问题:(1)固体A的主要成分是______________(写名称).(2)铝土矿与过量烧碱反应的离子方程式为______、______.(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式______________.(4)指出流程乙的一个缺点是____________.(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式________________.【答案】二氧化硅Al2O3+2OH_=2AlO2_+ H2O SiO2+2OH_ =SiO32﹣+H2O2Al2O3==4Al+ 3O2↑氧化铝中含有二氧化硅杂质Al2O3+N2+3C2AlN+3CO.【解析】流程甲:铝土矿中加入过量的稀盐酸,SiO2与盐酸不反应,Al2O3、Fe2O3、MgO均可与盐酸反应生成相应的氯化物,反应方程式为Al2O3+6H+===2Al3++3H2O;Fe2O3+6H +===2Fe3++3H2O;MgO+2H+===Mg2++H2O;反应液中加入过量烧碱,Al3+变为AlO2-,Mg2+、Fe3+变为Mg(OH)2 和Fe(OH)3 沉淀,过滤后,滤液中通入足量的二氧化碳气体,生成了Al(OH)3沉淀;反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
流程乙:铝土矿中加入过量的氢氧化钠溶液,Fe2O3、MgO与氢氧化钠不反应,SiO2、Al2O3均与强碱反应生成硅酸钠和偏铝酸钠,过滤,滤液中通入足量的二氧化碳,反应生成了Al(OH)3沉淀和硅酸。
铝及其化合物的有关计算
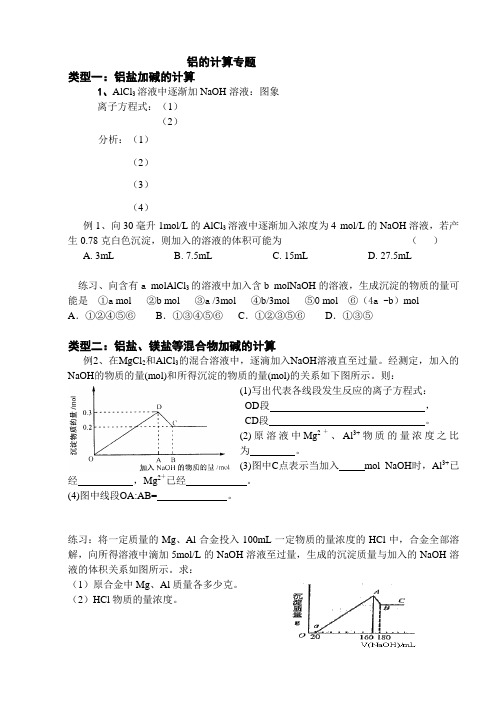
铝的计算专题类型一:铝盐加碱的计算1、AlCl3溶液中逐渐加NaOH溶液:图象离子方程式:(1)(2)分析:(1)(2)(3)(4)例1、向30毫升1mol/L的AlCl3溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78克白色沉淀,则加入的溶液的体积可能为()A. 3mLB. 7.5mLC. 15mLD. 27.5mL练习、向含有a molAlCl3的溶液中加入含b molNaOH的溶液,生成沉淀的物质的量可能是①a mol ②b mol ③a /3mol ④b/3mol ⑤0 mol ⑥(4a -b)molA.①②④⑤⑥B.①③④⑤⑥C.①②③⑤⑥D.①③⑤类型二:铝盐、镁盐等混合物加碱的计算例2、在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。
经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
则:(1)写出代表各线段发生反应的离子方程式:OD段,CD段。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为。
(3)图中C点表示当加入mol NaOH时,Al3+已经,Mg2+已经。
(4)图中线段OA:AB= 。
练习:将一定质量的Mg、Al合金投入100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图所示。
求:(1)原合金中Mg、Al质量各多少克。
(2)HCl物质的量浓度。
类型三:铝宫计算技巧---电荷守恒例3、向100mL 0.1mol/L的AlCl3溶液中滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度。
例4、在NaAlO2溶液中,通入amolHCl气体,生成bmol沉淀后,又通入c mol HCl气体时,沉淀恰好溶解,则原NaAlO2溶液中含NaAlO2的物质的量是()A、(a+b)/4molB、(a+c)/4molC、(3a+c)/4molD、cmol或b/3mol练1、在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。
Al及其化合物的相关性质的答案

【例1】解析:铝是一种活泼的金属,易与氧气反应,但反应后生成一层致密的氧化膜而阻止铝与氧气继续反应,所以铝具有较强的抗腐蚀性能。
答案:D思考题:铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
【例2】解析:A项电子及电荷均不守恒,正确写法:2Al+2OH-+2H2O=2AlO-2+3H2↑;B项电子及电荷均不守恒:2Na+2H2O===2Na++2OH-+H2↑;C项不符合反应事实Al3++4OH-===AlO-2+2H2O。
答案:D【例3】解析:铝在常温下与空气中的氧气反应,在铝表面形成一层致密的氧化物薄膜;铝与氯气反应生成氯化铝;氧化铝是两性氧化物,既能与酸反应,也能与碱反应。
答案:C【例4】解析:钝化的实质是浓H2SO4或浓HNO3在Fe、Al的表面形成了一层致密的氧化物保护膜。
由于铝的氧化物Al2O3是一种两性氧化物,既可与强酸反应,又可与强碱反应,所以A、B、D三项皆不符合题意,只有C项中的Cu(NO3)2因不与Al2O3反应,故不与钝化的铝条发生反应。
答案:C【例5】C【例6】D【例7】C【例8】B【过关练习】1. C2. D3. C4. D5. B6.D7.AC8. AB9.解析:由于铝灰中含Al2O3、Al,还有SiO2等杂质,加入盐酸搅拌使Al元素进入溶液,发生反应Al2O3+6H+===2Al3++3H2O,2Al+6H+===2Al3++3H2↑,和SiO2等杂质分离。
采取过滤的方法得到AlCl3溶液,溶液降温熟化调节pH至4.0~4.5,增大AlCl3溶液的pH,通过促进其水解而结晶析出。
AlCl3水解生成的HCl易挥发,挥发出的HCl经水喷淋吸收又生成盐酸这个过程中可以循环利用盐酸。
(6)为了不引进新的杂质,可以选择B和D。
答案:(1)Al2O3+6H+===2Al3++3H2O2Al+6H+===2Al3++3H2↑(2)过滤(3)H2(4)HCl(5)促进AlCl3水解,使晶体析出(6)BD。
备战高考化学压轴题专题复习——铝及其化合物推断题的综合及详细答案

备战高考化学压轴题专题复习——铝及其化合物推断题的综合及详细答案一、铝及其化合物1.为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(1)第①步Cu与混酸反应的离子方程式为________________。
得到滤渣1的主要成分为___________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是_________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:上述三种方案中,_______方案不可行,原因是________________;从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。
取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。
滴定反应如下:Cu2++ H2Y2-→ CuY2-+ 2H+。
写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
【答案】Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O或3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O Au、Pt 将Fe2+氧化为Fe3+不引入杂质,对环境无污染使Fe3+、Al3+沉淀除去加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体甲所得产品中含有较多Fe2(SO4)3杂质乙3102505c ba-⨯⨯⨯⨯× 100%【解析】【分析】【详解】(1)Cu与混酸反应的实质是与H+、NO3-反应,随反应进行离子浓度逐渐减小,所以离子方程式为Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O,3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt;(2)加过氧化氢的目的是把亚铁离子氧化成铁离子,方便除去;而且加入过氧化氢不会引入新的杂质且无污染;调节溶液的pH目的是使Fe3+、Al3+沉淀除去;(3)由滤液2得到CuSO 4·5H 2O 的方法是把滤液蒸发得浓溶液再冷却结晶,过滤得硫酸铜晶体;(4)甲方案不可行,因为滤渣2的主要成分是Fe (OH )3、Al (OH )3沉淀,加入硫酸沉淀全部溶解使制得的产品中含有较多Fe 2(SO 4)3杂质; 从原子利用率角度分析,乙方案更合理,不仅能除去硫酸铁,同时增加了硫酸铝的量,原子利用率较高;(5)由滴定反应方程式得100mL 溶液中n (Cu 2+)=b×10-3×a×5mol ,所以CuSO 4·5H 2O 质量分数= b×10-3×a×5×250/a×100%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巧解铝及其化合物的计算题巧解铝及其化合物的计算题铝及其化合物的计算是考查学生各种能力的重要题型,在高考及竞赛中频频出现,因此如何快速而准确解答这类题非常重要,现将几种巧算方法介绍如下:一、公式法铝及其化合物常见题型的计算公式如下:I. +3Al 与NaOH 反应生成沉淀的质量①当3:1)OH(n :)Al(n 3≥-+时,)g )(OH(n 26783)OH(n ])OH (Al [m 3--=?=。
②当3:1)OH (n :)Al (n 4:13<<-+时,)g )](OH (n )Al (n 4[78])OH (Al [m 33-+-=。
③当4:1)OH (n :)Al (n 3≤-+时,0])OH (Al [m 3=。
II. -2AlO 与强酸(+H )反应生成沉淀的质量①当1)H (n :)AlO (n 2≥+-时,)g )(H (n 78])OH (Al [m 3+=。
②当1)H (n :)AlO (n 4:12<<+-时,26])OH (Al [m 3=)g )](H (n )AlO (n 4[2+--。
③当4:1)H (n :)AlO (n 2<+-时,0])OH (Al [m 3=。
III. +32AlMg、的混合溶液与-OH 反应时,求++32AlMg、的物质的量。
若++32AlMg、与-OH 的反应关系如下图,则①mol )a b ()Al (n 3-=+②mol 2b 3a 4)Mg (n 2-=+IV . 明矾]O H 12)SO (KAl [224?溶液与2)OH (Ba 溶液反应生成沉淀的质量。
①当32])OH (Ba [n n 2≥明矾时,])OH (Ba [n 285m 2=沉淀;②当32])OH (Ba [n n 212<明矾时,明矾沉淀n 312])OH (Ba [n 77m 2+=;③当32])OH (Ba [n n 2≤明矾时,明矾沉淀n 466m =。
例1:将100mL 1L m ol 6.0-?氯化铝溶液跟1L m ol 4.0-?苛性钠溶液混合后,得到3)OH (Al g 9.3沉淀,此时消耗苛性钠溶液的体积是()A. 250mLB. 375mLC. 475mLD. 500mL解析:由I 中公式①可得:mL 375LmL 1000Lmol 4.0mol 15.0)NaOH (V mol 15.0)OH(n 11===---,由I 中公式②可得:mol 19.0])OH (Al [n )Al (n 4)OH (n 33=-=+-mL 475LmL 1000Lmol 4.0mol 19.0)NaOH (V 11==--。
选B 、C 项。
例2:将g 7.2铝溶解于100mL 1L m ol 3-? NaOH 溶液中,然后向所得溶液中加入1Lmol 1mL 400-?的盐酸,最后可得沉淀多少克?解析:2.7g 铝溶于100mL NaOH L mol 31-?溶液中生成2NaAlO mol 1.0,余NaOHmol 2.0,加入mol 4.0盐酸时,NaOH 需消耗盐酸0.2 mol 。
生成沉淀的质量是由0.1 mol2NaAlO和0.2 mol 盐酸反应而得到的。
根据II 中公式②可得:)g (2.5)2.01.04(26])OH (Al [m 3=-?=例3:把一小块镁铝合金溶于100mL 盐酸中,然后向其中滴入NaOH L mol 11-?溶液,生成沉淀的质量和加入NaOH 溶液的体积如下图所示。
求:(1)镁铝合金的质量组成。
(2)盐酸的物质的量浓度。
(3)B 点沉淀的质量。
解析:由II 中的公式①和②可得:)mol (005.0102)1060(3)1050(4)Mg (n )Mg (n )mol (01.0110)5060()Al(n )Al (n 3233=?---===??-==-+-+(1))g (27.0molg 27mol 01.0)Al (m 1=??=-)g (12.0molg 24mol 005.0)Mg (m 1=??=-(2)因溶解Mg 、Al 消耗的+H 与完全沉淀++32AlMg 、消耗的-OH 的物质的量相同,故:)L mol (5.01.010501)HCl (c 13--?=??=(3)B 点处,m (沉淀))g (07.158005.07801.0=?+?=例4:向a L 物质的量浓度为1L mol M -?的明矾]O H 12)SO (KAl [224?溶液中逐滴加入b L 物质的量浓度为1L mol N -?的2)OH (Ba 溶液时,①当b 满足________时,沉淀的总物质的量为最大值;当b 满足________时,沉淀的总质量为最大值。
②当2M 5.0b a ===,,6.3N =时,生成沉淀的质量为多少克?解析:①根据化学方程式4243224SOK BaSO 3)OH (Al 2)OH (Ba 3)SO (KAl 2+↓+↓=+和O H 2BaSO 2KAlO)OH (Ba 2)SO (KAl 242224+↓+=+可知:向明矾中加2)OH (Ba ,当+3Al沉淀完全时,生成沉淀的物质的量最大,此时bN 2aM 3=,则N 2aM 3b =;当-24SO沉淀完全时,沉淀质量最大,此时bN aM 2≤,即NaM 2b ≥。
②根据IV 中公式②可得:)g (6.450)25.03126.35.077(m =??+??=沉淀二、守恒法根据化学反应中的质量守恒,电荷守恒,得失电子守恒等,可简化铝的有关计算。
例5:准确称取6g 铝土矿样品(含23232SiO O Fe O Al 、、)放入盛有100mL 某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入1L m ol 10-?的NaOH 溶液,产生的沉淀的质量m 与加入NaOH 溶液的体积V 的关系如下图所示。
请回答:(1)硫酸的物质的量浓度为_______________。
(2)若a=2.3,用于沉淀+3Fe 所消耗的NaOH 溶液的体积是_________mL ,铝土矿中各组成成分的质量分数:32O Al 为_________,32O Fe 为_________,2SiO 为_________。
(3)a 值的范围应是_________,在这个范围内,a 值越大,_________的质量分数越小。
解析:(1)加入35mL NaOH 时,沉淀最多,溶液为42SO Na 溶液,根据电荷守恒有)SO(n 2)Na(n 24-+=,又根据元素守恒有=??==-+L 035.0Lmol 10)NaOH (n )Na(n 1mol 35.0。
L 1.0)SO H (c )SO H (n )SO(n 424224?==-解得142L mol 75.1)SO H (c -?=(2)沉淀+3Al 所耗-OH 的量是使3)OH (Al 溶解所耗-OH 的3倍,即沉淀+3Al 所耗NaOH 溶液为mL 30;+3Fe 消耗NaOH 溶液的体积为mL 7.2mL 3.2mL 30mL 35=--。
mol 05.0)L 030.0Lmol 10(61)NaOH (n 61)O Al (n 132=??==-%12%100160623107.210)O Al (w %85%100g6molg 102mol 05.0)O Al (w 332132====--%3)SiO(w 2=(3)由g 1.5)O Al (m 32=,设剩余0.9g 全部为32O Fe 或2SiO ,采用极值法不难求出a 值的范围为:5a 625.1<<;a 值越大,32O Fe 的质量分数越小。
三、对比法对比法是根据题给数据,对比分析出有关物质和过量物质,然后再求解答案。
例6:现有甲、乙两瓶无色溶液,已知它们可能是3AlCl 溶液和NaOH 溶液。
现做如下实验:①取440mL 甲溶液与120mL 乙溶液反应,产生1.56g 沉淀。
②取120mL 甲溶液与440mL 乙溶液反应,产生1.56g 沉淀。
③取120mL 甲溶液与400mL 乙溶液反应,产生3.12g 沉淀。
通过必要的计算和推理判定:(1)甲溶液为_______溶液,其物质的量浓度是_______1L m ol -?。
(2)乙溶液为_______溶液,其物质的量浓度是_______1L m ol -?。
对比②③两组数据,甲用量相同,乙的用量②比③多而生成的沉淀反而③比②多,根据NaOH 能溶解3)OH (Al 的性质,可推知甲为3AlCl ,乙为NaOH ;再对比①②两组数据可知①组中NaOH 不足量,故NaOH 的物质的量为mol 06.0302.0=?;L12.0mol 06.0)NaOH (c =mol 5.0=1L -?;②组中NaOH 部分溶解3)OH (Al ,设3AlCl浓度为1L mol x -?,则有:02.0)x 12.035.044.0(x 12.0=?-?-,1L m ol 5.0x -?=。
四、比例法比例法是利用铝及其化合物在反应过程中物质的量、质量等存在的固定比例关系来求解的方法。
例7:甲、乙两烧杯中各盛有100mL 1L m ol 3-?的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为()A. 5.4gB. 3.6gC. 2.7gD. 1.8g解析:铝和盐酸的反应方程式为↑+=+23H 3AlCl 2HCl 6Al 2;铝与NaOH 溶液的反应方程式为↑+=++222H 3NaAlO2O H 2NaOH 2Al 2,若在等物质的量的盐酸和NaOH 溶液中分别投入足量的铝粉,则产生的2H 的体积比为1:3。
现在产生的气体体积比为1:2,说明铝粉的量对盐酸来说是过量的,而对NaOH 是不足量的,与盐酸反应的铝粉是2.7g ,与NaOH 反应的铝粉应是盐酸的2倍,所以投入铝粉的质量应为5.4g 。
答案为A 项。
