(化学)中考化学试卷化学化学计算题题分类汇编及解析
九年级化学化学计算题题20套(带答案)及解析
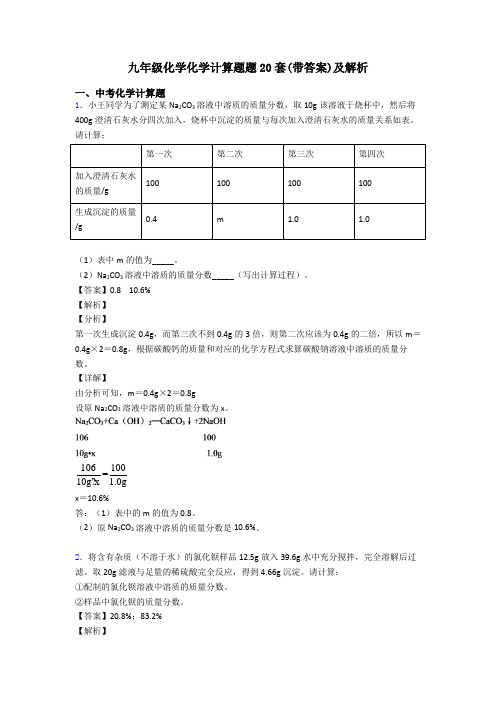
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)

(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)一、中考化学计算题1.现将100 g溶质质量分数为9.8%的稀硫酸与一定质量的氯化钡溶液恰好完全反应后,过滤得到284.7 g滤液。
计算:(1)生成硫酸钡沉淀的质量。
(2)氯化钡溶液中溶质的质量分数。
【答案】(1)生成硫酸钡沉淀的质量为23.3 g。
(2)氯化钡溶液中溶质的质量分数为10%。
【解析】试题分析:解:设生成硫酸钡沉淀的质量为x,反应的氯化钡的质量为y。
H2SO4质量为:10 0g×9.8%=9.8 gBaCl2 + H2SO4 = BaSO4↓ + 2HCl208 98 233y9.8 g x233/98 =x/9.8x=23.3 g208/98 =y/9.8y=20.8 g(2)氯化钡溶液的质量为:284.7 g+23.3 g-100 g=208 g氯化钡溶液的溶质质量分数为:20.8 g/208 g×100%=10%考点:根据化学方程式的计算溶质的质量分数2.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算 物质的质量分数3.将含有杂质(不溶于水)的氯化钡样品12.5g 放入39.6g 水中充分搅拌,完全溶解后过滤。
(化学)中考化学化学计算题专项训练及答案

(化学)中考化学化学计算题专项训练及答案一、中考化学计算题1.某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液,他们的实验过程和相关数据如图所示。
请计算:(1)实验中生成沉淀的质量为。
⑵所得氢氧化钠溶液中溶质的质量分数为.【答案】1010%【解析】【分析】【详解】(1)实验中生成沉淀的质量=195.6g-185.6g=10g⑵设氢氧化钠的质量为x。
Ca(0H)+NaCO=CaCO J+2NaOH22331008010gx1008010gxx=8g所的溶液的质量=185.6g-105.6g=80g氢氧化钠溶液的溶质质量分数=第x100%=10%80g答:(1)实验中生成沉淀的质量为10g;(2)所得氢氧化钠溶液中溶质的质量分数为10%。
2.某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:(1)当加入212g 稀盐酸时,放出气体的质量为g 。
⑵碳酸钠样品中碳酸钠的质量分数为多少?(写出计算过程)⑶加入106g 稀盐酸(即A 点)时烧杯中溶液的溶质质量分数为多少?(写出计算过程)【答案】4.4g80%5.6%【解析】【分析】【详解】(1)根据图像,可以看出当加入106g 稀盐酸的时候,反应就结束,产生气体质量为4.4g ,所以当加入212g 稀盐酸时,放出气体的质量仍然为4.4g(2)发生反应:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2个,根据方程式中碳酸钠与二氧化碳的质量关系可算出碳酸钠的质量,进而可以计算碳酸钠样品中碳酸钠的质量分数,反应后得到的是NaCl 溶液,所以也可根据方程式中NaCl 与二氧化碳的质量关系,求出溶液中溶质的质量解:设碳酸钠的质量为x ,生成的NaCl 质量为V 。
(化学)初三化学化学计算题试题(有答案和解析)含解析

(化学)初三化学化学计算题试题(有答案和解析)含解析一、中考化学计算题1.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是____g。
(2)所用稀硫酸的溶质质量分数____(写出计算过程)。
【答案】19.519.6%【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑65 98 2x y 0.4g659820.4x y g==x=13gy=19.6g混合物中铜的质量为32.5g-13g=19.5g所以稀硫酸中溶质的质量分数为19.6g0010019.600 100g⨯=答:(1)样品中金属铜的质量是19.5g。
(2)所用稀硫酸中溶质的质量分数为19.6%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在 20℃时,称取5g 样品,加入27g 水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去 10%的稀盐酸 36.5g。
(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:(1)样品中氢氧化钠的质量分数。
中考化学真题分类汇编 计算题(含解析)-人教版初中九年级全册化学试题

综合计算题(一)1.(18某某)尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下:CO2+2NH3CO(NH2)2+H2O,请计算:(1)尿素中氮元素的质量分数。
(2)生产6t尿酸理论上需要氨气的质量是多少?化学试题参考答案及评分标准【答案】(1)46.7%t。
【解析】(1)尿素中氮元素的质量分数为:×100%=46.7%(2)设理论上需要氮气的质量为x。
CO2+2NH3CO(NH2)2+H2O3460x6tx tt。
2.(18某某)一种新型“人造树叶”可吸收二氧化碳并转化为乙醇(C2H5OH)燃料,化学方程式为2CO2+3H2O C2H5OH+3O2。
研究显示,一升“人造树叶”每天可从空气中吸收968gCO2。
(1)一升“人造树叶”工作一天可得到乙醇的质量是________?(2)若每天一棵树平均可吸收2,则一升“人造树叶”吸收的CO2相当于_______棵树吸收的CO2。
【答案】(1).506g(2).20【解析】根据反应的化学方程式计算解答。
(1)设一升“人造树叶”工作一天可得到乙醇的质量为x。
2CO2+3H2O C2H5OH +3O28846968gxx=506g(2)968g÷48.4g=20答:(1)一升“人造树叶”工作一天可得到乙醇的质量是506g;(2)若每天一棵树平均可吸收2,则一升“人造树叶”吸收的CO2相当于20棵树吸收的CO2。
3.(18某某)用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如下图所示。
请计算:(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水__________克.(2)当a为80g时,所得溶液中溶质的质量分数是___________(结果精确到0.1%)?【答案】(1)50(2)3.8%【解析】(1)设需要水的质量为x,根据溶质在稀释前后质量不变。
100g×5%=(100g-x)×10%x=50g;(2)根据图像可知,当a为80g时,盐酸与氢氧化钠恰好完全反应。
专题12化学式、化合价及相关计算(解析版)三年(2022-2024)中考化学真题分类汇编(全国通用)

专题12化学式、化合价及相关计算考点01化学式的书写及意义考点02化学用语考点03化合价考点04化学式的简单计算考点01化学式的书写及意义1.(2024·云南·中考真题)某化学符号的意义如下:①表示一种物质;②表示该物质由两种元素组成;③表示1个分子;④表示1个分子由3个原子构成。
下列选项中符合上述描述的是()A.Cl B.HCl C.ClO2D.HClO【答案】C【解析】A、Cl表示氯元素,不符合题意;B、HCl表示氯化氢这种物质,表示1个氯化氢分子,表示氯化氢由氢元素和氯元素组成,表示1个氯化氢分子由1个氯原子和1个氢原子构成,不符合题意;C、ClO2表示二氧化氯这种物质,表示1个二氧化氯分子,表示二氧化氯由氯元素和氧元素组成,表示1个二氧化氯分子由2个氧原子和1个氯原子构成,符合题意;D、HClO表示次氯酸这种物质,表示1个次氯酸分子,表示次氯酸由氢元素、氯元素和氧元素组成,表示1个次氯酸分子由1个氢原子、1个氯原子和1个氧原子构成,不符合题意。
故选:C。
2.(2024·重庆·中考真题)借助模型可以更好地认识物质的微观构成。
下列模型可以用来表示“HCl”的是()A.B.C.D.【答案】D【解析】A.选项模型是由相同的两个原子构成一个分子,而HCl分子是由氢原子和氯原子构成,故不符合题意;B.选项模型一个分子是由三个原子构成,而一个HCl分子是两个原子构成,故不符合题意;C.选项模型只有一个原子,而一个HCl分子是两个原子构成,故不符合题意;D.选项模型一个分子是由两个不同原子构成,因为氯原子半径大于氢原子半径,因此,大圆代表氯原子,小圆代表氢原子,故符合题意,故选D。
3.(2023·陕西·中考真题)下列生活中常见物质的化学式书写正确的是()A .冰:2H OB .铁锈:34Fe O C .黄铜:CuD .食盐:24Na SO 【答案】A【解析】A 、冰是由水分子构成的,水分子的化学式为H 2O ,故选项表达正确;B 、铁锈的主要成分为Fe 2O 3,铁锈属于混合物,没有固定的化学式,故选项表达错误;C 、黄铜是Cu 、Zn 组成的合金,属于混合物,没有固定的化学式,故选项表达错误;D 、食盐是氯化钠的俗称,氯化钠的化学式为NaCl ,故选项表达错误。
最新化学计算题压轴试题分类汇编及答案(word)

最新化学计算题压轴试题分类汇编及答案(word)一、中考化学计算题1.现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。
请在如图画出利用l00g8%的NaOH 溶液吸收CO2与生成NaHCO3的曲线。
____(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
【答案】10.6g 相等三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等【解析】【详解】(1)100g8%的NaOH溶液中含NaOH的质量=100g×8%=8g(2)设碳酸钠的质量为x,与氢氧化钠反应的二氧化碳的质量为y,碳酸氢钠的质量为z,和碳酸钠反应的二氧化碳的质量为a根据2NaOH+CO2=Na2CO3+H2O和 Na2CO3+CO2+H2O=2NaHCO3,可得关系式为:22323 2NaOH~CO~Na CO CO~2NaHCO8044106441688g y x a z804410644168====8g y x a zx=10.6gy=4.4gz =16.8ga=4.4g利用l00g8%的NaOH溶液吸收CO2与生成NaHCO3的曲线,起点4.4、拐点(8.8,16.8)。
如图:(3)三种溶液中所含的钠元素质量相等,根据钠元素守恒和硫元素守恒,可知与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。
最新全国中考化学真题汇编——《计算题》专题(含答案,部分解析)

全国真题汇编《计算题》22. (2019·青海省)市售的某些银首饰是银、锌合金。
小庆同学取该合金样品20g ,加入100g 稀硫酸恰好完全反应,产生气体质量与反应时间的关系如图所示,计算:(1)该合金中锌的质量(精确到0.1g )。
_______(2)该稀硫酸中溶质的质量分数(精确到0.1% )。
______ 【答案】 (1). 6.5g (2). 9.8% 【解析】【详解】(1)由图可知,生成氢气的质量为0.2g ,设该合金中锌的质量为x ,参加反应的硫酸的质量为y ,则:244265982xyZn H SO ZnSO gH 0.2+=+↑65982x y 0.2g==x=6.5g y=9.8g(2)该稀硫酸中溶质的质量分数为:9.8g100%=9.8%100g⨯。
18. (2019·宁夏)中华文化源远流长,早在西汉时期《淮南万毕术》一书中就有“曾青得铁则化为铜”的记载,这是我国现代“湿法炼铜”的先驱。
某大型工厂利用此原理处理含硫酸铜的废液回收金属铜时,向100kg 的废液中加入足量的铁粉,得到金属铜6.4kg 。
(1)计算废液中硫酸铜的质量分数是多少?______(2)金属资源保护的有效途径之一是金属的回收再利用,其它有效途径还有_______(写一条)。
【答案】 (1). 16% (2). 防止金属锈蚀(或寻找金属替代品;有计划合理开采)(答案合理即得分) 【解析】 【分析】硫酸铜和铁反应生成硫酸亚铁和铜。
【详解】(1)设废液中硫酸铜的质量为x44CuSO +Fe =FeSO +Cu 16064x 6.4kg160x =64 6.4kgx=16kg废液中硫酸铜的质量分数为16kg×100%=16%100kg答:废液中含硫酸铜的质量分数为16%。
(2)金属资源保护的有效途径之一是金属的回收再利用,其它有效途径还有防止金属锈蚀(或寻找金属替代品;有计划合理开采)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(化学)中考化学试卷化学化学计算题题分类汇编及解析一、中考化学计算题1.阿司匹林(分子式为C9H8O4)是一种常用解热镇痛药,用于治疗感冒、发烧、头痛等疾病。
某阿司匹林肠溶片说明书的部分内容如图所示。
(1)阿斯匹林的相对分子质量是_____,其中氢、氧元素的质量比是_____。
(2)阿斯匹林中碳元素的质量分数_____;25mg阿斯匹林中含碳元素的质量_____;(3)治疗不稳定性心绞痛时,病人每天服用阿斯匹林肠溶片的最大量是_____片。
【答案】180 1:8 60% 15mg 12【解析】(1)根据相对分子质量为构成分子的各原子的相对原子质量之和、化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据化合物中元素的质量分数=⨯相对原子质量原子个数相对分子质量×100%,化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答;(3)不稳定性心绞痛时,每天阿斯匹林的剂量为75~300mg,据此进行分析解答。
解:(1)阿斯匹林的相对分子质量为12×9+1×8+16×4=180;其中氢、氧元素的质量比为(1×8):(16×4)=1:8。
(2)阿斯匹林中碳元素的质量分数为129180⨯×100%=60%;25mg阿斯匹林中含碳元素的质量为25mg×60%=15mg;(3)不稳定性心绞痛时,每天阿斯匹林的剂量为75~300mg,则病人每天服用阿斯匹林肠溶片的最大量是300mg÷25mg=12片。
点睛:结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力。
2.小明称取用侯氏制碱法制得的纯碱样品(杂质仅为氯化钠)12.4g,加入到100g溶质质量分数为7.3%的稀盐酸中,恰好完全反应。
求所得溶液的溶质质量分数为__________。
【答案】12.5%【解析】【详解】由题意得:100g溶质质量分数为7.3%的稀盐酸中氯化钠的质量为100g×7.3%=7.3g。
设参加反应的Na2CO3质量为x,生成的NaCl的质量为y,生成二氧化碳的质量为z。
2322Na CO +2HCl =2NaCl +CO +H O 1067311744x 7.3gyz1067311744===x 7.3g y z↑解之得x=10.6g ,y=11.7g ,z=4.4g 。
纯碱样品中NaCl 的质量=12.4g-10.6=1.8g 反应后溶液中NaCl 的质量为=11.7g+1.8g=13.5g 。
反应后溶液中NaCl 的质量分数=12.4100 4.413.5gg g g+-×100%=12.5%故答案为:所得溶液中溶质的质量分数为12.5%。
3.为测定某一样品中含杂质的含量,并配制一定溶质质量分数的氯化镁溶液。
进行如下实验:把100g 的稀盐酸加入到20g 含杂质的MgCO 3和MgCl 2的样品粉末中(杂质即不溶于水,也不和盐酸反应),完全反应后得到中性溶液,其操作过程如图。
回答下列问题:(1)写出发生反应的化学方程___;(2)求解混合物中发生反应物质的质量(X)的比例式为___; (3)样品中杂质的含量为___; (4)所得溶液中溶质的质量分数为___;(5)用36.5%的浓盐酸配制100g 上述稀盐酸时,需要此浓盐酸的质量为___。
【答案】MgCO 3+2HCl ═MgCl 2+H 2O+CO 2↑84x =44 4.4g10.5%; 9.5% 20g 【解析】 【分析】碳酸镁和盐酸反应生成氯化镁和水以及二氧化碳。
【详解】根据质量守恒定律可得,生成的二氧化碳的质量为20g+100g 115.6g 4.4g ﹣= 设碳酸镁的质量为X ,HCl 的质量为y ,生成的氯化镁的质量为z3222MgCO 2HCl MgCl H O +=++CO 847395 44xgyz4.4↑84739544===x y z 4.4gx 8.4gy 7.3g z 9.5g=== 样品中杂质的含量为2.1g100%=10.5%20g⨯ 所得溶液中溶质的质量分数为20g-2.1g-8.4g+9.5g100%=9.5%20g-2.1g+100g-4.4g+86.5g⨯ 用36.5%的浓盐酸配制100g 上述稀盐酸时,需要此浓盐酸的质量为7.3g=20g 36.5%4.某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,准确称取25g 放于盛有200g 稀盐酸的烧杯中(杂质不溶于水,也不与稀盐酸反应,也不分解),恰好完全反应。
测得烧杯内物质的总质量与时间的关系如图所示(气体溶解忽略不计),试计算:(1)石灰石中碳酸钙的质量分数是多少?_____ (2)完全反应后所得溶液的溶质质量分数是多少?_____ 【答案】80% 10.5% 【解析】 【分析】根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙的质量和生成氯化钙的质量,进而求算对应质量分数。
【详解】解:根据质量守恒定律可得,生成二氧化碳的质量为225g ﹣216.2g =8.8g 设该石灰石样品中碳酸钙的质量为x ,生成氯化钙的质量为z322210011144xz CaCO +2HCl=CaCl +H O O g+C 8.8↑ 10011144==x z 8.8gx =20g z =22.2g(1)石灰石中碳酸钙的质量分数是20g100%=80%25g⨯ (2)完全反应后所得溶液的溶质质量分数为22.2g100%10.5%216.2g-(25g-20g)⨯≈答:(1)石灰石中碳酸钙的质量分数是80%; (2)完全反应后所得溶液的溶质质量分数为10.5%。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
5.维生素C 又名抗坏血酸,易溶于水,易被氧化,遇热易被破坏,人体缺乏维生素C 可能引发多种疾病,它的化学式是C 6H 8O 6。
计算: (1)维生素C 的相对分子质量为 ;(2)维生素C 中氢元素的质量分数为 (结果保留一位小数)。
【答案】(1)176;(2)4.5% 【解析】本题主要考查学生们对于相对分子质量、元素的质量分数计算的掌握程度。
(1)维生素C 的相对分子质量为:12×6+1×8+16×6=176; (2)维生素C 中氢元素的质量分数=(1×8)/176×100%=4.5%6.将20 g 黄铜(铜和锌的合金)与93.7 g 稀硫酸放入烧杯中恰好完全反应,反应后烧杯中物质的质量为113.5g ,求: (1)产生氢气的质量___。
(2)反应后烧杯里溶液中溶质的质量分数___。
【答案】0.2g 16.1% 【解析】 【详解】(1)根据质量守恒定律可得,产生氢气的质量为:93.7g+20g-113.5g=0.2g ; (2)解:设参加反应的锌的质量为x ,生成氯化锌的质量为y Zn+H 2SO 4=ZnSO 4+H 2↑ 65 161 2 x y 0.2g6516120.2x y g== x=6.5g y=16.1g反应后烧杯里溶液中溶质的质量分数:()16.1g100%16.1%113.5g 20g 6.5g ⨯=--答:产生氢气的质量为0.2g ,反应后烧杯里溶液中溶质的质量分数为16.1% 【点睛】该题为文字计算题,解题关键是反应前后物质质量差为生成气体质量,反应后溶液质量要减去不溶杂质质量7.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:(1)实验过程中产生的CO2气体的质量为___g(2)计算CaCO3中各元素的质量比___.(3)计算反应后的CaCl2不饱和溶液中溶质的质量分数____(写出计算过程,结果精确到0.1%).【答案】(1)4.4;(2)10:3:12;(3)6.3%【解析】(1)根据质量守恒定律可以知道物质减少的质量为生成二氧化碳的质量;(2)根据化学式中某元素的质量比计算解答;(3)根据二氧化碳的质量结合化学方程式可以求算出碳酸钙和生成氯化钙的质量,进而可以求出样品中氯化钙的质量。
解:(1)反应中生成CO2的质量为:12g+100g+100g﹣207.6g=4.4g;(2)CaCO3中各元素的质量比=40:12:(16×3)=10:3:12;(3)设原混合物中 CaCO3的质量为x,生成氯化钙的质量为y。
CaCO3+2HCl═CaCl2+H2O+CO2↑100 111 44x y 4.4g100111444.4gx y==x=10gy=11.1g溶液中氯化钙的质量=11.1g+(12g-10g)=13.1g溶液中氯化钙的质量分数=13.101000 207.6gg⨯ =6.3%答:不饱和溶液中溶质的质量分数为6.3%。
8.BaCl2是一种重金属盐,其水溶液具有很强的毒性,若误服了BaCl2溶液可立即服用MgSO4溶液解毒。
为测定某BaCl2溶液的溶质质量分数,现向BaCl2溶液不断加入MgSO4溶液,并将反应过程中溶液总质量与加入MgSO4溶液的质量关系绘制成曲线如图所示,请回答:(1)P点时溶液中的离子有_____。
(2)求原BaCl2溶液的溶质质量分数。
________【答案】Mg2+和Cl- 20.8%【解析】【详解】加入100g硫酸镁出现明显的拐点,说明此时恰好完全反应。
此时溶液为氯化镁,对应的离子有 Mg2+和Cl-。
根据质量守恒定律可得,生成硫酸钡的质量为100g+100g-176.7g=23.3g解:设原BaCl2溶液的溶质质量分数为xMgSO4+BaCl2=BaSO4↓+MgCl2208 233100gx 23.3g208100x23323.3gx=20.8%答:(1)P点时溶液中的离子有 Mg2+和Cl-。
(2)原BaCl2溶液的溶质质量分数为20.8%。
【点睛】此题为图形计算题,解题关键是对图形的理解,图中转折点表示氯化钡和硫酸镁恰好完全反应,此时消耗硫酸镁溶液的质量为100g,而生成沉淀的质量等于反应前两种溶液质量总和与反应后溶液的质量差,此点也是解答该题的一个重点。
9.为测定石灰石中碳酸钙的质量分数,化学兴趣小组的同学设计了以下方案:将94.4g稀盐酸加入到15g石灰石样品中,恰好完全反应。
生成的二氧化碳气体全部用足量的NaOH 溶液吸收,NaOH溶液增加的质量随时间变化如下表:(友情提示:石灰石中的杂质不参加反应且难溶于水)时间(min)t1t2t3t4t5t6t7t8氢氧化钠溶液增加的质量(g) 1.52 2.53 3.54 4.4 4.4求:(1)最终生成CO2的质量;(2)样品中CaCO3的质量分数(计算结果精确到0.1%);(3)将石灰石与稀盐酸反应后的剩余物质进行过滤,再向滤液中加入多少克水可以得到溶质质量分数为10%的CaCl2溶液。
