《 有机反应方程式的书写》(共36个)
有机物化学反应方程式汇总

有机物化学反应方程式汇总有机物类别官能团主要化学性质烷烃——取代反应:CH4+Cl2CH3Cl+HCl烯烃碳碳双键加成反应:CH2=CH2+HBr CH3-CH2Br,(还可与Br2、H2O、H2在一定条件下发生加成反应)加聚反应:nCH2=CH2-[CH2-CH2氧化反应:使酸性KMnO4溶液褪色炔烃碳碳三键同烯芳香烃苯——取代反应:加成反应:苯的同系物——取代反应:氧化反应:使酸性KMnO4溶液褪色卤代烃—X取代反应:CH3CH2Br+NaOH CH3CH2OH+NaBr消去反应:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O 醇—OH与活泼金属反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑取代反应:CH3CH2OH+HBr CH3CH2Br+H2O消去反应:CH3CH2OH CH2=CH2↑+H2O氧化反应:2CH3CH2OH+O22CH3CHO+2H2O 醛—CHO还原反应(加成反应):CH3CHO+H2CH3CH2OH氧化反应:2CH3CHO+O22CH3COOHCH3CHO+2Ag(NH3)2OH CH3COONH4+2A g↓+3NH3+H2OCH3CHO+2C u(O H)2 +NaOH CH3COONa+Cu2O↓+2H2O 羧酸—COOH酸的通性:如CH3COOH+NaHCO3CH3COONa+H2O+CO2↑酯化反应:CH3COOH+ CH3CH2OH CH3COOCH2CH3+H2O酯—COO—水解反应:CH3COOCH2CH3+H2O CH3COOH+ CH3CH2OH酚极弱的酸性:取代反应:催化剂△催化剂浓硫酸170℃催化剂△催化剂△催化剂△△△催化剂加热催化剂加热光照+HBr+Br2Br催化剂+HNO3—NO2+H2O浓硫酸△+3 H2催化剂△—CH3+3HNO3CH3NO2O2N NO2浓硫酸△+3H2O OHOH+ NaOHONa+ H2OOH+3Br2OHBrBrBr+3HBr↓从反应试剂归纳有机反应反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴烷烃、苯环取代反应CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr H3C-CH2Br醇取代反应CH3CH2OH+HBr CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O H3C-CH2OH酯水解反应CH3COOCH3+H2O CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应CH3CH2OH+ Na CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2 H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2 CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O22CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略催化剂△△催化剂△催化剂△催化剂△乙醇OH+3Br2OHBrBrBr+3HBr↓+3 H2催化剂△。
有机化学反应方程式

有机化学反应方程式1. 烷烃的氧化反应2. 甲烷的氯代反应(游离基的链反应)3. 烷烃的卤代反应 (卤代反应活性:叔氢>仲氢>伯氢 F 2 > Cl 2 > Br 2 > I 2 )4. 环烷烃的自由基取代反应5. 环烷烃的加成反应1)催化加氢(催化加氢易到难:环丙烷>环丁烷>环戊烷。
≥6环烷烃更难。
)2)加卤素C H 2C CH 2+Br 2CH 2—CH 2—CH 2H 2BrBr3)加卤化氢环丙烷的烷基取代物与HX 开环加成, 环的开裂总是在含最多H 和最少H 的碳原子间进行, 氢加到含氢多的碳原子上。
6. 烯烃的亲电加成反应 1)加卤素卤素的活泼性次序:F 2>Cl 2>Br 2>>I 2 (不反应);烯烃与氟加成太剧烈,往往使反应物完全分解,与碘则难发生加成反应。
溴水褪色,可用于鉴别不饱和键:鉴别烷烃和烯、炔。
该加成反应一定是分步进行的 2)加卤化氢烯烃与卤化氢同样发生分步的、亲电性加成反应HX 对烯烃加成的相对活性:HI > HBr > HCl (与极化度有关)+Br2BrBr+ HBrCH 3CH 2CH 2Br+ HICH 3CH 2CH 2CH 2IC +X 2C C C X X C +C C C XHHX实验证明主要产物是(Ⅰ)不对称烯烃与卤化氢等极性试剂加成时,氢原子总是加到含氢较多的双键碳原子上。
这就是马尔可夫尼可夫最初提出的规则,简称马氏规则。
3)加硫酸将产物水解,是工业制备醇的一个方法(间接法)4)加水通常烯烃不易与水直接反应,但在硫酸等强酸存在下,烯烃可与水加成生成醇。
7. 烯烃的催化加氢主要得顺式加成产物。
用途主要有将汽油中的烯烃转化为烷烃;不饱和油脂的加氢;用于烯烃的化学分析8.烯烃的自由基加成反应主要产物是反马氏规则的这种现象又称为过氧化物效应,只局限于烯烃与溴化氢的反应。
这时烯烃与溴化氢发生是自由基加成反应。
《有机化学基础》方程式默写

《有机化学基础》化学反应方程式默写总结(一)烷烃1.甲烷燃烧: CH 4 +2O 2CO 2 + 2H 2O2.甲烷与氯气在光照条件下反应: CH 4 + 3Cl 2 CHCl 3+ 3HCl CH 4 + 4Cl 2 CCl 4 + 4HClCH 4 + 2Cl 2CH 2Cl 2 + 2HCl3.甲烷高温分解: CH 4 C + 2H 2(二)烯烃乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
加成反应与加聚反应1.乙烯与溴的四氯化碳溶液反应:CH 2=CH 2 + Br 2 CH 2BrCH 2Br2.乙烯与水反应:CH 2=CH 2 + H 2OCH 3CH 2OH3.乙烯的催化加氢:CH 2=CH 2 +H 2CH 3CH 34.乙烯的加聚反应:n CH 2=CH 2浓硫酸170℃点燃5. 乙烯与氯化氢加成:H2C=CH2+HCl CH3CH2Cl6.乙烯与氯气加成:CH2=CH2 + Cl2 CH2ClCH2Cl7. 1—丁烯与氢气催化加成:CH2=CH2CH2CH3 +H2CH3CH2CH2CH38.环己烯催化加氢:H2 +9. 1,3环己二烯催化加氢:2H2 +10. 1,3-丁二烯与溴在温度较低和较高时的反应:CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH211. 1,1—二氯乙烯加聚:n CCl2=CH212.丙烯加聚:n H2C=CHCH313. 2—甲基—1,3—丁二烯加聚:n(三)炔烃乙炔的制取:CaC2+2H2O CH≡CH↑+Ca(OH)21.乙炔燃烧: 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应:CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成:CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯: CH≡CH +HCl H 2C =CHCl n H 2C =CHCl(四)芳香烃1.苯的燃烧: 2C 6H 6+15O 2 12CO 2 + 6H 2O2.苯的催化加氢:+ 3H 23.苯与液溴催化反应: + Br 2 + HBr4.苯的硝化反应: +HO -NO 2 + H 2O9.苯乙烯与溴的四氯化碳溶液反应:+Br 210.甲苯与浓硝酸、浓硫酸的混合酸1000C 时获得三硝基甲苯:+ 3HO —NO 2 + 3H 2O11、甲苯与氢气加成12、甲苯与Cl2在光照条件下发生取代反应+3H 2催化剂△CH 3 |—CH 313、甲苯与液溴在溴化铁作用下发生取代反应(六)、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应:CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应:CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O3. 1—溴丙烷与氢氧化钾醇溶液共热:CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O4. 2—氯丙烷与氢氧化钠水溶液共热:CH3CHClCH3 +NaOH CH3CH(OH)CH3+ NaCl5. 2—甲基—2—溴丁烷消去溴化氢:(七)、醇类1.乙醇与钠反应:2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧:CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化:2CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇消去反应制乙烯:CH3CH2OH CH2=CH2↑ + H2O5.乙醇分子间脱水制乙醚:2CH3CH2OH CH3CH2OCH2CH3 + H2O (取代反应)6.乙醇与红热的氧化铜反应:CH3CH2OH+CuO CH3CHO+H2O7.乙醇和浓的氢溴酸加热反应制溴乙烷:C2H5OH+ HBr C2H5Br + H2O(八)、酚类(能和FeCl3溶液反应,使溶液呈紫色)1.苯酚与氢氧化钠反应:+ NaOH + H2O2.苯酚钠与CO2反应:—ONa —OH+CO2+H2O +NaHCO33.苯酚与浓溴水反应:+3Br2↓ + 3HBr(九)、醛类1.乙醛的催化加氢:CH3CHO + H2CH3CH2OH(加成反应,还原反应)2.乙醛的催化氧化:2CH3CHO + O22CH3COOH3.银氨溶液的配制:NHAg++NH3·H2O===AgOH↓++4AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O4.乙醛与银氨溶液反应: CH 3CHO + 2Ag(NH 3)2OH CH 3COONH 4 + 2Ag↓ + 3NH 3 + H 2O5.乙醛与新制氢氧化铜反应: CH 3CHO + 2Cu(OH)2 +NaOHCH 3COONa + Cu 2O↓ + 3H 2O或CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O6、甲醛与苯酚反应制酚醛树脂: 甲醛与苯酚反应:n HCHO + n — + 2n H 2O (缩聚反应)(十)、羧酸1.乙酸与乙醇发生酯化反应:CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O2.乙酸与碳酸钠反应:2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑3.乙酸与碳酸氢钠反应:CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑4.两分子乳酸 CH 3CH (OH )COOH 发生酯化反应脱去两分子水形成六元环:2CH 3CHOHCOOH5、乳酸发生缩聚反应形成高分子△—OH 催化剂 △OH —CH 2— | n] [ 浓硫酸△6、乙二醇和对苯二甲酸发生缩聚反应形成高分子化合物:7.甲酸与银氨溶液反应:HCOOH+2Ag(NH3)2OH (NH4)2 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应:HCOOH+2Cu(OH)2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O(十一)、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解:稀硫酸CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.乙酸乙酯碱性水解CH3COOC2H5+NaOH CH3COONa+C2H5OH(十二)、糖类1、葡萄糖结构:CH2OH—CHOH—CHOH—CHOH—CHOH—CHO2.葡萄糖燃烧:C6H12O6 + 6O26CO2 + 6H2O3.葡萄糖与银氨溶液反应:CH2OH(CHOH)4CHO + 2Ag(NH3)2OH CH2OH(CHOH)4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应:CH2OH(CHOH)4CHO + 2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇:CH2OH(CHOH)4 CHO + H2CH2OH(CHOH)4CH2OH6.葡萄糖在酒化酶作用下获得乙醇:C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解:C12H22O11(蔗糖) + H2O C6H12O6(葡萄糖) + C6H12O6(果糖)8.麦芽糖水解:C12H22O11(麦芽糖) + H2O 2C6H12O6(葡萄糖)注意:蔗糖不含醛基,不可以发生银镜反应;麦芽糖可以发生银镜反应。
高中化学全部化学方程式汇总(有机和无机)

高中化学全部化学方程式汇总(有机和无机)【注意】以下是有机和无机化学方程式的汇总,请按需使用或参考。
为了排版整洁,请在使用时进行适当的调整和修改。
一、有机化学方程式1. 碳氢化合物反应方程式1.1 烷烃燃烧反应:CnH2n+2 + (n + (n/2 + 1)/2)O2 → nCO2 + (n + (n/2 - 1)/2)H2O1.2 烯烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O1.3 异构烷烃燃烧反应:CnH2n + (n + n/2)O2 → nCO2 + nH2O2. 醇类反应方程式2.1 醇的燃烧反应:CnH2n+1OH + (n + (n+1)/2)O2 → nCO2 + (n+1)H2O2.2 醇的脱水反应:CnH2n+1OH → CnH2n + H2O3. 酚类反应方程式3.1 酚的燃烧反应:C6H6O + 15/2O2 → 6CO2 + 3H2O 3.2 酚的酸碱中和反应:C6H6O + NaOH → C6H5ONa + H2O 4. 酯类反应方程式4.1 酯的酸水解反应:RCOOR' + H2O → RCOOH + R'OH 4.2 酯的碱水解反应:RCOOR' + NaOH → RCOONa + R'OH 5. 醛和酮类反应方程式5.1 氧化性还原反应:RCHO + [O] → RCOOH5.2 醛的酸碱反应:RCHO + NaOH → RCOONa + H2O 6. 醚类反应方程式6.1 醚的加热裂解反应:ROR' → R'H + R'OH6.2 醚的酸水解反应:ROR' + H2O → ROH + R'OH7. 脂肪酸类反应方程式7.1 脂肪酸的酸碱反应:RCOOH + NaOH → RCOONa + H2O7.2 脂肪酸的酯化反应:RCOOH + R'OH → RCOOR' + H2O二、无机化学方程式1. 钠和氧的反应方程式4Na + O2 → 2Na2O2. 钙和水的反应方程式Ca + 2H2O → Ca(OH)2 + H23. 硝酸和铜的反应方程式Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O 4. 二氧化碳和水的反应方程式CO2 + H2O → H2CO35. 硝酸和氢氧化钠的反应方程式2NaOH + HNO3 → NaNO3 + H2O6. 硫化氢和氯的反应方程式H2S + Cl2 → 2HCl + S7. 氧化锌和硫酸的反应方程式ZnO + H2SO4 → ZnSO4 + H2O8. 氯气和钾溶液的反应方程式Cl2 + 2KOH → KCl + KClO + H2O9. 溴和钾的反应方程式2K + Br2 → 2KBr10. 硫和氧的反应方程式S + O2 → SO2以上是高中化学的部分有机和无机方程式的汇总,希望能对你的学习有所帮助。
有机化学方程式书写
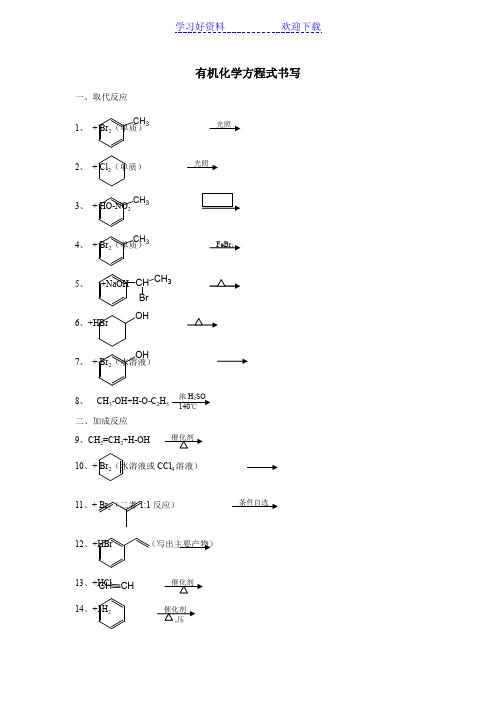
有机化学方程式书写一、取代反应1、+ Br 2(单质)2、 + Cl 2(单质)3、 + HO-NO 24、 + Br 2(单质)5、 +NaOH6、+HBr7、 + Br 2(水溶液)8、 CH 3-OH+H-O-C 2H 二、加成反应9、CH 2=CH 2+H-OH10、+ Br 2(水溶液或CCl 4溶液)11、+ Br 2(二者1:1反应)12、+HBr (写出主要产物)13、+HCl14、+3H 2OH OH CH CHCHBrCH 3CH 3CH 3CH 315、 +H 2(足量)16、+ CH 2=CH 217、+H 2(足量)小结:(1)能与H 2发生加成反应官能团有:(2)能与Br 2发生加成反应的官能团有:三、消去反应18、+NaOH19、+2NaOH20、CH2Br-CH 221、小结:消去反应能发生,在结构上的关键是:四、氧化反应22、+O 223、+O 224、CH 3OH+O 225、+O2小结:醇催化氧化反应能发生,在结构上的关键是:CHOO Br Cl Cl OH H 2C CH H 2C OHCH 2H 3CH 3C H 3COHH 3C H 3H 3C26、27、 + Ag(NH 3)2OH28、+ Cu(OH)2 + NaOH五、酯化反应29、+H-O-C 2H 5 30、 (1mol ) 31、2 六元环状化合物32、 +3 HO-NO 2六、水解反应33、CH 2Br-CH 234、+H 2O35、+ NaOH 36、+ NaOH37、+ NaOHCH CHO CHO CHO H 3C C O18OHC C H 2OH O O H H 3C CH H 2C HC H 2C O O H 3C OOC 2H 5CC H 2OOH 2C O C O38、 + 3 NaOH39、n40、n41、n CH 2=CH 2-CN + n +n42、n43、n HO-CH2-CH2-OH+n HOOC-COOH 44、n 45、n + n HCHO小结:加聚与缩聚反应在生成物上的差别是:八、几个特殊反应46、+Cu(OH)247、+Cu(OH)2 48、6C 6H 5OH+Fe 3+49、C 20H 42CH H 3C CH OHOH H 2C OH H 2C OH H 2C OH HC OHH 2C OH O C H 2CH C H 2C O C 17H 35O C O C 17H 35O C OC 17H 35九、有机物衍变的一般规律(通常以卤代烃为桥烃 卤代烃 醇醛酸CH 3-CH 3CH 3-CH CH 3CH CH 3CHO CH 3COOH 酯CH 2=CH酯22CH 2Cl CH 3CH 2OH COOHCH 3Br CH 3Br CH 3OH CH 3O。
有机化学方程式汇总(详)

39. 乙醇脱水(分子内、分子间) CH3CH2OH
CH2=CH2 ↑+H2O(消去反应)
2CH3CH2OH 浓 H2SO4 CH3CH2—O—CH2CH3+ H2O (取代反应)
140℃
40. 苯酚的电离方程式
电离 OH
O- + H+
41. 苯酚与 NaOH 溶液反应
OH + NaOH
ONa + H2O
4. 甲烷的热分解 CH4 高温 C+2H2
5. 烷烃的热分解 C4H10 △ C2H4+C2H6 C4H10 △ CH4 + C3H6
6. 乙烯实验室制法 CH3CH2OH
H2O + CH2=CH2 ↑
(浓硫酸:催化剂,脱水剂)
7. 乙烯的燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
8. 乙烯通入溴水中 CH2=CH2 + Br2
19. 乙炔通入溴水中 HC CH + Br Br
HCCH Br Br
1, 2 - 二溴乙烷
HCCH + Br Br
Br Br
Br Br HCCH
Br Br
1, 1 , 2 , 2 - 四溴乙烷
20. 乙炔与氢气的加成反应
催化剂 HC CH+ H2 △ H2C CH2
21. 乙炔水化制备乙醛
O
催化剂
NO2 2,4,6-三硝基甲苯
(TNT)
32. 甲苯和氢气的加成反应
CH3
CH3
Ni + 3 H2 △
33. 溴乙烷水解 CH3CH2Br + NaOH H2O,△ 4. 溴乙烷消去反应 CH3CH2Br +NaOH 醇 CH2=CH2↑ + NaBr + H2O
(完整版)有机反应方程式归纳(答案)

有机反应方程式书写(请注明反应条件)一、烷烃、烯烃、炔烃1.甲烷的实验室制法C2H5OH CH2=CH2↑+H2O2.甲烷燃烧CH4+2O2CO2+2H2O3.甲烷与氯气CH4+Cl2CH3Cl+HCl CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HCl4.甲烷隔绝空气时高温分解CH4C+2H25.丁烷的裂解(两个方程式)C4H10CH4+C3H6C4H10C2H4+C2H66.乙烯的实验室制法CH3CH2OH CH2=CH2↑+H2O7.乙烯燃烧C2H4+3O22CO2+2H2O8.乙烯使溴水褪色CH2=CH2+ Br2→CH2 Br─CH2 Br9.乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH10.异戊二烯与溴1:1加成(3种产物,分别写三个方程式)11.异戊二烯与足量溴水反应12.乙烯的加聚13.乙烯与丙烯1:1加聚14.异戊二烯聚合15.苯乙烯与异戊二烯1:1加聚16.乙炔的实验室制法CaC2+2H2O CH CH↑+Ca(OH)217.乙炔与足量氢气反应CH CH+2H 2CH3 -CH318.乙炔的聚合19.由乙炔制备聚氯乙烯CH CH+HCl CH2=CHCl二、苯及其同系物20.苯燃烧2C6H6+15O212CO2+6H2O21.苯与液溴反应22.甲苯的硝化反应23.苯与氢气反应24.甲苯与氯气的取代反应(2个方程式)(一个在铁的催化下,一个在光照下)25.甲苯与浓硝酸、浓硫酸反应三、卤代烃的性质26.溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O27.溴乙烷的水解反应CH3-CH2-Br+ NaOH CH3-CH2-OH+NaBr28.氯苯与氢氧化钠水溶液反应29.2,3-二氯丁烷的消去反应四、醇的性质30.乙醇燃烧C2H5OH+3O22CO2+3H2O31.乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑32.乙醇的催化氧化2C2H5OH+O22CH3CHO+2H2O33.乙醇与浓硫酸反应(两个方程式)CH3CH2OH CH2=CH2↑+H2O2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O34.乙醇与乙酸反应C2H5OH+CH3COOH CH3COOC2H5+H2O35.乙二醇与钠反应36.乙二醇的催化氧化37.甘油与硝酸反应五、酚的性质38.苯酚与钠反应39.苯酚与氢氧化钠反应40.苯酚与浓溴水反应41.苯酚钠与二氧化碳反应42.苯酚与甲醛缩聚六、醛的性质43.乙醛与氢气反应CH3CHO+H2C2H5OH44.苯甲醛与足量氢气反应45.甲醛与新制氢氧化铜反应HCHO+4Cu(OH)2CO2+2Cu2O↓+3H2O46.乙醛与新制氢氧化铜反应CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O47.甲醛与银氨溶液反应HCHO+4Ag(NH3)2OH(NH4)2CO3+2Ag↓+6NH3+2H2O48.乙二醛与银氨溶液反应七、羧酸的性质49.乙酸与钠反应2CH3COOH+2Na2CH3COONa+H2↑50.乙二酸与氢氧化钠反应51.甲酸与少量碳酸钠反应HCOOH+Na2CO3→HCOONa+ NaHCO352.甲酸与过量碳酸钠反应2HCOOH+Na2CO3→2HCOONa+CO2↑+H2O53.乙二酸与乙二醇两分子间脱去1份水54.乙二酸与乙二醇两分子间脱去2份水55.乙二酸与乙二醇缩聚56.对苯二甲酸与乙二醇缩聚57.乳酸(2-羟基丙酸)分子内脱去1份水,生成物能使溴水褪色58.2份乳酸分子间脱去1份水59.2份乳酸分子间脱去2份水60.乳酸的缩聚八、酯的性质61.乙酸乙酯酸性水解CH3COOC2H5+H2O CH3COOH+C2H5OH62.乙酸乙酯碱性水解CH3COOC2H5 +NaOH CH3COONa+C2H5OH63.油酸甘油酯酸性条件下水解64.硬脂酸甘油酯碱性条件下水解65.乙酸苯酯碱性条件下水解九、糖、蛋白质的性质66.葡萄糖与新制氢氧化铜反应67.葡萄糖的银镜反应68.由淀粉制乙醇(发酵法)C6H12O6C2H5OH+2CO2↑69.a-氨基乙酸(甘氨酸)与盐酸反应70.a-氨基乙酸(甘氨酸)与氢氧化钠反应71.a-氨基乙酸2分子间脱去1分子水72.a-氨基乙酸2分子间脱去2分子水73.a-氨基乙酸缩聚。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考难点汇总32 有机反应方程式的书写
写出未曾见过的化学反应方程式或其中的部分物质,需要有一定的类比能力,因而较难。
●难点突破
请试做下列题目,然后自我界定学习本篇是否需要。
为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。
J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:
试写出:
(1)结构简式:F____________、H____________
(2)化学方程式:D→E______________________________________
E+K→J_____________________________________
●案例探究
[例题]已知下列反应在一定条件下发生:
工业上合成有机物J(C19H20O4)过程如下:
上述流程中:a. A−→
−B仅发生中和反应;b.F与浓溴水混合不产生白色沉淀。
(1)写出A、F的结构简式:____________、____________。
(2)写出反应②和③的化学方程式:_______________________,___________________。
命题意图:考查学生根据题给信息完成化学方程式或判定反应产物的能力。
知识依托:题给信息、酸的性质、酯化反应、卤代反应。
错解分析:不能准确理解题给信息,得不出A的准确结构,造成错解。
解题思路:先理解题给信息:
则生成A的反应为:
F是E水解的产物,化学式为C7H7OH,它与浓溴水混合不产生白色沉淀,则
●锦囊妙计
推导有机物的结构或书写有机反应方程式有以下两种方法可依:
1.正推法:根据合成路线由前向后推的方法,即由反应物推生成物的方法。
若题给已知信息,正确理解,即可类比应用。
2.逆推法:根据合成路线由后向前推的方法,即由生成物推反应物的方法。
若题给已知信息,须逆用题给信息,才能得出答案。
●歼灭难点训练
1.(★★★)2001年10月10日,瑞典皇家科学院将该年度诺贝尔化学奖授予在催化手性/不对称合成领域取得原创性贡献和突破性成就的3位科学家,当某有机物分子中的某个碳原子所连接的四个原子或原子团均不相同时,这种碳原子称为手性碳原子,有一个手性碳原子的物质一定具有光学活性。
已知葡萄糖在乳酸菌的催化作用下可转化为含有手性碳原子的乳酸(C3H6O3)。
(1)写出符合C3H6O3组成的饱和有机酸同分异构体的结构简式:
____________、____________、____________、____________。
(2)取9.0 g乳酸与足量金属钠反应,可产生2.24 L气体(标准状况);另取9.0 g 乳酸与等物质的量的乙醇反应,生成0.1 mol 乳酸乙酯和1.8 g H2O。
写出上述两个反应的化学方程式(有机物用结构简式)____________________________、____________________________。
(3)诺贝尔获奖者之一诺尔斯博士的贡献是使用催化不对称氢化反应合成L—DOPA(用于帕金森综合症治疗的药物):
2.(★★★★)下面列出了8种有机物的转换关系:
试写出:
(1)C1的结构简式____________,F1的结构简式____________。
(2)①反应方程式___________________,④反应方程式__________________。
3.(★★★★)以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。
下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2—位碳原子和2—位氢原子相连而得:(Ⅲ)是一种3—羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)。
4.(★★★★★)已知在一定条件下C==C可被KMnO4(H+)(aq)氧化、羰基可与乙炔发生反应:
下列系列反应中,B是生活中常见的有机酸:
试写出:
(1)A的结构简式____________。
(2)下列反应方程式:B−→
−G ;E−→
− F 。
附:参考答案
难点突破
提示:由J逆推(以虚线箭头表示逆推):弯箭头法
结合合成D有机物结构,可知前者是E,后者是K。
由K逆推可得H:
歼灭难点训练
1.提示:(1)C 3H 6O 3分子有1个不饱和度,当位于—COOH 中,另有1个O 原子,可形成—OH ,也可形成醚键。
(2)n (C 3H 6O 3)=
1
-mol
g 90g 0.9⋅=0.10 mol ,n (H 2)=
1
-mol
L 22.4L 24.2⋅=0.100 mol ,可见乳酸分子
含2个羟基:1个羧羟基、1个醇羟基。
根据乳酸分子中含手性C 原子,可确定乳酸的结构。
(3)与H 2加成,烯键变饱和键。
醇。
3.提示:乙烯制正丁醇,“C2”变“C4”,如何使碳链增长,根据题给信息,可由乙醛自身加成而完成。
但乙醛自身加成成羟醛,应先消去羟基,再将醛基还原,可生成正丁醇。
这样,可先由乙烯制乙醛,方法有二:①乙醛氧化法;②乙醛水化成乙醇、乙醇氧化法;前者较简捷。
答案:①CH2==CH2+O2−→
−2CH3CHO(或其他方法)
②2CH3CHO−→
−CH3—CH(OH)—CH2—CHO
③CH3CH(OH)—CH2CHO−→
−CH2==CH—CH2CHO
(或CH3—CH==CH—CHO)
④CH2==CH—CH2CHO(或CH3—CH==CHCHO)+2H2−→
−CH3—CH2CH2CH2OH 4.提示:先逆向理解题给信息②。
