物理化学
物理化学知识点(全)
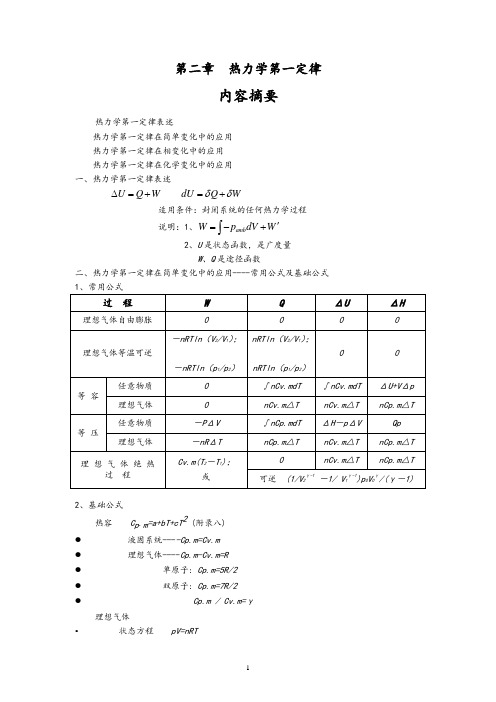
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学概念

物理化学概念1.电化学: 研究电能和化学能相互转化及转化过程中有关规律的科学.2.原电池: 将两支电极插入电解质溶液中形成的,能自发地在两极分别发生氧化和还原反应,使化学能转化为电能的装置.3.电解池: 将接有外电源的两支电极插入电解质溶液中,迫使两极分别发生氧化和还原反应,将电能转变为化学能的装置.4.正极: 电极电势较高的电极.5.负极: 电极电势较低的电极.6.阴极: 发生还原反应的电极.7.阳极: 发生氧化反应的电极.8.离子迁移规律: 在电场的作用下,阳(正)离子总是向阴极迁移,阴(负)离子总是向阳极迁移.9.电极反应规律: 在阳极,电极电势愈负(小)的电对,愈先发生氧化反应;在阴极,电极电势愈正(大)的电对,愈先发生还原反应.10.电流传导规律: 整个电流在溶液中的传导是由阴、阳离子的移动而共同承担的.11.法拉弟定律: (1).通电于电解质溶液后,在电极的两相界面上发生化学变化的物质的量与通入的电量成正比,与一式量该物质发生反应时,参加反应的电子数成反比.(2).通电于串联电解池,在各电极上发生反应的物质的物质的量与其氧化数的变化值的乘积都相同. Fz Q n j j =; FQ z n z n z n z n z n B B A A j j =+====...2211 12.离子迁移数: 离子j 所传导的电流(量)与总电流(量)之比. QQ I I t j j j == 13.摩尔电导率: 把含有1mol 电解质的溶液置于相距为单位距离的两个平行电极之间时所具有的电导. c V Λm m κκ==14.柯尔劳施离子独立运动(迁移)定律: 在无限稀溶液中,离子彼此独立运动,互不影响,无限稀释电解质的摩尔电导率等于无限稀释时阴、阳离子的摩尔电导率之和. ∞--∞++∞+=,,m m m v v Λλλ(化学计量单元),∞-∞+∞+=,,m m m Λλλ(类元电荷计量单元)15.离子强度: 溶液中各离子的浓度与其价数的平方的乘积之和的一半.∑=221j j z m I 16.可逆电池: 将化学能以热力学可逆的方式转化为电能的装置称为可逆电池.包括化学反应可逆和能量交换可逆两个方面.17.可逆电极:(1).第一类电极: 将金属浸入含该金属离子的溶液中构成的电极.包括金属电极、卤素电极和气体电极(2).第二类电极: 在金属上覆盖一层该金属的难溶盐后浸入含该难溶盐阴离子的溶液中构成的电极.包括金属-难溶盐电极、金属-难溶氧化物电极和难溶氧化物-难溶盐电极(3).氧化-还原电极:18.氢标还原电极电势: 规定标准氢电极的电极电势为0V .以标准氢电极为负极,指定电极为正极组成的电池的电动势.18.液体接界电势: 在两种不同的电解质溶液或同种电解质但浓度不同的溶液的界面间产生的电势差.它是由于离子的扩散速率不同造成的,是不可逆的.也称扩散电势.19.分解电压: 使某电解质溶液能连续不断地进行分解时所需(必须)的最小外加电压.20.极化: 在有电流流过电极时,电极的电极电势偏离平衡电极电势的现象.21.超电势: 在某一电流密度下,电极的电极电势与其平衡电极电势的差值的绝对值.22.速率方程: 表示化学反应的反应速率与浓度等参数间的关系式, 或浓度与时间等参数间的关系式.也称动力学方程.前者是微分速率方程,后者是积分速率方程.23.反应速率: 单位时间单位体积内发生的化学反应的反应进度 或 单位体积内,反应进度随时间的变化率. tc v t V r j jd d 1d d 1⋅=⋅=ξ(恒容) 24.反应机理/反应历程: 表示一个总包(复杂)反应所经历的具体途径的若干基元反应的有序集合。
物理化学名词解释归纳

一.名词解释1.离子迁移数:是指在一电解质溶液中各种离子的导电份额或者导电百分数。
2.独立组分数:用以确定平衡体系中所有各相组成所需的独立物质的最少数目称为独立组分数。
3.摩尔燃烧焓:是指1mol有机化合物在指定温度标准大气压下完全燃烧生成稳定的产物时的反应热。
4.等电点:蛋白质所带的正负电荷数相等即净电荷为0时的pH称为蛋白质的等电点。
5.扩散:物质从高浓度区自发向低浓度区迁移,使其分布趋向均匀的过程称为扩散。
6.对峙反应:也称可逆反应,是指在正方向和逆方向上可以同时进行的反应,且正逆反应速率的大小可相比拟。
7.可逆过程:是指系统内部及系统与环境之间每一瞬间都接近于平衡态的过程。
8.摩尔电导率:表示在两个相距1m的平行电极间,1mol电解质溶液所具有的电导。
9.HLB值:即亲水亲油平衡值,用来表示表面活性物质的亲水性和亲油性的相对强弱。
10.乳状液转型:是指在外界某种因素的作用下,乳状液由O/W型变成W/O型,或者由W/O型变成O/W 型的过程。
11原子发射光谱:是指由物质内部运动的原子和分子受到外界能量后而得到的光谱。
12.自由度:在不引起旧相消失和新相生成的前提下,可以在一定范围内变动的独立变量如浓度温度压力的数目称为自由度。
13.离子选择电极:是指具有离子感应膜,可以把溶液中某种离子的活度转换成相应电势的电极,它是某离子的指示电极。
14.负吸附:溶液的表面张力随着溶质的加入儿升高,表面过剩为负,称为负吸附。
15.吸附平衡:当气体分子在吸附剂表面聚集与逃离吸附剂表面两个过程的速率相等时,体系达到平衡,称为吸附平衡。
16.乳状液:是由一种或几种液体以小液滴的形式分散于另一种与其互不相容的液体中形成的多相分散体系。
二.简答题1.简述可逆过程的特点.(1)可逆过程是由一连串无限接近平衡态额微小变化组成,因变化的动力和阻力相差为一无穷小量,因而过程进行得无限缓慢。
(2)若循原过程相反的方向无限缓慢变化,可使体系与环境同时恢复原状。
物理化学简介

• 概论
•物质的聚集状态
气体 V 受 T、p 的影响很大 V 受T、p 的影响较小 (又称凝聚态)
液体
固体
•联系 p、V、T 之间关系的方程称为状态方程 •本章中主要讨论气体的状态方程 理想气体 气体的讨论 实际气体
29
§1.1 理想气体状态方程
1. 理想气体状态方程 低压气体定律: (1)波义尔定律(R.Boyle,1662): pV = 常数 ( n ,T 一定)
解:M甲烷 = 16.04×10-3 kg · -1 mol
m pM ρ V RT 200 103 16.04 103 k g m 3 8.315 (25 273.15) 1.294k g m 3
33
§1.1 理想气体状态方程
2.理想气体模型
(1)分子间力
•相互作用 相互吸引—范德华力(趋向力,诱导力,色散力) 相互排斥—分子间电子云、原子核间排斥力
25
0.3 物理量的表示及运算
3. 量值计算
物理化学的公式中均表示成量方程式的形式, 而在对量的数学运算中,有时涉及数值方程式。
[例如] 计算25℃,100kPa下理想气体的摩尔体积Vm =? •用量方程式运算
RT 8.315J m ol1 K 1 (273.15 25) K Vm 3 p 100 10 Pa
物理化学名词解释

名词解释1.热:由系统与环境之间的温度差而引起的能量传递。
2.功:系统与环境之间其他一切被传递的能量称为功。
3.热力学能:是系统中物质的所有能量的总和。
4.热容:在无化学反应和相变化且非体积功为零的条件下,封闭系统吸收的热δQ与温度的升高dT成正比,比例系数为系统的热容,用C表示。
5.系统:将一部分物质从其他部分划分出来,作为研究的对象,称为系统。
6.环境:与系统密切相关的物质和空间称为环境。
7.敞开系统:系统环境之间既有物质的交换,又有能量的传递。
8.封闭系统:系统与环境之间没有物质的交换,只有能量的传递。
9.孤立系统:系统与环境之间既无物质的交换,也无能量的传递。
10.电子导体:也称为第一类导体,通过自由电子的定向迁移来实现其导电的目的。
11.离子导体:也称为第二类导体,依靠正、负离子的定向迁移来实现其导电的目的。
12.电解池:将电能转化为化学能的装置叫电解池。
13.原电池:将化学能转化为电能的装置叫原电池。
14.化学动力学:研究反应速率和各种因素(例如浓度、压力、温度)对反应速率的影响。
15.基无反应:由反应物微粒(分子、原子或自由基等)一步直接生成产物的反应。
16.总包反应:由多个基无反应组成的反应称为总反应。
17.反应速率:化学反应进行的快慢程度,用单位时间内反应物或生成物的物质的量表示。
18.催化作用:一种或多种少量的物质,能使化学反应的速率显著增大,而这些物质本身在反应前后的数量及化学性质都不改变。
19.自催化作用:催化剂可以是有意识的加入反应体系的,也可以是在反应过程中自发产生的。
后者是一种或几种反应产物的中间产物,称为自催化剂,这种现象称为自催化作用。
20.相界面:将两种分开的界面21.表面张力:在液体表面存在一种使液面收缩的力,称表面张力。
22.液面铺展:液体在另外一种与其不互溶的液体表面自动展开成膜的过程。
23.胶束:当浓度增加到一定程度时,表面活性剂分子的疏水基通过疏水相互作用缔合在一起而远离水环境向内、亲水基朝向水中向外形成了多分子聚集体,称为胶束。
物理化学的主要内容包括

物理化学的主要内容包括
:
1. 动力学:运动的原理,能的定义,熵的概念,热力学,动力学等。
2. 化学平衡:溶液的溶解度、能量障碍及改变,静态及动态平衡,平
衡常数及平衡常数的改变,萃取平衡,反应化学平衡,皿热反应等。
3. 电离和离子竞争:电解反应、离子竞争、活性空穴及电荷构型的调节,吸附反应及calvin- wheeler竞争,体系电荷分布及滴定反応等。
4. 化学催化:催化原理及作用机制,原位及连续催化,非权衡催化反
应的特性,络合催化,分子催化等。
5. 固体表面和电场:表面状态及表面电荷,消散电荷谱,电场及偏振,极化材料及表面电荷型复合物等。
6. 分子量和热力学:分子量及其热力学特性,热力学不平衡性及能量
分配,分子结构,热量放射,热电材料等。
物理化学知识点总结

第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程:1221ln ln p p nRT V V nRT W ==2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂=定压热容与定容热容的关系:nR C C =-V p 热容与温度的关系:C p =a +bT +c’T 2 四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V 可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ; 利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B m r θθν∆=∆∑反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。
物理化学基础知识

一、测量⒈长度L:主单位:米;测量工具:刻度尺;测量时要估读到最小刻度的下一位;光年的单位是长度单位。
⒉时间t:主单位:秒;测量工具:钟表;实验室中用停表。
1时=3600秒,1秒=1000毫秒。
⒊质量m:物体中所含物质的多少叫质量。
主单位:千克;测量工具:秤;实验室用托盘天平。
二、机械运动⒈机械运动:物体位置发生变化的运动。
参照物:判断一个物体运动必须选取另一个物体作标准,这个被选作标准的物体叫参照物。
⒉匀速直线运动:①比较运动快慢的两种方法:a 比较在相等时间里通过的路程。
b 比较通过相等路程所需的时间。
②公式:1米/秒=3.6千米/时。
三、力⒈力F:力是物体对物体的作用。
物体间力的作用总是相互的。
力的单位:牛顿(N)。
测量力的仪器:测力器;实验室使用弹簧秤。
力的作用效果:使物体发生形变或使物体的运动状态发生改变。
物体运动状态改变是指物体的速度大小或运动方向改变。
⒉力的三要素:力的大小、方向、作用点叫做力的三要素。
力的图示,要作标度;力的示意图,不作标度。
⒊重力G:由于地球吸引而使物体受到的力。
方向:竖直向下。
重力和质量关系:G=mg m=G/gg=9.8牛/千克。
读法:9.8牛每千克,表示质量为1千克物体所受重力为9.8牛。
重心:重力的作用点叫做物体的重心。
规则物体的重心在物体的几何中心。
⒋二力平衡条件:作用在同一物体;两力大小相等,方向相反;作用在一直线上。
物体在二力平衡下,可以静止,也可以作匀速直线运动。
物体的平衡状态是指物体处于静止或匀速直线运动状态。
处于平衡状态的物体所受外力的合力为零。
⒌同一直线二力合成:方向相同:合力F=F1+F2 ;合力方向与F1、F2方向相同;方向相反:合力F=F1-F2,合力方向与大的力方向相同。
⒍相同条件下,滚动摩擦力比滑动摩擦力小得多。
滑动摩擦力与正压力,接触面材料性质和粗糙程度有关。
【滑动摩擦、滚动摩擦、静摩擦】7.牛顿第一定律也称为惯性定律其内容是:一切物体在不受外力作用时,总保持静止或匀速直线运动状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• •
lβ (A+B) G 1.0 D
* tB
t
* A
100
•
lα (A+B) C
g(A+B)
•
l α(A+B)
80
E lα (A+B) lβ (A+B)
60
•
F 0.0 H2O(A) 0.2 0.4 wB 0.6
•
0.8 n-C4H9OH(B)
二组分液态部分互溶系统的气二组分液态部分互溶系统的气-液平衡相图
p= p + p
* A
* B
当两种液体共存时, 当两种液体共存时,不管其相对数量 如何, 如何,其总蒸气压恒大于任一组分的蒸气 而沸点则恒低于任一组分的沸点。 压,而沸点则恒低于任一组分的沸点。 通常在水银的表面盖一层水,企图减少汞蒸气, 通常在水银的表面盖一层水,企图减少汞蒸气,其 实是徒劳的。 实是徒劳的。
TB 以下是单一液相区, 以下是单一液相区,
以上是两相区。 以上是两相区。
二组分液态部分互溶系统的液二组分液态部分互溶系统的液-液平衡相图
二组分液态部分互溶系统的液二组分液态部分互溶系统的液-液平衡相图
(3)同时具有最高、最低会溶温度 )同时具有最高、 如图所示是水和烟碱的 溶解度图。 溶解度图。 在最低会溶温度 TC' (约 334 K)以下和在最高会溶温 以下和在最高会溶温 以上, 度 Tc (约481K)以上,两液体 以上 可完全互溶, 可完全互溶,而在这两个温 度之间只能部分互溶。 度之间只能部分互溶。 形成一个完全封闭的溶度曲 曲线之内是两液相区。 线,曲线之内是两液相区。
(1)具有最高会溶温度 ) H 2 O - C6 H5 NH2 系统在常温下 只能部分互溶,分为两层。 只能部分互溶,分为两层。 下层是水中饱和了苯胺, 下层是水中饱和了苯胺,溶解 度情况如图中左半支所示;上层 度情况如图中左半支所示; 左半支所示 是苯胺中饱和了水, 是苯胺中饱和了水,溶解度如图 右半支所示 升高温度, 所示。 中右半支所示。升高温度,彼此 的溶解度都增加。到达B点 的溶解度都增加。到达 点,界 面消失,成为单一液相。 面消失,成为单一液相。 B点温度称为最高临界会溶温度(critical consolute 点温度称为最高临界会溶温度( 点温度称为最高临界会溶温度 T TB 水和苯胺可无限混溶。 temperature) B。温度高于 ,水和苯胺可无限混溶。 )
离子液体-scCO2中进行的金属催化的反应 离子液体
Ⅰ、Phase diagrams of G - L equilibria 1. Diagrams of ideal mixtures of liquids (1) p - x 图
pA = p xA pB = p xB
∗ B
∗ A
p
p
∗ A
p = p A + pB
2.液固体系 液固体系
理想 正偏差 负偏差
2.3固态部分互溶 固态部分互溶 2.4形成化合物 形成化合物
稳定化合物 不稳定化合物
1.1.1 理想的完全互溶双液系
理想的完全互溶双液系
P-x 图
T-x 图
理想的完全互溶双液系
1.1.2二组分真实液态混合物的气液平衡相图
P-x 图
T-x 图 P-x 图
超临界技术应用:反应超临界技术应用:反应-分离耦合
CO2(sc or compressed) CO2
products reactants or ionic liquid MLn(cat.) CO2 ionic liquid reactants/products reactants/products ionic liquid MLn(cat.)
φ =2 φ =2 φ =2
f=1 f=2 f=1
n (NH3(g)) : n (CO2(g)): n (H2O(g)) = 1: 1: 1 NH3(g))
建立的平衡体系的自由度数; 例2 (1)CO2(s) 与CO2(g) 建立的平衡体系的自由度数; (2) 由HgO(s)分解为 分解为Hg(g)及O2(g)建立的平衡体系 分解为 及 建立的平衡体系 的自由度数。 的自由度数。 解: (1) C = S - R - R´= 1 – 0 – 0 = 1 f=C-φ+2=1–2+2=1 (2) C = S - R - R´= 3 – 1 – 1 = 1 f=C- φ+2=1–2+2=1
二组分液态部分互溶系统的液-液平衡相图 二组分液态部分互溶系统的液 液平衡相图
二组分液态部分互溶系统的液二组分液态部分互溶系统的液-液平衡相图
(4) ) 不具有会溶温度 乙醚与水组成的双液 系,在它们能以液相存在 的温度区间内, 的温度区间内,一直是彼 此部分互溶, 此部分互溶,不具有会溶 温度。 温度。
例3 试确定H2(g)+I2(g)=2HI(g)的平衡系统中,在下 试确定H (g)=2HI(g)的平衡系统中 的平衡系统中, 述情况下的独立组分数(1)反应前只有 述情况下的独立组分数(1)反应前只有HI(g);(2)反 反应前只有HI(g);(2)反 应前H (g)和 (g)两种气体的物质的量相等 (3)反 应前H2(g)和I2(g)两种气体的物质的量相等;(3)反 两种气体的物质的量相等; 应前有任意的H (g)和 (g)。 应前有任意的H2(g)和I2(g)。 解:(1) C = S - R - R´= 3 – 1 – 1 = 1 (2) C = S - R - R´= 3 – 1 – 1 = 1 (3) C = S - R - R´= 3 – 1 – 0 = 2
二组分液态部分互溶系统的液二组分液态部分互溶系统的液-液平衡相图
帽形区外,溶液为单一液相, 帽形区外,溶液为单一液相, 帽形区内,溶液分为两相。 帽形区内,溶液分为两相。 在373 K时,两层的组成分 时 别为A’和 ,称为共轭层 别为 和A”,称为共轭层 ),A’和 (conjugate layers), 和A” ), 称为共轭配对点 A 共轭配对点。 称为共轭配对点。 n是共轭层组 成的平均值。 成的平均值。 临界会溶温度。 所有平均值的连线与平衡曲线的交点为临界会溶温度 所有平均值的连线与平衡曲线的交点为临界会溶温度。 会溶温度的高低反映了一对液体间的互溶能力, 会溶温度的高低反映了一对液体间的互溶能力,可以 用来选择合适的萃取剂。 用来选择合适的萃取剂。
G
60
lβ (A+B)
0.0
•
•1.0
H2O(A)n-C4H9OH()H2O(A) - n-C4H9OH(B) 系统的相图
二组分液态部分互溶系统的气二组分液态部分互溶系统的气-液平衡相图
wB 0.0 t/℃ ℃ 120 0.2 p=常数 常数 wB=0.58 g(A+B) 0.4 0.6 0.8 1.0
T
a o b
物系点:代表体系总组 物系点 成的点(o)。 相点:代表各相组成的点 相点 (a 、b)。 (a) 在封闭体系中发生相 B 变时,物系点沿垂线 变化
A xB X0 yB 两相平衡时 n总 X B = nl xB + ng y B
(b)两相平衡时物系点和 n总 = nl + ng 相点在一条水平线上 ng ( y B − X B ) = nl ( X B − xB )
1.1 二组分液态完全互溶
1.1.2真实液态混合物 真实液态混合物
1.双液系 双液系
1.2二组分液态完全不互溶 二组分液态完全不互溶 1.3二组分液态部分互溶 二组分液态部分互溶 2.1固态不互溶 简单低共熔混合物 固态不互溶/简单低共熔混合物 固态不互溶 2.2固态完全互溶 固态完全互溶 特点 相图 应用
T1 T2 T3
xB P=p0
B
Tb,B xB B
A
T Td Tb
G T1 L+G L T2 B T3
p0
L
p0
L
A
xB
p0 G
Tb:液体开始沸腾的温度 ----泡点 泡点(bubble point) 泡点 Td: 气体开始冷凝的温度 ---- 露点(dew point) 露点(
露点线(气相线) 泡点线(液相线)
t/℃ p1=常数 g(A+B) wB=0.48
• •
* tB
C
* tA •
g(A+B)
•
l α(A+B)
D
lα (A+B)
lα
lβ
•
F wB
A
• G
部分互溶系统的温度-组成图 部分互溶系统的温度 组成图
lβ (A+B) B
E
二组分液态部分互溶系统的液二组分液态部分互溶系统的液-液平衡相图
(2)具有最低会溶温度 ) 水-三乙基胺的溶解 三乙基胺的溶解 度图如图所示。 度图如图所示。 在 TB温度(约为 温度(约为291.2K) ) 以下, 以下,两者可以任意比例 互溶,升高温度, 互溶,升高温度,互溶度 下降,出现分层。 下降,出现分层。
