表面吸附量的测定
溶液表面吸附量的测定.

溶液表面吸附量的测定(3学时)一、目的要求1、了解溶液表面吸附量的物理意义及其测定原理。
2、了解最大气泡法测定溶液表面张力的基本原理和方法。
3、了解弯曲液面的附加压力与液面弯曲度、溶液表面张力之间的关系。
二、实验原理当一种溶质溶于水形成溶液时,溶质在溶液表面的浓度与其在溶液本体中的浓度存在着差别,这种现象称为溶液的表面吸附。
理论上,可用“表面吸附量”(或称表面超量)表示溶液的表面吸附程度大小,表面吸附量的物理化学意义是指溶质在溶液表面处的浓度与其在溶液本体中浓度的差值,通常用符号表示,其SI 单位为mol.m -2。
Γ在恒温、恒压条件下,表面吸附量(mol m -2)、溶液中溶质的活度和溶液表面张力Γa 三者之间的关系可用式(8.1)中的Gibbs 等温式进行描述:()1N m γ−(8.1)a d RT da γΓ=−在浓度不太大时,可以采用浓度代替活度,因此Gibbs 等温式可写成:()1mol L c −a (8.2)c d RT dc γΓ=−可见,只要通过实验测得溶液的表面张力与溶质浓度的关系曲线,即可利用公式γc (8.2)计算得到某一个浓度条件下的表面吸附量。
c Γ例如,图8.1为溶液表面张力随溶质浓度的变化曲线,若要求溶质浓度为时溶液的表1c 面吸附量,可在浓度轴上点作浓度轴的垂线,该垂线与关系曲线相交于A 点,1Γ1c ~c γ则曲线在A 点处切线AB 的斜率即为,由图8.1可知,AD 为纵轴的垂线,则有d dc γ。
又因为,则得到,代入到式(8.2)中即可DB AD d dc γ=1AD c =()1DB c d dc γ=求出浓度为时溶液的表面吸附量。
1c对于溶液表面吸附,可以采用Langmuir 理想吸附模型描述表面吸附量与溶液浓度Γc 之间的关系,即:(8.3)1kc kc θ∞Γ==Γ+γBD 1图8.1表面张力随浓度的变化关系曲线式(8.3)中,为溶质分子对溶液表面的覆盖百分率;为溶液的最大吸附量,对于θ∞Γ给定的体系,一定条件下是常数;为吸附常数∞Γk 可以将式(8.3)重排为直线形式:(8.4)1c c k ∞∞=+ΓΓΓ以对作图可得到一条直线,根据直线的截距和斜率可以求得最大吸c Γc 1k ∞Γ1∞Γ附量和吸附常数。
溶液表面吸附的测定实验报告

溶液表面吸附的测定实验报告实验报告:溶液表面吸附的测定实验目的:1. 了解溶液表面张力的测定方法;2. 理解溶液中表面吸附现象的产生和作用;3. 掌握X方法测定特定物质的表面吸附现象。
实验原理:当溶液与固体表面接触时,由于表面活性剂的存在,表面物质会吸附在固体表面上,形成薄膜。
表面吸附现象与溶液温度、浓度、pH值等因素密切相关,其大小与固体表面性质、溶质分子结构、外界环境温度、压力、湿度等因素有关。
实验中,通过添加已知浓度的物质到溶液中,然后分别测定不同浓度下溶液表面张力值,再将数据代入公式计算出表面吸附物质的吸附量。
实验仪器和试剂:1. 表面张力计;2. 磁力搅拌器;3. 鱼油酸钠试剂(0.1mol/L);4. 标准盐酸(0.5mol/L);5. 微量滴定管。
实验步骤:1. 准备工作:清洁实验仪器和试剂瓶口,定量取出所需试剂。
2. 将100mL二甲苯溶液倒入清洁的烧杯中,加入脱氧鱼油酸钠浸泡1小时,搅拌均匀。
3. 用干净针头涂取适量已浸泡好的鱼油酸钠溶液滴到表面张力计的平衡槽中;4. 将磁力搅拌器调整至适当转速,使溶液中的表面张力尽量平衡;5. 记录稳定状态下的表面张力值;6. 依次加入不同浓度的标准盐酸,重复第4-5步操作,测定不同浓度下的表面张力值;7. 计算出不同浓度下的表面吸附物质的吸附量。
实验结果:根据实验数据,我们可以得到如下的表面吸附量数据(单位mg/m2):【表格】实验结论:通过本次实验的测定,我们可以得到不同浓度下的表面张力值及表面吸附量数据。
从实验数据中可以看出,表面吸附量会随着浓度的增加而增加,这与表面吸附物质分子与溶剂分子接触几率增加的结论相符。
通过本实验可进一步认识表面吸附现象,有助于我们深入了解该现象在工业生产和实际应用中的作用。
实验注意事项:1. 实验仪器需保证干净,以免影响实验结果;2. 实验试剂需定量取用,并注意浓度值,以保证实验数据的准确性;3. 操作过程中需严格按照实验流程进行,确认数据和记录结果时应谨慎。
物化实验复习题

物化实验复习题电导的测定及应⽤1、电离度与浓度、摩尔电导率、平衡常数的关系?答:根据电离度的公式可得以下规律①浓度: 因浓度越稀,离⼦互相碰撞⽽结合成分式的机会越少,电离度就越⼤,②摩尔电导率: 摩尔电导率越⼤,电离度越⼤。
③平衡常数:电离平衡常数越⼤,电离度越⼤。
(另外平衡常数只与温度有关2、电导使⽤的电极答:铂⿊电导电极3、注意事项1)实验⽤⽔必须是重蒸馏⽔,其电导率应1 10S/m. 电导率测量应迅速进⾏,否则空⽓中的0O2溶⼊⽔中变为CO3,使电导率快速增加2)测量硫酸铅溶液时,⼀定要⽤沸⽔洗涤多次,以除去可溶性离⼦,减⼩实验误差装3)由于电解质溶液电导受温度影响较⼤所以试验中要恒温,测量必须在同⼀温度下进⾏。
稀释的重蒸馏⽔也需要在同温度下恒温后使⽤4)每次测定前,电导电极必须洗净,电极要轻拿轻放,切勿触碰铂⿊。
盛待测液的容器必须清洁,没有离⼦污染,以免影响实验结果。
思考题:1.弱电解质的电离度a与哪些因素有关?答:弱电解质的浓度、温度、加⼊的其它电解质等。
2.强、弱电解质溶液摩尔电导率与浓度的关系有什么不同?答:对于强电解质溶液,在浓度很低时其Am和JC呈线性关系:⽽对于弱电解质溶液,Am和VC不呈线性关系。
(因此,强电解质由直线外推法测得^ )3.为什么要测纯⽔的电导率?答:因为纯⽔的电导率很⼩,可以作对导电溶液的参考标准.4.何谓极限摩尔电导率,弱电解质的极限摩尔电⽚率是如何得到的?答: Am (⽆穷):溶液在⽆限稀释时的摩尔电导率就称为极限摩尔电导率。
丙酮碘化反应1、吸光度与碘的浓度的关系?答:呈正⽐,它与碘的浓度关系: A=dLc (E为摩尔吸光系数,L为溶液的厚度)。
2、式=k[a] ⽥[2①与=k[a] 时②相⽐,为什么少了碘的浓度?答:实验研究表明,除⾮在很⾼的酸度下,丙酮的碘化反应的速率才与碘的浓度有关。
⼀般酸度下,反应速率与碘的浓度⽆关。
3、求反应级数的⽅法?答:采⽤改变物质⽐例的微分法,求反应级数。
物理化学-表面张力及表面吸附量的测定-175
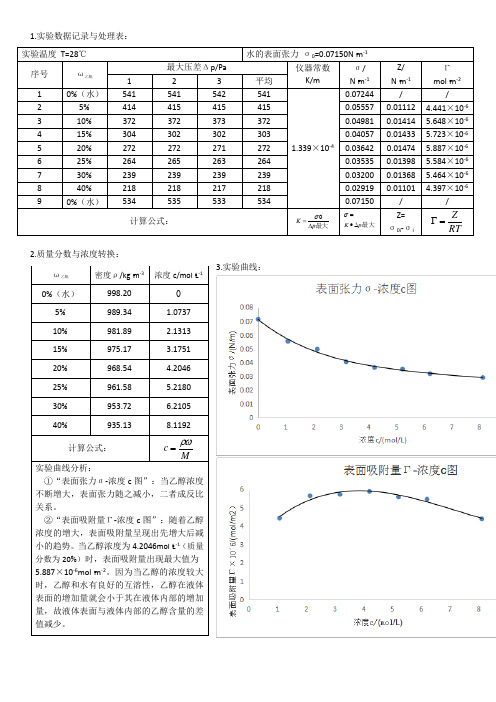
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
5.5-2固体表面上的吸附

2
固体表面是均匀的, 固体表面是均匀的,各晶格 位置处吸附能力相同, 位置处吸附能力相同 , 每个 位置吸附一个分子。 位置吸附一个分子 。 吸附热 是常数,与覆盖率无关。 是常数,与覆盖率无关。
固体表面是均匀的, 固体表面是均匀的 , 各晶格 位置处吸附能力相同。 位置处吸附能力相同 。 因第 二层以上各层为相同分子间 的相互作用, 所以除第一层 的相互作用 , 所以 除第一层 其余各层吸附热都相等, 外 , 其余各层吸附热都相等 , 为被吸附气体凝结热。 为被吸附气体凝结热。 被吸附在固体表面上的分子 横向相互之间无作用力。 横向相互之间无作用力。 相互之间无作用力 当吸附达到平衡时, 当吸附达到平衡时 , 每一层 上的吸附速率与解吸速率都 上的 吸附速率与解吸速率都 相等。 相等。
(
)
朗缪尔公式的优缺点: 朗缪尔公式的优缺点: 若固体表面比较均匀,吸附只限于单分子层,该式能较 固体表面比较均匀,吸附只限于单分子层, 表面比较均匀 好代表实验结果。 一般化学吸附及低压高温物理吸附, 好代表实验结果。对一般化学吸附及低压高温物理吸附, 该式均取得很大成功。 该式均取得很大成功。 当表面复盖率不是很低时, 当表面复盖率不是很低时,被吸附分子间的相互作用不 可忽视;实际上,固体表面并不均匀, 可忽视;实际上,固体表面并不均匀,吸附热随覆盖率θ 而变,该公式与实验发生偏差。此外,对多分子层吸附也 而变,该公式与实验发生偏差。此外, 不适用。 不适用。
(3)吸附经验式—弗罗因德利希公式
弗罗因德利希提出含有两个常数的指数经验方程, 弗罗因德利希提出含有两个常数的指数经验方程,来描述 中压范围内,第一类吸附等温线 吸附等温线: 中压范围内,第一类吸附等温线:
k 为单位压力时的吸附量,随温度升高而降低;n 在0 与 为单位压力时的吸附量,随温度升高而降低;
吸附法测定实验报告

吸附法测定实验报告吸附法测定实验报告引言:吸附法是一种常用的实验方法,用于测定物质在固体表面的吸附量。
通过测量吸附物质在固体表面的浓度变化,可以得到吸附等温线,进而研究吸附过程的特性。
本实验旨在通过吸附法测定不同条件下某种物质的吸附量,并分析吸附等温线的特点。
实验方法:1. 实验仪器及试剂准备:本实验使用的仪器包括吸附仪、恒温槽、电子天平等。
试剂为待测物质溶液。
2. 实验步骤:(1)将恒温槽调节至设定温度,并待温度稳定。
(2)将吸附仪中的试样舱与对比舱分别加入一定量的待测物质溶液。
(3)将试样舱放入恒温槽中,设定一定的吸附时间。
(4)吸附结束后,取出试样舱,用电子天平称量其质量变化。
(5)重复以上步骤,改变吸附时间或温度,进行多次实验。
实验结果:通过实验测得吸附物质在不同条件下的吸附量数据,并绘制吸附等温线图。
实验讨论:1. 吸附等温线的形状:根据实验结果绘制的吸附等温线图可以看出,吸附等温线呈现出不同的形状。
在低温下,吸附量随着吸附时间的增加而逐渐增加,但增加速度逐渐减缓;而在高温下,吸附量随着吸附时间的增加而迅速增加,之后趋于饱和。
这说明在不同温度下,吸附过程的速率和平衡状态有所不同。
2. 吸附速率与温度的关系:通过对比不同温度下的吸附等温线图可以发现,随着温度的升高,吸附速率也相应增加。
这是因为在高温下,分子热运动加剧,分子与固体表面的碰撞频率增加,从而增加了吸附速率。
这一结论对于理解吸附过程的动力学机制具有重要意义。
3. 吸附容量与温度的关系:根据实验结果可以观察到,在一定范围内,随着温度的升高,吸附容量也相应增加。
这是因为在高温下,分子热运动增强,吸附物质与固体表面的相互作用力减弱,从而使吸附容量增大。
然而,当温度超过一定范围时,吸附容量反而会下降,这可能是由于吸附物质分子在高温下的热解或解吸导致的。
结论:通过吸附法测定实验,我们得到了不同条件下某种物质的吸附等温线,并对吸附过程的特性进行了分析。
溶液表面吸附的测定

溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc dσRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc dσ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc dσ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。
Gibbs公式
2.5 Gibbs公式
图2-2脂肪酸水溶液的表面张力和酸浓度的关系 1-甲酸;2-乙酸;3-丙酸;4-丁酸;5-戊酸;6-己
酸;7-庚酸;8-壬酸;9-葵酸
2.5 Gibbs公式
特劳勃规则虽是经验规律,但却可以由此得出颇有意义的结论。郎缪尔指出,特劳 勃规律就等于说将1摩尔(-CH2-)自本体相移至表面需作功640卡。他的证明如 下。
Γ = − p ⋅ dγ = − 1 dV
RT dp kT d ln p
图2-11由于吸附烃蒸汽,使 水的表面张力降低
1- 正戊烷;2 三甲基戊烷,3 一正已烷. 4 一正庚烷;5 一正 辛烷
2.5 Gibbs公式
★固汽界面吸附 吉布斯公式也适用于固汽界面的吸附,一 般常通过测定吸附量,求得表面超量Γ,从 而计算固体表面张力的改变,即
物质常称为“非表面活性物质”。其特点是 d γ > 0
dc
Γ2σ 为负值,这时溶质在表面层的浓度比溶液内部小(负吸附),即溶质具有表面 亏量,图中1型曲线属于此类。
溶液的表面张力与表面活性
类型2:溶液表面张力随溶液浓度增加而逐渐降低。这种类型的例子包括 大多数低分子量的极性有机物。如醇、醛、酸、酯、胺及其衍生物。 由于水溶性有机化合物一般含有一个极性基(如 OH 基或 COOH 基) 和一个非极性碳氢基团。这类分子倾向于聚集在表面层,它们的取向 是把极性部分指向体相溶液中的极性水分子,非极性部分朝向气相。 这种类型的数学特征是
dγ
dc
<
0,
d 2γ
dc2
<0
Γ2 σ
为正值,这就是说溶质在表面层的浓度比溶液内部大(正吸附),即溶质具 有表面超量。
类型3:这种类型的特点是;当浓度增加时,γ迅速下降并很快达最低 点,此后溶液表面张力随浓度变化很小。达到最低点时的浓度一般在 1%以下。在水中加入高直碳链的有机酸以及烷基磺酸盐(RCOO-Na+ 和R-SO3-Na+)等属这种类型。此类溶液的特点是:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验十九 表面吸附量的测定
预习题
1.为什么表面活性物质水溶液的表面张力随溶液浓度的变化而变化?
2.用气泡最大压力法测表面张力时,为什么气泡必须均匀缓慢冒出?
3.为什么毛细管端要刚好与液面接触?若毛细管端浸入溶液,则使最大压力差变大还使变小?为什么?
4.毛细管常数如何测定?
5.表面吸附量Γ的物理意义是什么?
6.浓度为4.00×10-4 mol·L -1时的溶液表面吸附量如何得到?此表面吸附量的单位是什么?
7.分析影响本实验结果的因素有哪些?
一.实验目的
1.用气泡最大压力法测定十六烷基三甲基溴化铵水溶液的表面张力。
从而计算溶液在某一浓度时表面吸附量Γ。
2.熟悉斜管压力计的使用方法。
二.实验原理
1.在指定的温度下,纯液体的表面张力是一定的,一旦在液体中加入溶质成溶液时情况就不同了,溶液的表面张力不仅与温度有关,而且也与溶质的种类,溶液浓度有关。
这是由于溶液中部分分子进入到溶液表面,使表面层的分子组成也发生了改变,分子间引力起了变化,因此表面张力也随着改变,根据实验结果,加入溶质以后在表面张力发生改变的同时还发现溶液表面层的浓度与内部浓度有所差别,有些溶液表面层浓度大于溶液内部浓度,有些恰恰相反,这种现象称为溶液的表面吸附作用。
根据吉布斯吸附等温式
12.303lg cd d RTdc RT d c
σσΓ=-=- (1) 式中,Γ代表溶液浓度为c 时的表面上溶质的吸附量(mol·m -2),c 代表平衡时溶液浓度(mol·L -1),R 为理想气体常数(8.314 J·mol -1·K -1),T 为吸附时的温度(K )。
从(1)式可看出,在一定温度时,溶液表面吸附量与平衡时溶液浓度c 和表面张力随浓度变化率d dc
σ成正比关系。
当0d dc
σ<时,Γ > 0表示溶液表面张力随浓度增加而降低,则溶液表面发生正吸附,此时溶液表面层浓度大于溶液内部浓度。
当0d dc
σ>时,Γ < 0表示溶液表面张力随浓度增加而增加,则溶液表面发生正吸附,此时溶液表面层浓度小于溶液内部浓度。
我们把能产生显著正吸附的物质(即能显著降低溶液表面张力的物质)称为表面活性物质。
本实验用表面活性物质十六烷基三甲基溴化铵配制成一系列不同浓度的水溶液。
分别测定这些溶液的
表面张力σ,然后以σ对lg c 作图得一曲线。
求曲线上某一点的斜率
lg d d c
σ,可计算该点对应浓度溶液的表面吸附量。
2.本实验测定各溶液的表面张力采用气泡最大压力法,此法原理是当毛细管与液面接触时,往毛细管内加压(或在溶液体系内减压)则可以在液面的毛细管出口处形成气泡。
如果毛细管半径很小,则形成的气泡基本呈球形。
而气泡在形成过程中是在变化的。
当开始形成气泡时,表面几乎是平的,即这时的曲率半径最大,随着气泡的形成,曲率半径逐渐变小,直到形成半球形。
这时曲率半径R 与毛细管半径r 相等,曲率半径达最小值。
此时附加压力为产生气泡的最大压力。
此时
22p R r
σσ∆== (2) 其中,Δp 为最大附加压力,r 为毛细管半径(此时等于气泡的曲率半径R ),σ为表面张力。
当密度为ρ的液体作压差计介质时,测得与Δp 相应的最大压差为Δh m 。
按(2)式得
m m 22
r r p h g K h σ∆∆ρ∆=== (3)
其中K 在一定温度时仅与毛细管半径r 有关,称毛细管常数,此常数可以从已知表面张力的标准物质测得。
三.仪器与试剂
表面张力测定仪1套(包括带支管的大试管,毛细管和滴液减压器)
斜管压强计1台 吸耳球
各种浓度的表面活性物质溶液 蒸馏水 铬酸洗液
YYT —200斜管压力计的工作原理,结构及使用方法
(一).工作原理
YYT —200斜管压力计是一种可见液体弯曲的多测量范围液体压力计,其原理(见图)是当测量表压时,需要测量压力的空间和宽广器相连通,而当测量负压时则与倾斜管相连通,在测量压差的情况下,则把较高的压力和宽广器接通,而把较低压力和倾斜管接通。
设在所测压力的作用下,与水平线之间有倾斜角度α的管子内工作液体在垂直方向升高了一个高度h 1,而在宽广容器内的液面下降了h 2,那时在仪器内工作液体面的高度差将等于:
h = h 1 + h 2 (1)
式中,
h = n sin α (2)
其中,n 为斜管上的压力读数(mm )。
假如F 1代表管子的截面积,F 2代表宽广容器的截面积则:
n F 1 = h 2F 2 (3)
也就是在倾斜管内所增加的液体体积n F 1,等于宽广容器内所减少的液体体积h 2F 2。
把式(2)和(3)代入式(1)中可得:
12
sin F h n F α=+
或
12sin F p nr F α⎛⎫=+ ⎪⎝
⎭ 式中,p 为所测的压力(mm 液柱),r 为工作液体的比重(g ·mL -1)
(二).结构
YYT-200斜管压力计是测量倾斜角度可以变更的压
力计,它的结构如附图,在宽广器(10)中充有工作液
体(酒精),与它相连的是倾斜测量管(8),在倾斜测量
管上标有长度为250 mm 的刻度,宽广器装牢在三个定
位螺钉(9)一个水准指示器(2)的底板(1)上,在底
板上还装着弧形支架(3),用它可以把倾斜测量管固定
在五个不同倾斜角度的位置上,而得到五种不同的测量
上限值,刻在支架上的数字0.2、0.3、0.4、0.6、0.8表
示常数因子12sin F r F α⎛
⎫+ ⎪⎝⎭
的数值。
把工作液体的液面调整到零点,是用零位调整旋扭
(5)调节浮筒浸入工作液体的深度,来改变宽广器(10)内酒精的液面,而将测量管内的液面调整到零点。
在宽广容器上装有多向阀门(11),用它可以使被测压力与宽广器相遇,或与测量管相通。
仪器的水准位置可根据底板上的水准指示器用左右两个定位螺丝来定位。
(三).使用方法
1.将仪器放置在平面无震动影响的工作台上,调整仪器底板左右两个定位螺丝,使仪器处于水平位置,将倾斜测量管按测量值固定在相应的常数因子值上。
2.旋开宽广器上的加液盖,缓缓地加入比重为0.810 g·cm -3的酒精,使其液面在倾斜测量管上的刻线始点附近,然后把加液盖仍按在原位,将阀门柄(6)拨在“测压”处,用橡皮管接在阀门的“+”压接头上,轻吹橡皮管,使倾斜测量管液面上升到接近于顶端处,排出存留在宽广容器和倾斜测量管道之间的气泡反复数次,至气泡排尽为止。
3.将阀门柄仍拨回“校正”处,旋动零位调整旋钮校正液面的零点。
若旋钮已旋至最低位置。
仍不能使液面升至零点,则宽广容器中所加酒精过少,
应再加入酒精,使液面稍高于零处,再用旋钮调至零
处,反之酒精过多,可轻吹套在阀门“+”压接头上
的橡皮管,使液面从斜管的上端接头处溢出多余的酒
精。
4.测量阀门柄拨在“测压”处,如被测压力高于
大气压力时,将被测量的压力管子接在阀门的“+”
压接头上;如被测压力低大气压力时,将阀门中间的
接头和倾斜测量管上的接头用橡皮管相通,将被测量
的管子接在阀门的“-”压接头上;如测量压力差时,
则将被测的高压管接在阀门的“+”压接头上,被测
压力的低压管接在阀门的“-”压接头上,阀们中间的
接头和倾斜测量管上端的接头用橡皮管接通。
本实验
中,高压为大气压,不必接“+”。
5.在测量过程中,如欲校对液面零位是否符合,可将阀门柄拨至“校正”处进行校正。
气泡最大压力法测溶液表面张力的装置
四.实验步骤
1.实验前将毛细管和试管用洗液洗净,按图装好全套装置。
2.在大试管中盛入水,放入毛细管,使毛细管管口刚好与液面相接触,缓慢打开放水活塞,使气泡从毛细管端尽可能慢慢地放出(每分钟约4~6个气泡),待气泡均匀稳定地放出时,读取斜管压力计上的最大压差Δh m值读取三次,取平均值,计算毛细管常数K。
3.按上述方法将表面活性物质水溶液按浓度从小到大的次序分别测定各自的Δh m值。
五.数据记录与处理
1.毛细管常数的测定。
室温大气压
由(3)式计算毛细管常数K,并将K值填入表中。
2.溶液表面吸附量Γ的测定。
由(3)式计算不同浓度溶液的表面张力σ,并把相应的Δh m值填入表中(溶液浓度在试剂瓶标签上找)。
以σ对lg c作图得一曲线。
计算溶液浓度c = 4.00×10-4 mol·L-1时的溶液表面吸附量。
六.思考题
1.本实验为何要测定毛细管常数K?
2.测定溶液表面张力时,为何要使毛细管端刚好与液面相接触?
3.试述溶液表面吸附量的物理意义。
