认证监督处工作流程图
GMP认证流程

药品GMP 认证流程1、申报企业到省局受理大厅提交认证申请和申报材料2、省局药品安全监管处对申报材料形式审查(5个工作日)3、认证中心对申报材料进行技术审查(10个工作日)4、认证中心制定现场检查方案(10个工作日)5、省局审批方案(10个工作日)6、认证中心组织实施认证现场检查(10个工作日)7、认证中心对现场检查报告进行初审(10个工作日)8、省局对认证初审意见进行审批(10个工作日)9、报国家局发布审查公告(10个工作日)一、申报条件:1、新开办药品生产企业,药品生产企业新建、改建、扩建药品生产车间或者新增生产剂型的,应当自取得药品生产证明文件或者经批准正式生产之日起30日内,按照规定向药品监督管理部门申请《药品生产质量管理规范》认证。
2、注射剂、放射性药品、国家食品药品监督管理局规定的生物制品药品GMP认证由国家食品药品监督管理局组织认证。
3、除注射剂、放射性药品,国家食品药品监督管理局规定的生物制品外其它药品GMP 认证由省食品药品监督管理局组织认证。
4、药品生产企业应在《药品GMP证书》有效期届满前6个月,重新申请药品GMP认证。
二、办理程序:(一)申请:申请人向省政务大厅食品药品监督管理局窗口提交《药品GMP认证申请书》(一式两份)及申请书电子文档,并附相关材料。
(二)受理:申请材料经省政务大厅食品药品监督管理局窗口形式审查符合要求的,予以受理,出具受理通知书;申请材料不齐全或者不符合形式审查要求的,5个工作日内发给申请人《补充材料通知书》;不予受理的出具《不予受理通知书》。
(三)现场检查:经形式审查符合要求的转入技术审查,技术审查符合要求的安排现场检查。
技术审查需要补充材料的,一次性书面通知申请企业。
企业应在2个月内报送,逾期未报的中止认证工作.(四)审查:省食品药品监督管理局对现场检查报告进行审核和审批,符合认证标准的报国家食品药品监督管理局予以公告,公告无异议的,颁发《药品GMP认证审批件》和《药品GMP 证书》,公告有异议的,组织调查核实。
监理工作程序流程图(通用)

监理工作程序流程图(通用)监理工作程序流程图(通用)1、施工阶段进度控制计划在工程承包合同中,确定工期总目标。
承包单位和建设单位根据工期总目标编制施工总进度计划,应附有编制材料设备采购计划、劳动力使用计划、施工机械使用计划。
监理工程师审批施工总进度计划并编制年、季、月度计划。
编制说明中应包括上月实际完成工程量、当月(年)计划完成工程量、计划提前或拖后的原因分析以及拟采取的对策。
审批年、季、月度计划后,按计划组织实施,监理工程师检查计划执行情况,基本符合计划要求的继续施工,否则签发严重偏差计划通知书,纠正计划偏差,向建设单位建议调整,直至更换施工队伍,最终实现工期总目标。
2、施工阶段投资控制程序签定施工合同后,业主、施工、监理三方进行施工图纸会审,设计、施工、业主、监理四方进行工程预付款申请,承包单位施工图纸实施,材料、设备采购,业主、监理、施工单位联合考察厂家材料、设备等。
监理工程师审核预付款申请,审定设计变更及工程洽商申请,审核已完分项工程报验单、计量申请、索赔申请,否认可的申请不予审核。
最终监理工程师审批并签认付款认证,否则进行索赔审批,最终报送业主付款。
3、月工程款支付监理核签程序工程项目施工合格后,承包单位报月支付申请,监理工程师审定工程变更费用、技术洽商费用、工程索赔费用、其他各项费用,并确定计量项目合格、计量部位、工程量及工作量。
如果不同意,则由XXX组织协调。
最终总监理工程师签发月支付证书,建设单位审核并签字支付给承包单位。
4、施工阶段质量控制程序承包单位申报分项分部工程方案并经监理审批后,申报材料合格证、复验单,如不合格则加倍复试或换材料,进行整改。
各分项隐蔽工程自检,如不合格则填报工程报验单,并附上隐蔽工程检验单、预检单、质量保证资料、分项工程质量评定表。
最终监理工程师进行现场检查及审查实验报告。
在签证单上签字认可后,向监理方申报工程报验单并附上地基处理质量验收记录、质评表及相关资料。
建筑公司各项工作流程图(操作表)(所有部门)

确认签证
确认签证
变更签证单 工程资料存档
-10-
福建鸿禹建设发展有限公司
隐蔽工程验收管理 工作流程
隐蔽工程施工
隐蔽工程自检
隐蔽工程资料填写
隐蔽工程报验
验收不合格
验收合格
实施工序隐蔽
资料归档
-11-
福建鸿禹建设发展有限公司
做好基础工作
搭建 工程 资料 管理 体系
配备 资料 管理 员
建立 资料 管理 制度
项目技术负责人提出编写纲要
明确编制人
下达编制令 生产、预算、材料、设备帮助
建筑部分编写
装修部分编写
安装部分编写
项目技术负责人检查编写情况并解决存在的问题
项目技术负责人初审
修改并汇总成稿
审批不合格
报公司审批
施组的过程修改
发放、报验、归档
-7-
福建鸿禹建设发展有限公司
作业指导书的编制与管理 工作流程
选择作业指导书编制目标 作业指导书编制
8、相关政策 性调整文件 及规定
部门负责人复核, 并专题向领导汇报
是
9、业主奖励、 责任扣款及 罚款的资料
上报甲方进行审核
与甲方核对结算
是
双方签字确认
出结算报告, 资料存档
-16-
福建鸿禹建设发展有限公司
明确负责统计工作人员
规定统计工作职责
配备统计工作资源 统计员掌握工程造价、 合同等基本情况 制定阶段性统计工作 计划
设 置 七 牌 两 图
悬 挂 安 全 标 识
四 通主材设 一体料备 平挂合合 合密理理 理目堆防 绿网放护 化
设
做
置保好
两临证垃
区时卫圾
监督审核

监督审核1.监督审核的概念监督审核是指认证机构对获得认证的企业在证书有效期限内所进行的定期或不定期的(复审)。
其目的是验证获证组织的职业安全健康管理体系是否持续符合职业安全健康管理体系审核规范的要求,并在有效运行,从而确认能否继续持有和使用认证机构颁发的认证证书和认证标志的审核。
OHSMS认证机构对获准认证的受审核方在证书有效期内(一般为3年)应定期实施监督审核,确保受审核方的OHSMS持续地符合职业安全健康管理体系试行标准、体系文件以及法律、法规和其他要求,确保持续有效地实现既定的OHS方针和目标。
此外,受审核方由于各种原因在某一时期内可能会发生以下情况的变化:(1)活动、产品或服务的变化,如在现有厂区引入新物质、新工艺和新设备,从而带来新的OHS风险;(2)有关的法律、法规和其它要求的变化,如国家废除旧的法律、法规、,颁布新的法律、法规;(3)组织职业安全卫生管理体系文件的变化,通过和管理评审,可能针对体系运行中出现的问题进行了文件方面的更改,或者出于持续改进的需要,更新了OHS方针、目标和管理方案。
为了维护认证资格,针对上述变化对职业安全健康管理体系也会作出相应的调整,监督审核也应确保其持续的符合性、有效性和适宜性。
认证后的监督审核包括定期和不定期的(复审)以及对获证组织使用证书和认证标志的管理。
2.监督审核的类型监督审核通常分为两类,即例行(定期)监督和不定期监督。
(1)例行监督审核不同类型的企业因其本身OHS风险的复杂性及其风险的大小不同,采取监督审核的时机、频次和深度均有所区别。
一般来说,两次例行监督审核之间的间隔不超过一年。
对于某些OHS风险较大的企业,如建筑、化工、煤矿等,则应适当增加审核的频次。
有时还将例行监督的时机与获证企业的生产进度相结合。
随着企业的OHSMS逐渐趋于完善和稳定,并成功通过复评的获证组织,认证机构则可以视企业的具体情况,适当降低监督审核的频次。
每次监督审核应派出正式审核组,按照初次现场审核的程序进行,但人日数一般为初次现场审核的1/3,特殊专业将适度增加。
CQC产品认证工作流程图

注意:1.请将签署了的本通告书随认证申请资料一并寄往中国质量认证中心产品认证二部邮寄地址:北京市南四环西路188号九区邮编:1000702。
申请人已同意并保证本通告各页所定的条款和条件未经CQC产品认证二部同意,不会对本通告的内容及文本进行任何更改。
本通告的签署人已完全被授权代表申请人签署本通告。
1、术语解释:申请人:指的是向CQC产品认证二部申请获得产品认证证书的法人、其他组织。
申请人是产品认证证书的持有人.代理人:指的是被申请人授权在涉及产品认证相关事宜方面代表申请人提出认证申请的机构。
2、联系方式:申请人:(请填写完整的公司法定名称)法定代表人:(请填写营业执照上的企业法人或负责人)联系人:(请填写本授权书所载信息,公司的联系人)职务:联系地址:ﻩ(请填写完整的通讯地址)邮编:电话:ﻩﻩﻩﻩ传真:手机: E-mail:代理人:(请填写完整的公司法定名称)法定代表人:(请填写营业执照上的企业法人或负责人)联系人:(请填写本授权书所载信息,公司的联系人) 职务:联系地址:(请填写完整的通讯地址)邮编:电话:ﻩﻩ传真:手机: E—mail:3、申请人已知应履行以下职责:3.1申请人已授权代理人在涉及产品的认证相关事宜方面代表申请人向CQC产品认证二部提出认证申请。
具体产品认证范围及授权内容详见附表。
3.2 如申请人希望收回某一代理人的授权,申请人应事先通过书面的形式告知CQC产品认证二部. 3.3申请人同意CQC产品认证二部在任何时候决定终止与作为申请人的授权代表人的代理活动。
3.4申请人按本授权书所示授权代理人的代理活动,申请人同意CQC产品认证二部可与该代理互通申请人的机密的或专有的信息3.5申请人授权CQC产品认证二部可将未加密的机密信息和其他信息通过互联网或公共网络发到申请人或代理提供的电子邮件地址或其他地方.如发生意外泄密,CQC产品认证二部无须承担由此类传送而引起的任何损害赔偿的责任。
产品CMC认证流程说明
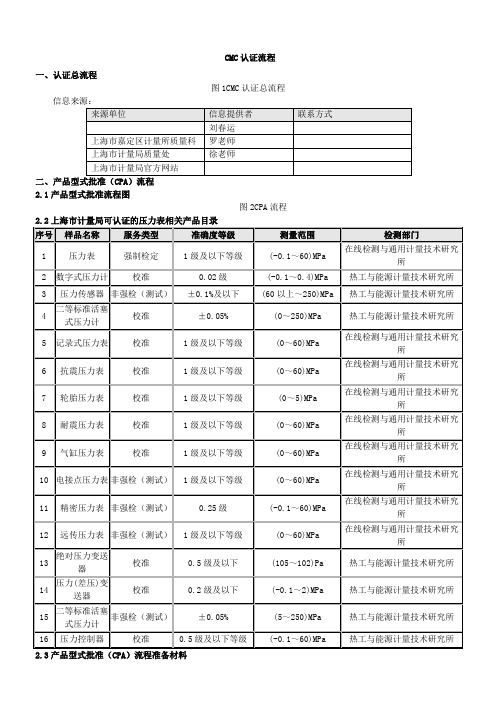
CMC认证流程
一、认证总流程
图1CMC认证总流程信息来源:
2.3产品型式批准(CPA)流程准备材料
该流程主要目的是为了拿到CMC认证编号,CMC是“中华人民共和国制造计量器具许可证”标志,是“ChinaMetrologyCertification”的英文缩写,意为中国制造计量器具许可证,拿到该编号产品可以正常上市销售。
认证周期:5个工作日内作出是否受理的决定,45个工作日技术评审,总周期约为3个月;
具体费用:审核费用约为4-7万元,试产品检测内容而定;
具体流程如下:
办理机构
五、问题解答
5.1借用他人《制造、修理计量器具许可证》。
质检部各岗位职责、日常管理规定与质量工作流程图

质检部各岗位职责、⽇常管理规定与质量⼯作流程图质量管理部各岗位职责及⽇常管理规定第⼀章质检部各岗位职责⼀、质检部主要⼯作内容1、负责组建公司质量管理体系,推动公司ISO9000质量管理体系的运⾏;2、负责制定原材料、外协件、制程、半成品、成品的检验规范;3、负责原材料、外协件、半成品、成品⼊库前检验;4、负责⽣产过程的质量控制及监督;5、负责计量和质量监测仪器的全⾯管理;6、负责对不合格品的判定、处置和分析,对纠正和预防措施的监督;7、负责竣⼯资料的制作;8、负责收集产品质量信息,建⽴和保存各种质量技术和检验记录,进⾏数据统计和分析;9、负责对研发的新产品进⾏检验,提出问题点并跟踪解决的结果;10、负责定期分析与质量⽬标的差异,并提出相应对策;⼆、部门主管岗位职责1、严格遵守、执⾏国家各项法律、法规及公司与部门管理制度,协助总经理⼯作,全⾯主持质检部⽇常管理;2、负责建⽴、健全部门管理制度,公平执⾏奖惩与考核;3、负责建⽴和完善质量保证体系,确保产品质量的稳定提⾼;4、负责公司质量事故的处理,根据公司的《质量责任追究管理办法》进⾏;5、负责与技术、⽣产、营销等相关部门的协调⼯作;6、负责质检部相关费⽤的审核;7、负责完成上级安排的其他⼯作。
三、质量⼯程师岗位职责1、严格执⾏国家、地⽅的各项法律、法规及公司与部门管理制度,协助部门主管做好质检部的管理、协调、服务⼯作;2、负责⼚内总装、外协制作产品的质量管理;3、负责为质检员提供相应的检验标准和⽅法;4、负责制作指导质检员完成各⼯序产品的《检验标准》制作;5、负责完成质检部主管安排的其他⼯作;6、负责制定《项⽬质量策划》。
四、进料质检员岗位职责1、严格执⾏国家、地⽅的各项法律、法规及公司与部门管理制度;2、负责公司原材料、辅料及外购件的检验⼯作,若在⽣产中发现材料及外购件不合格,有权制⽌继续作业,并要求相关部门改善;3、负责根据《报检单》进⾏的质检⼯作;4、负责编制、修改有关⽣产材料、外购件的《检验标准》;5、负责完成部门主管交办的其它事项。
机关人事任免、财务、纪检等流程图

通知甘人口委办知字〔2011〕37号
甘肃省人口和计划生育委员会办公室关于
印发《廉政风险点及防控措施和工作流程》的通知机关各处(室)、委属各事业单位:
为扎实推进人口计生系统惩治和预防腐败体系建设,增强人口计生干部廉政风险防控意识,对权力运行实施全程监控,确保权力正确行使。
根据岗位职责、行政管理事项和业务工作程序,加强对重点部位、关键环节、重大事项的廉政风险防范管理,形成以岗位为点、以程序为线、以制度为面的廉政风险防控机制,把廉政制度和风险防控措施落实到人口计生业务各项工作流程,结合实际,制定了人口计生廉政风险点及防控措施一览表和工作流程图(见附表1-8),经省人口委审定,现印发给你们,请认真贯彻落实。
二〇一一年五月四日
抄送:各市(州)人口委
附表:
干部任免廉政风险点及防控措施一览表1
庆阳市人口委人事干部任免流程图
“评优评先及征集活动”廉政风险防控措施一览表2
庆阳市人口委“评优评先及征集活动"流程图
财务预算、决算及预算执行工作廉政风险点及防控措施一览表3
庆阳市人口委财务预算、决算及预算执行工作流程图
财务工作廉政风险点及防控措施一览表4
财务工作流程图
内部审计工作廉政风险点及防控措施一览表5
内部审计工作流程图
基建项目申报廉政风险点及防控措施一览表6
庆阳市人口委基本建设项目申报流程图
招投标廉政风险点及防控措施一览表7
招投标工作流程图
内部采购廉政风险点及防控措施一览表8
庆阳市人口委采购工作流程图。
