内酰胺类抗生素复合制剂
医院内注射用B内酰胺类抗生素皮试原则

医院内注射用ß-内酰胺类抗生素皮试原则1凡使用青霉素类、含酶抑制剂的ß-内酰胺复合制剂的患者均须作青霉素皮试:皮试阴性者可以应用。
1.2 皮试阳性者禁用。
1.3 凡停用72h及72h以上者,均应重做药物过敏试验。
1.4 曾发生青霉素或头孢菌素药物过敏性休克、急性喉头水肿、急性肺水肿、剥脱性皮炎的患者,禁作青霉素皮试。
2 使用头孢菌素类及其它ß-内酰胺类药物一般情况下无须做皮肤过敏试验:2.1. 有以下情况者需皮试:a 确系过敏体质的患者、青霉素皮试阳性者,在接受头孢菌素及其它ß-内酰胺类注射剂治疗前,均应做原液皮试;b 对厂家在药品说明书中明确规定使用前应做皮肤过敏试验的头孢菌素及其它ß-内酰胺类药物,按药品说明书规定执行。
2.2. 曾发生青霉素或头孢菌素药物过敏性休克、急性喉头水肿、急性肺水肿、剥脱性皮炎的患者,禁作头孢菌素其它ß-内酰胺类药物皮试。
2.3. 确实具有对某种头孢菌素药物过敏史的患者,原则上不再使用头孢菌素,如必须使用,则尽量选用侧链化学结构差异大的其他头孢菌素类药物。
用药前应知情告知,病人或家属同意并签字后做该药的皮试,皮试阴性者在应用过程中应严密监测,并做好抢救准备工作。
3 皮试液配制方法及保存:3.1 青霉素及青霉素类注射用抗生素的皮试使用青霉素皮试液。
3.2 头孢菌素及其它ß-内酰胺类注射用抗生素的皮试必须用拟用药品配制的皮试液做皮试:a皮试液浓度:300μg/ml;b皮试方法:每次皮内注射0.1ml(30μg),十五分钟后观察皮丘反应;c头孢菌素及其它ß-内酰胺类抗生素皮试液的配制方法:取药物1g,加注射用水或生理盐水4ml(如药物规格为0.75g加溶媒3ml,0.5g加2ml,0.25g加1ml)溶之,配成浓度为25%(g/ml)的溶液,摇匀后取0.1ml,加注射用水或生理盐水稀释至10ml,摇匀后取1ml稀释至8ml,摇匀即得。
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)
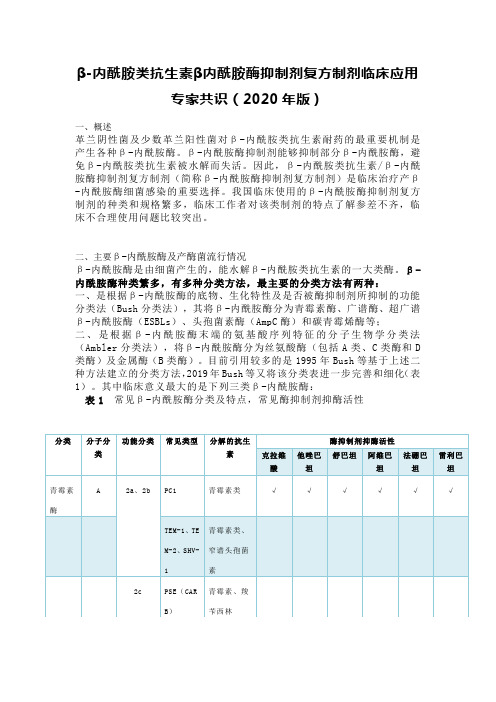
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)一、概述革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。
我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。
二、主要β-内酰胺酶及产酶菌流行情况β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种:一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等;二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。
目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。
其中临床意义最大的是下列三类β-内酰胺酶:表1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M 型、OXA型和其他型共5大类型。
2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。
部分由质粒介导,常呈持续高水平表达。
β-内酰胺酶抑制剂复合制剂

加强药物相互作用研究
提高患者用药依从性
对于与其他药物可能发生相互 作用的情况,医生应加强药物 相互作用的研究,了解具体作 用机制,避免不良反应的发生 。
向患者充分说明用药的重要性 和注意事项,提高患者的用药 依从性,减少不良反应的发生 。
THANKS
感谢观看
加强β-内酰胺酶抑制剂复合制剂耐药性的研 究,为耐药性问题的解决提供科学依据。
06
β-内酰胺酶抑制剂复合制剂的挑战和
解决方案
挑战分析
耐药性
随着时间的推移,细菌对β-内酰胺酶抑制剂复合制剂的耐药性逐 渐增强,导致药物治疗效果下降。
药物相互作用
与其他药物同时使用时,β-内酰胺酶抑制剂复合制剂可能会与其他 药物发生相互作用,影响疗效。
β-内酰胺酶抑制剂复合制 剂
• 引言 • β-内酰胺酶抑制剂复合制剂的种类和
特性 • β-内酰胺酶抑制剂复合制剂的药理作
用和机制 • β-内酰胺酶抑制剂复合制剂的临床应
用和效果
• β-内酰胺酶抑制剂复合制剂的研发进 展和未来展望
• β-内酰胺酶抑制剂复合制剂的挑战和 解决方案
01
引言
背景介绍
新药研发
优化给药方案
随着对β-内酰胺酶抑制剂复合制剂作用机制 的深入了解,未来将会有更多新型的β-内酰 胺酶抑制剂复合制剂进入研发阶段。
针对不同病原体和宿主,优化β-内酰胺酶抑 制剂复合制剂的给药方案,以提高疗效和降 低副作用。
扩大适应症范围
耐药性研究
随着临床应用的不断深入,β-内酰胺酶抑制 剂复合制剂的适应症范围有望进一步扩大。
扩大抗菌谱
通过抑制β-内酰胺酶,β-内酰胺 酶抑制剂复合制剂可以扩大β-内 酰胺类抗生素的抗菌谱,使其对 一些原本耐药的细菌有效。
β-内酰胺酶抑制剂复合制剂

革兰阳性菌
• 氨苄西林/舒巴坦 • 阿莫西林/克拉维酸 • 替卡西林/克拉维酸 • 头孢哌酮/舒巴坦 • 哌拉西林/他唑巴坦 • 头孢他啶/阿维巴坦 • 头孢洛扎/他唑巴坦 • 美罗培南/法硼巴坦
常用的β-内酰胺酶抑制剂复方制剂抗菌谱
来源于2020年 β-内酰胺酶类抗生素/β-内酰胺酶抑制剂复方制剂专家共识
头孢菌素类:轻度炎性脑膜的透过性很低, 严重炎性脑膜炎时约15%穿透性。
美罗培南: 轻度炎性4.7%~25%; 严重脑膜炎的透过率39%
粒缺伴发热
由于免疫力明显下降,发热可能是感染的唯一征象。
容易发展为感染性休克,威胁生命安全。
中性粒细胞缺乏伴发热: 口腔温度>38.3℃ 或者 2 小时内连续两次体温>38.0℃ 且中性粒细胞绝对计数(absolute neutrophil count, ANC)<0.5×109/L 或预计降至 0.5×109/L 以下
大肠埃希菌(30%~50%)
肠球菌属、克雷伯菌属、变形杆 菌属细菌、铜绿假单胞菌
急性单纯性下尿路感染 口服阿莫西林/克拉维酸
急性上尿路感染建议静脉给药: 轻度:阿莫西林/克拉维酸、氨苄西林/舒巴坦
中重度:哌拉西林/他唑巴坦、头孢哌酮/舒巴坦
舒巴坦本身对鲍曼不动杆菌有很好的抗菌活性
常见临床感染部位—中枢神经系统
粒缺伴发热
根据危险分层和耐药危险 因素评估后,尽快使用抗 菌药物初始经验性治疗。
其原则是覆盖可迅速引起 严重并发症或威胁生命的 最常见和毒力较强的病原 菌。
同时必须考虑本区域、本 院及本科室感染的流行病 学覆盖耐药菌,直至获得 准确4年-2019年血流感染的耐药菌检出率
复杂性腹腔感染、院内获得性腹腔感染:多是革兰阳性菌与革兰阴性菌混合感染。 腹腔感染若存在积脓或病灶,应积极进行脓液引流或外科干预祛除感染灶。
强效β—内酰胺类抗生素制剂的应用进展

2 1 常见 B一 . 内酰胺 酶抑制剂 复方{ 剂及其 应用 目 I 2 1 1由棒酸组成的 且一 .. 内酰胺类 复方制剂 普卡西林 ( 羧 噻吩青霉素 )+ 酸,商 品名 (i e tI 又称 誊门汀 或特 美 棒 T m n  ̄1 ) 汀. 克服 了普卡西林易被 且 内酰胺酶破坏的蛱点, 一 主要用于 全身性感染或厌 氧菌、需氧 菌混合{染 。羟氨苄青霉素+ 舂 棒
诺酮 ( 环丙 沙星 )结合物 R 2 0 9 3 体外对革兰 氏阳性苗 o 5- 9 在 和 阴性菌都有 良好抗苗活性 .而且.还有较强的抗厌氧菌作
用 ‘。
药物剂型能 更好地发挥 且一 内酰胺类抗 生素的抗菌效能. 研究 报道,在 急、慢性感染 中,氨苄西林 的脂质体 比游 离药物有 效 .氨苄西林纳米粒对 鼠沙 门苗病的抗菌效应 比游 离氨 苄西 林增加 10倍 ;又如哌拉西林脂质 体能够保护药物不被 B一 2 内酰胺酶水解 。 目前, 且一 内酰胺类抗 生素的以纳米粒和胎 质体等为载体 的靶 向制剂 的开发 . 宽了 且一 拓 内酰胺类抗生素
酸 . 商品名 A g et n 又称安美汀 、 ( uu n i ) 臭格门汀、安灭菌等 . 它对革 兰氏阳性苗及 阴性菌 的抗菌 话性 均强于羟氨 苄青霉 生素 耐药的主要原因是产生 且一内酰胺酶 ,导致 且一 内酰胺酶
类抗 生素的 且一 内酰胺环 水解破坏。寻找酶抑{ 剂是解决耐 目 I 药增强疗效的重要途径之 一。 自 1 7 96年棒酸问世以来 .广
增效制 剂的研 发途 径 。
L6 B一内酰 胺 增强剂 的研 究开 发 最近 , 有研 究发 现 M一722I 20 1 C 2 05 ,  ̄- 0 66等与 B一 内酰胺并用 可使 - 吨 的 K C I 下 降,称之 为 且一 内酰胺增强剂 ,如头孢睦林抗 - 吣 的 M C I 加入 1. / c 2 0 1 ,药物本身的 M C值 由 2 6 / 0 g L t 一 0 6 6后 i I 5吣 L 下 降为 n 1 5 g L 。 估计 ,各种 且一 2 m / “。 内酰胺与增强剂的复
β-内酰胺酶抑制剂复合剂的临床应用及配比的科学性

没有 的, 比克拉维酸稳定且不会产生诱导酶 , 比舒 巴坦的抑酶 它 它
作 用强 , 对 B类 及 大部 分 C类 抑 制 作用 弱 。 B一内酰胺 类 抗 生 但 与
B一内酰 胺 类 抗 生 素 是 目前 临 床 膻 用 广 泛 、 效 较 好 的 一类 抗 疗 生 素 , 其 细 菌 耐药 性 已成 为 一 个 严 重 问 题 。 菌 耐 药 机 制之 一 是 但 细 通 过 产 酶 来 破 坏 B一内酰 胺 环 使 之 失 去 抑 菌 活 性 , 决 巾 药 性 的 解 讨 途 径 之 一 是 将 p一内酰 胺 类 抗 牛 素 jp一内酰 胺 酶 抑 制 剂 组 合 成 复 合 剂 . 而 提 高 其 临 床 疗 效 。 就 B一内 酰胺 酶抑 制剂 搜 其 复 合 从 现 剂 的 临床 应 用 、 合 剂 配 比 的科 学性 作 慨 述 。 复
维普资讯
综 述报告
20 年第 1 卷第7 08 7 期
B一内酰胺酶抑制剂复合剂 的临床应用及配 比的科学性
许恒 忠
( 山东 省聊城 市 第二 人 民医院 , 山东 临清 2 2 0 ) 5 6 1
摘要 : 目的 介 绍 B一内酰 胺 酶  ̄ - 利 、 r, e 复合 剂的 临 床 应 用 , 合 剂 配 比方 面 的 研 究进展 法 对 近 年 来 的 有 关 文献 进 行 分析 、 纳 。 果 J 复 方 归 结 B一 内酰 胺 类 抗 生 素 与 B一内酰 胺 酶 抑 制 剂联 合 使 用是 减 少 p一内酰 胺 类 抗 生 素 产 生 耐 药性 的 有 效 方 法 : 论 p一内酰 胺 酶 抑 制 剂复 合 结
抗菌素详细讲解

2. 头孢菌素
第一代头孢菌素 第二代头孢菌素 第三代头孢菌素 第四代头孢菌素
3.其他β-内酰 胺类抗生素
亚胺培能 君刻单 β-内酰胺酶抑制剂与 β-内酰胺类抗生素复 合制剂:安灭菌、优 立新、替门汀。
β-内酰胺类抗生素:一般血药浓度较高, 抗菌谱广,杀菌力强,毒性较低,但应当 注意的是:(1)因耐药菌株增多,某些 药物如氨苄西林的应用意义有所下降; (2)此药在肺组织的浓度往往是血浓度 的几分之一,在避免毒性的前题下要适当 增加剂量,如特美汀3.2g bid 应改为3.2g q.8.h静滴,(3)对于院外感染的经验治疗, 因多数第三代头孢菌素抗肺炎链球菌的作 用不强,不应作为首选。
3.临床上科学、合理地使用抗菌素:滥用抗 生素是诱发细菌产生β-内酰胺酶并引起细菌 耐药的重要原因之一。有人观察,在某大城 市内集中应用头孢噻肟钠5年后,细菌耐药率 高达60%,而停止或明显减少该药的应用,5 年后耐药降到8%,提示抗生素要轮换应用, 应用抗菌素首先要有细菌感染的指征。最好 有病原学的证据和药敏实验结果。临床医师 应掌握各种抗菌素的抗菌谱,药代动力学、 联合应用效果及不良反应知识。尽最大努力 科学用药、合理用药。
三、氨基糖苷类: 静止期杀菌性抗菌素:以抗需氧G—杆菌 假单胞菌属,结核菌属为特点。 第一代:链霉素、新霉素、巴龙霉素、 卡那霉素、核糖霉素等。 第二代:庆大霉素、妥布霉素、西梭米 星等。 第三代:阿米卡星和阿贝卡星、异帕米 星及奈替米星等。 第三代最突出特点是耳、肾毒性很低。
耳毒性最小
立克素
1. 研制开发新型的对β-内酰胺酶稳定 的β-内酰胺类抗生素: 90年代进入我国的碳青霉烯类(泰能) 对染色体Ⅰ型酶和ESBL酶都显示了良 好的稳定性,在临床的各类感染性疾病 中确实发挥了显著的杀菌效能。
我院β内酰胺类抗生素药物的基本应用

β内酰胺类抗生素药物的基本应用【摘要】目的:了解我院注射用β内酰胺类抗生素药物的使用情况,为指导临床合理用药提供参考。
方法:采用回顾性调查方法,收集我院2011-2012年度β-内酰胺类抗生素用药总量,用药金额等数据。
并对用药频度进行计算分析。
结果:头孢呋辛、头孢哌酮钠舒巴坦钠、青霉素钠等用药频率ddds排序居前,仍为抗感染药物首选。
ddds排序居前的品种每日费用较低。
结论:我院注射用β-内酰胺类抗生素应用基本合理。
【关键词】β-内酰胺;抗生素;用药频率;日均费用【中图分类号】r917 【文献标识码】a 【文章编号】1004-7484(2012)13-0469-01青霉素和头孢菌素等β-内酰胺类抗生素的发现与使用为人类抵抗细菌感染做出了巨大的贡献,挽救了无数人的生命。
近年来,高效、广谱、安全的抗生素新品种不断出现,为临床用药提供了更大的应用空间。
但抗生素的滥用及其耐药性、药源性疾病等问题给药物管理和合理用药带来了新的挑战,给患者增加了用药负担以及增加了用药风险。
现对对本院住院药房2011-2012年注射用β-内酰胺类抗生素用药品种、用药剂量等进行统计分析。
1 资料与方法1.1 一般资料资料全部来源于我院2011~2012年药房β-内酰胺类抗生素消耗数量、金额。
1.2 方法[1-4] 采用who推荐的限定日剂量(ddd)值分析法。
ddd值的确定:大多数品种以《新编药物学》以及《2005中华人民共和国药典》规定的日剂量为准;未被收载的品种,以药品说明书及相关文献报道为准。
对同一品种、不同厂家药品,计算其总剂量(g),最后求和得到该品种消耗的总剂量(g)。
用药频率(ddds)=某药品年消耗总剂量(g)/该药的ddd值。
ddds可用来衡量药物的用药频率,值越大,说明该药的用药频率越大。
日均费用(ddc)=药品零售金额/该药ddds。
序号比值:以金额序号除以ddds序号,即得序号比值。
序号比是反映购药金额与用药人数是否同步的指标,此比值接近1表明同步较好,反之较差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•杂志首页•|•投稿•|•读者须知•|•关注371•标准与规范•β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识•β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识编写委员会中华医学杂志, 2015,95(48): 3887-3894. DOI: 10.3760/cma.j.issn.0376-2491.2015.48.003引用本文:β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识编写委员会. β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识[J]. 中华医学杂志,2015,95( 48 ): 3887-3894. DOI: 10.3760/cma.j.issn.0376-2491.2015.48.003正文作者信息基金0关键词0主题词0English Abstract评论阅读371引用 0相关资源视频0论文 0大综述 0以下内容和版式版权归属中华医学会,未经授权不得转载×一、概述革兰阴性菌是我国细菌感染性疾病最常见的病原体。
近年来,革兰阴性菌对β-内酰胺类抗生素的耐药性不断增加,最重要的耐药机制是细菌产生各种β-内酰胺酶。
β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。
因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。
目前我国临床使用的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的种类和规格繁多,临床医师对该类合剂的特点了解不够,临床不合理使用问题较突出。
为规范β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的临床应用,延缓其耐药性的发生和发展,特制定本共识。
二、主要β-内酰胺酶及β-内酰胺酶抑制剂β-内酰胺酶是由细菌产生的能水解β-内酰胺类抗生素的一大类酶。
β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶等;根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶和金属酶。
目前引用较多的是基于上述2种方法建立的分类方法。
见表1。
超广谱β-内酰胺酶(ESBLs)是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。
这类酶可被β-内酰胺酶抑制剂如克拉维酸、舒巴坦及他唑巴坦等抑制。
ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。
到目前为止,全世界共发现了200余种ESBLs。
根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M 型、OXA型和其他型共5大类型[1]。
头孢菌素酶(AmpC酶)通常是由染色体介导,对第一、二、三代头孢菌素水解能力强,但其对碳青霉烯类抗生素和第四代头孢菌素的水解能力弱,克拉维酸不能抑制其活性,他唑巴坦和舒巴坦有部分抑酶作用,氯唑西林抑制头孢菌素酶作用强。
该酶主要存在于肠杆菌属、柠檬酸杆菌属、普鲁菲登菌属、粘质沙雷菌属和摩根菌属等细菌。
染色体介导的头孢菌素酶可以被β-内酰胺类抗生素诱导和选择。
近年来,质粒介导的头孢菌素酶陆续被报道,主要出现于肺炎克雷伯菌、大肠埃希菌及沙门菌属细菌中,常呈持续高水平表达,可通过质粒广泛传播。
根据其与染色体介导的头孢菌素酶的同源性,可分为CMY-2组、CMY-1组、MIR-1/ACT-1组、DHA-1组和ACC-1组等[2]。
碳青霉烯酶是指能水解碳青霉烯类抗生素的一大类β-内酰胺酶,分别属于Ambler分子分类中的A类、B类和D类酶。
A类、D类为丝氨酸酶,B类为金属酶,以锌离子为活性中心[3,4]。
A类碳青霉烯酶可以由染色体介导,也可由质粒介导,前者包括SME、NMC和IMI酶等,后者包括KPC和GES酶等。
KPC酶是近年来肠杆菌科细菌尤其是肺炎克雷伯菌对包括碳青霉烯类抗生素在内的几乎所有β-内酰胺类抗生素耐药的最主要机制,我国最常见的是KPC-2,其对头孢吡肟和头孢他啶的水解能力较弱[5,6]。
A类碳青霉烯酶可部分被克拉维酸所抑制,但不被乙二胺四乙酸(EDTA)所抑制[2]。
D类碳青霉烯酶(OXA酶)对苯唑西林水解活性强,主要见于不动杆菌属细菌。
包括OXA-23、OXA-24/OXA-40、OXA-48、OXA-58和OXA-51酶等。
目前临床应用的酶抑制剂对其没有很好的抑制作用,且不同OXA酶对碳青霉烯类抗生素水解活性不相同,β-内酰胺酶抑制剂的抑酶活性也不同[7]。
B类碳青霉烯酶(金属酶)能灭活青霉素类、头孢菌素类、碳青霉烯类抗生素,但对氨曲南水解活性弱,不能被β-内酰胺酶抑制剂所抑制,可被EDTA或巯基类化合物抑制。
常见于铜绿假单胞菌、不动杆菌属细菌和肠杆菌科细菌,包括IMP、VIM、GIM、SPM、SIM、NDM酶等[4,8]。
β-内酰胺酶抑制剂能抑制细菌产生的大部分β-内酰胺酶,常与β-内酰胺类抗生素联合使用,能使抗生素中的β-内酰胺环免遭水解,保护β-内酰胺抗生素的抗菌作用。
临床上常用的β-内酰胺酶抑制剂主要有:克拉维酸、舒巴坦、他唑巴坦,三者均含有β-内酰胺环结构,为不可逆竞争性抑制剂[9]。
β-内酰胺酶抑制剂的出现很大程度上解决了β-内酰胺类抗生素的耐药问题(表1)。
CHINET耐药监测网和国家卫计委细菌耐药监测网的数据显示,近8年来我国ESBLs在大肠埃希菌的发生率在50%~60%,大肠埃希菌所产ESBLs基因型90%以上为CTX-M型,各地区产ESBLs大肠埃希菌CTX-M型分布有一定差异。
产ESBLs大肠埃希菌对碳青霉烯类抗生素、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率均低于15%。
肺炎克雷伯菌产生的ESBLs基因型情况与大肠埃希菌相似,以CTX-M型为主。
据国家卫计委细菌耐药监测网分析,2013年我国各地区肺炎克雷伯菌的ESBLs检出率介于15.9%~46.7%,而CHINET监测16家三甲医院2013年肺炎克雷伯菌ESBLs检出率为31.8%。
产ESBLs肺炎克雷伯菌对亚胺培南、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率分别为 6.0%、17.8%和23.5%[10,11,12]。
据2013年CHINET耐药监测网数据显示,肺炎克雷伯菌对碳青霉烯类抗生素耐药超过10.0%。
我国肠杆菌科中流行的碳青霉烯酶为KPC-2,在大肠埃希菌、肺炎克雷伯菌,粘质沙雷菌、奇异变形杆菌等肠杆菌科细菌中均有发现,流行地区包括浙江、上海、江苏、湖南、北京、山东等多个省市。
由于产KPC-2的菌株常常同时产ESBLs和(或)AmpC酶,甚至同时合并有外膜蛋白缺失,常表现为广泛耐药或全耐药。
CHINET近5年数据显示,我国碳青霉烯类抗生素耐药鲍曼不动杆菌检出率从2008年的49.3%上升至2013年的62.8%,产碳青霉烯酶OXA-23是介导鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制[10,13]。
根据不同β-内酰胺酶水解底物范围、活性及对酶抑制剂抑酶活性的差异,建立了多种β-内酰胺酶表型检测方法,其对临床合理选用抗菌药物有重要的参考价值,但其检测结果易受多种因素的影响,必要时可采用分子生物学技术进一步确认酶的类型。
1.ESBLs的检测:目前实验室通常采用CLSI推荐的ESBLs初筛和表型确证试验,也可采用三维试验、Etest条、双纸片协同试验、自动化仪器等[14]。
ESBLs 种类繁多,耐药表型不一,国内大肠埃希菌和克雷伯菌中主要流行CTX-M型,通常对头孢噻肟和头孢曲松耐药,部分菌株可对头孢他啶体外敏感,对碳青霉烯类抗生素、含酶抑制剂复合制剂头孢哌酮/舒巴坦和哌拉西林/他唑巴坦敏感率高[10]。
2.AmpC酶的检测:实验室没有常规开展AmpC酶的检测,其检测方法主要有头孢西丁三维试验、AmpC酶纸片法、头孢西丁琼脂法等,也可以硼酸(30 μg/ml)为抑制剂,采用类似于美国临床和实验室标准化委员会(CLSI)推荐的ESBLs检测方法和判断标准。
产AmpC酶菌株的典型耐药表型为头孢吡肟敏感、头孢西丁耐药,部分菌株可同时产ESBLs,造成第四代头孢菌素头孢吡肟耐药,仅对碳青霉烯类抗生素敏感。
克拉维酸与三代头孢菌素或氨曲南对产头孢菌素酶细菌无协同作用[15]。
3.碳青霉烯酶的检测:碳青霉烯酶的表型检测方法主要有两种:改良Hodge试验和EDTA协同试验。
改良Hodge试验不能区分碳青霉烯酶类型,主要用于检测肠杆菌科细菌中的碳青霉烯酶,对KPC酶灵敏度和特异性较高,对金属酶会出现假阴性,菌株如高产ESBLs或AmpC酶合并外膜孔蛋白丢失,改良Hodge试验也会出现假阳性[14]。
EDTA协同试验用于检测金属酶,以EDTA作为抑制剂,美罗培南或亚胺培南作为指示药物,采用类似于CLSI 推荐的ESBLs检测方法和判断标准[16]。
产碳青霉烯酶菌株往往对碳青霉烯类抗生素耐药,对目前临床使用的含酶抑制剂复合制剂、广谱头孢菌素也常表现为耐药。
五、β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的组成原则β-内酰胺类抗生素与β-内酰胺酶抑制剂组成合剂必须考虑组方和配比的合理性。
基本组成原则如下:(1)β-内酰胺类抗生素与β-内酰胺酶抑制剂的药代动力学特征基本吻合,如消除半衰期相近和分布相似,两者在体内的有效浓度能共同维持足够的作用时间,以发挥更好的协同杀菌效果。
(2)β-内酰胺类抗生素与酶抑制剂组方后毒理学试验表明合剂与单药相比毒性未显著增加,并且临床研究结果显示联合后不良反应无明显增加。
(3)母体和酶抑制剂均需适当剂量。
在已上市的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂基础上增加新配比的品种,必须有充足理由说明现有配比不能完全满足临床需要,临床前和临床研究结果证明新配比合剂与已上市配比合剂相比,在有效性或安全性上具有临床价值的明显优势和(或)新配比合剂有特殊适应证范围等。
目前国内外临床上应用的主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂包括:(1)阿莫西林/克拉维酸(针剂5∶1,口服4∶1或2∶1);(2)替卡西林/克拉维酸(15∶1);(3)氨苄西林/舒巴坦(2∶1);(4)头孢哌酮/舒巴坦(2∶1或1∶1);(5)哌拉西林/他唑巴坦(8∶1)。
数据来源于各产品说明书及相关文献报道,此5种复合制剂的配方符合抑制剂合剂组成的原则、有详细的药物代谢动力学数据(表2)、详实的体外药敏监测数据及丰富的临床使用数据,成为临床抗感染治疗的重要选择。
主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂共同的特点:(1)除舒巴坦对不动杆菌属有很强抗菌活性外,其他β-内酰胺酶抑制剂仅具有微弱的抗菌作用;(2)β-内酰胺酶抑制剂对多数质粒介导的β-内酰胺酶有较强抑制作用,与阿莫西林、氨苄西林、哌拉西林、替卡西林、头孢哌酮等联合后可保护上述抗生素不被细菌产生的灭活酶水解;(3)β-内酰胺酶抑制剂不增强与其配伍药物对敏感细菌或非产β-内酰胺酶的耐药细菌的抗菌活性;(4)β-内酰胺酶抑制剂合剂的抗菌作用主要取决于其β-内酰胺类抗生素的抗菌谱和抗菌活性;(5)β-内酰胺类抗生素和β-内酰胺酶抑制剂合剂中两药的药代动力学性质相近,具协同抗菌作用;(6)两药联合应用后不良反应无明显增加。
