B型超声诊断设备技术指导原则
B型超声诊断仪的操作使用

一般安全信息(二)
7.超声可能对人体造成危害,应避免长时间照射。 8.显示屏易碎请勿撞击,如发现破裂,应对其进行妥善处理。 9.为降低使用风险,请使用随机配置的电源线。 10.深圳市三维医疗设备有限公司不对仪器因用户自行折卸、改装所引发的任何风险负 责。 11.仪器供电电源插座应为标准三芯电源插座,其保护接地点(端子)应与供电系统保 护接地导线相连。 12. 超声可能对人体造成危害,应避免长时间照射。
注意:按下相应调节焦点位置设置键,通过移动轨迹球或按方向键移动焦点的位置(此动作可多次进行),按下确定 键结束。
数字键、角度测量键、符号键 当功能键、上档键指示灯灭的状态下,按下该键可输入数字。 当上档键指示灯亮的状态下,按下该键可输入符号。
当功能键指示灯亮的状态下,按下该键可快捷的进入角度测量(具体测量方法参考角度测量)。 Company Logo Page 7
数字复用键
数字键&扫描角度改变键&符号键 u 当功能键、上档键指示灯灭的状态下,按下该键可输入数 字。 u 当上档键指示灯亮的状态下,按下该键可输入符号。 u 当功能键指示灯亮的状态下,按下该键可实现图像角度的 改变。连续按下该键,可实现对图像五档不同角度的改变。
数字键&符号键 u 当上档键指示灯灭的状态下,按下该键可输入数 字。 u 当上档键指示灯亮的状态下,按下该键可输入符 号。
Page 8
Company Logo
字母复用键
字母键&体标健&符号键 u 当功能指示灯灭的状态下,按下该键可输入英文字母或汉 字。 u 当上档键指示灯亮的状态下,按下该键可输入符号。
字母键/产科指示键 u 当功能键指示灯灭的状态下,按下该键,输入英文字母或 汉字。 u 当功能键指示灯亮的状态下,按下该键,可快速进入产科 七项指标测量。
医疗器械 指导原则清单
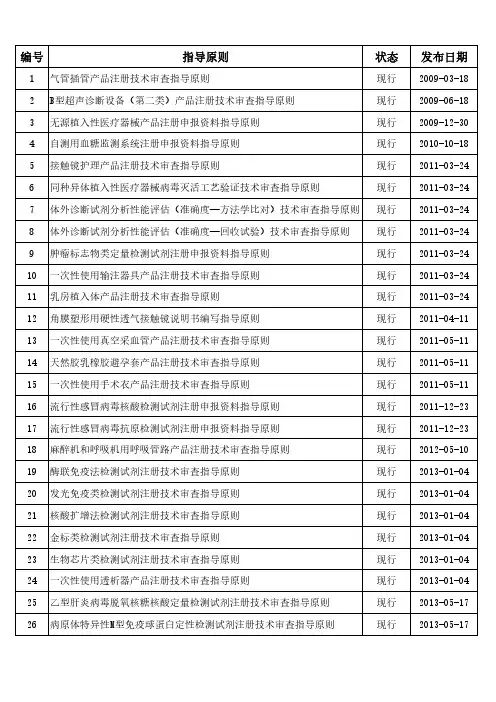
编号指导原则状态发布日期1气管插管产品注册技术审查指导原则现行2009-03-18 2B型超声诊断设备(第二类)产品注册技术审查指导原则现行2009-06-18 3无源植入性医疗器械产品注册申报资料指导原则现行2009-12-30 4自测用血糖监测系统注册申报资料指导原则现行2010-10-18 5接触镜护理产品注册技术审查指导原则现行2011-03-24 6同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则现行2011-03-24 7体外诊断试剂分析性能评估(准确度—方法学比对)技术审查指导原则现行2011-03-24 8体外诊断试剂分析性能评估(准确度—回收试验)技术审查指导原则现行2011-03-24 9肿瘤标志物类定量检测试剂注册申报资料指导原则现行2011-03-24 10一次性使用输注器具产品注册技术审查指导原则现行2011-03-24 11乳房植入体产品注册技术审查指导原则现行2011-03-24 12角膜塑形用硬性透气接触镜说明书编写指导原则现行2011-04-11 13一次性使用真空采血管产品注册技术审查指导原则现行2011-05-11 14天然胶乳橡胶避孕套产品注册技术审查指导原则现行2011-05-11 15一次性使用手术衣产品注册技术审查指导原则现行2011-05-11 16流行性感冒病毒核酸检测试剂注册申报资料指导原则现行2011-12-23 17流行性感冒病毒抗原检测试剂注册申报资料指导原则现行2011-12-23 18麻醉机和呼吸机用呼吸管路产品注册技术审查指导原则现行2012-05-10 19酶联免疫法检测试剂注册技术审查指导原则现行2013-01-04 20发光免疫类检测试剂注册技术审查指导原则现行2013-01-04 21核酸扩增法检测试剂注册技术审查指导原则现行2013-01-04 22金标类检测试剂注册技术审查指导原则现行2013-01-04 23生物芯片类检测试剂注册技术审查指导原则现行2013-01-04 24一次性使用透析器产品注册技术审查指导原则现行2013-01-04 25乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则现行2013-05-17 26病原体特异性M型免疫球蛋白定性检测试剂注册技术审查指导原则现行2013-05-1727人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则现行2013-05-17 28流式细胞仪配套用检测试剂注册技术审查指导原则现行2013-05-17 29疝修补补片产品注册技术审查指导原则现行2013-10-12 30负压引流装置产品注册技术审查指导原则现行2013-10-23 31一次性使用无菌手术包类产品注册技术审查指导原则现行2013-10-23 32一次性使用配药用注射器产品注册审查指导原则现行2013-10-23 33义齿制作用合金产品注册技术审查指导原则现行2013-10-23 34鼻氧管产品注册技术审查指导原则现行2013-10-23 35医用磁共振成像系统注册技术审查指导原则现行2014-03-13 36弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及G型免疫球蛋白抗现行2014-03-13 37肿瘤个体化治疗相关基因突变检测试剂技术审查指导原则现行2014-03-13 38药物滥用检测试剂技术审查指导原则现行2014-03-13 39软性亲水接触镜说明书编写指导原则现行2014-04-17 40硬性角膜接触镜说明书编写指导原则现行2014-04-17 41心脏射频消融导管产品注册技术审查指导原则现行2014-05-14 42牙科树脂类充填材料产品注册技术审查指导原则现行2014-05-14 43一次性使用避光输液器产品注册技术审查指导原则现行2014-05-14 44一次性使用血液分离器具产品注册技术审查指导原则现行2014-05-14 45血液透析浓缩物产品注册技术审查指导原则现行2014-05-14 46金属接骨板内固定系统产品注册技术审查指导原则现行2014-05-14 47医用口罩产品注册技术审查指导原则现行2014-05-20 48一次性使用引流管产品注册技术审查指导原则现行2014-05-20 49一次性使用皮肤缝合器产品注册技术审查指导原则现行2014-05-20 50医疗器械产品技术要求编写指导原则现行2014-05-30 51植入式心脏电极导线产品注册技术审查指导原则现行2014-06-04 52体外诊断试剂临床试验技术指导原则现行2014-09-11 53体外诊断试剂说明书编写指导原则现行2014-09-1154雌激素受体、孕激素受体抗体试剂及检测试剂盒技术审查指导原则现行2015-04-17 55医疗器械临床评价技术指导原则现行2015-05-19 56乙型肝炎病毒基因分型检测试剂技术审查指导原则现行2015-07-15 57影像型超声诊断设备新技术注册技术审查指导原则现行2015-07-15 58医疗器械软件注册技术审查指导原则现行2015-08-05 59结核分枝杆菌复合群核酸检测试剂注册技术审查指导原则现行2015-09-21 60丙型肝炎病毒核糖核酸测定试剂技术审查指导原则现行2015-11-26 61过敏原特异性IgE抗体检测试剂技术审查指导原则现行2015-11-26 62人乳头瘤病毒(HPV)核酸检测及基因分型试剂技术审查指导原则现行2015-11-26 63全自动化学发光免疫分析仪技术审查指导原则现行2015-11-26 64质子/碳离子治疗系统技术审查指导原则现行2015-12-31 65离心式血液成分分离设备技术审查指导原则现行2015-12-31 66影像型超声诊断设备(第三类)技术审查指导原则(2015年修订版)现行2015-12-31 67一次性使用膜式氧合器注册技术审查指导原则现行2016-01-14 68α-氰基丙烯酸酯类医用粘合剂注册技术审查指导原则现行2016-01-14 69可吸收止血产品注册技术审查指导原则现行2016-01-18 70腹腔、盆腔外科手术用可吸收防粘连产品注册技术审查指导原则现行2016-01-18 71透明质酸钠类面部注射填充材料注册技术审查指导原则现行2016-01-18 72高频手术设备注册技术审查指导原则现行2016-02-06 73医用X射线诊断设备(第三类)技术审查指导原则(2016年修订版)现行2016-02-06 74植入式心脏起搏器技术审查指导原则(2016年修订版)现行2016-02-06 75脉搏血氧仪设备临床评价技术指导原则现行2016-02-06 76治疗呼吸机注册技术审查指导原则现行2016-02-06 77强脉冲光治疗仪注册技术审查指导原则现行2016-02-06 78磁疗产品注册技术审查指导原则(2016年修订版)现行2016-02-06 79电子血压计(示波法)注册技术审查指导原则(2016年修订版)现行2016-02-06 80X射线诊断设备(第二类)注册技术审查指导原则(2016年修订版)现行2016-02-0681尿液分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 82凝血分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 83半自动化学发光免疫分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 84生化分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 85血糖仪注册技术审查指导原则(2016年修订版)现行2016-02-06 86血液透析用制水设备注册技术审查指导原则(2016年修订版)现行2016-02-06 87牙科综合治疗机注册技术审查指导原则(2016年修订版)现行2016-02-06 88医用雾化器注册技术审查指导原则(2016年修订版)现行2016-02-06 89助听器注册技术审查指导原则(2016年修订版)现行2016-02-06 90自动尿液有形成分分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 91医学图像存储传输软件(PACS)注册技术审查指导原则现行2016-02-26 92正压通气治疗机注册技术审查指导原则现行2016-02-26 93大型蒸汽灭菌器注册技术审查指导原则现行2016-02-26 94腹膜透析机注册技术审查指导原则现行2016-02-26 95医用内窥镜冷光源注册技术审查指导原则现行2016-02-26 96振动叩击排痰机注册技术审查指导原则现行2016-02-26 97碱性磷酸酶测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 98人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)注册技术审查指导原现行2016-02-26 99C反应蛋白测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 100大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册技术审查指导原现行2016-02-26 101缺血修饰白蛋白测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 102肌酸激酶测定试剂(盒)注册技术审查指导原则(2016年修订版)现行2016-02-26 103白蛋白测定试剂(盒)注册技术审查指导原则现行2016-02-26 104糖化血红蛋白测定试剂盒(酶法)注册技术审查指导原则现行2016-02-26 105乳酸脱氢酶测定试剂盒注册技术审查指导原则现行2016-02-26 106促甲状腺素检测试剂注册技术审查指导原则现行2016-02-26 107甘油三酯测定试剂盒注册技术审查指导原则现行2016-02-26108唾液酸检测试剂盒(酶法)注册技术审查指导原则现行2016-02-26 109β2-微球蛋白检测试剂盒(胶乳增强免疫比浊法)注册技术审查指导原则现行2016-02-26 110牙科种植体(系统)注册技术审查指导原则(2016年修订版)现行2016-04-14 111牙科基托聚合物材料注册技术审查指导原则现行2016-04-14 112一次性使用脑积水分流器注册技术审查指导原则现行2016-04-14 113可吸收性外科缝线注册技术审查指导原则现行2016-04-14 114脊柱后路内固定系统注册技术审查指导原则现行2016-04-14 115椎间融合器注册技术审查指导原则现行2016-04-14 116人红细胞反定型试剂注册技术审查指导原则现行2016-09-26 117一次性使用血液透析管路注册技术审查指导原则现行2016-11-02 118眼科超声乳化和眼前节玻璃体切除设备及附件注册技术审查指导原则现行2016-12-06 119人工耳蜗植入系统临床试验指导原则现行2017-01-04 120光固化机注册技术审查指导原则现行2017-01-10 121体外除颤产品注册技术审查指导原则现行2017-01-10 122口腔颌面锥形束计算机体层摄影设备注册技术审查指导原则现行2017-01-10 123医用磁共振成像系统临床评价技术审查指导原则现行2017-01-10 124医疗器械网络安全注册技术审查指导原则现行2017-01-20 125钙磷/硅类骨填充材料注册技术审查指导原则现行2017-01-22 126中心静脉导管产品注册技术审查指导原则现行2017-01-22 127袜型医用压力带注册技术审查指导原则现行2017-01-22 128髋关节假体系统注册技术审查指导原则现行2017-02-10 129人工颈椎间盘假体注册技术审查指导原则现行2017-02-10 130结核分枝杆菌复合群耐药基因突变检测试剂注册技术审查指导原则现行2017-02-13 131电动病床注册技术审查指导原则(2017年修订版)现行2017-02-17 132腹腔镜手术器械技术审查指导原则现行2017-02-17 133手术无影灯注册技术审查指导原则现行2017-02-17 134人工耳蜗植入系统注册技术审查指导原则现行2017-02-28135可见光谱治疗仪注册技术审查指导原则现行2017-03-10 136纤维内窥镜(第二类)注册技术指导原则(2017年修订版)现行2017-03-10 137硬管内窥镜(第二类)注册技术审查指导原则(2017年修订版)现行2017-03-10 138注射泵注册技术审查指导原则(2017年修订版)现行2017-03-10 139手术电极注册技术审查指导原则(2017年修订版)现行2017-03-10 140医用电子体温计注册技术审查指导原则(2017年修订版)现行2017-03-10 141半导体激光治疗机(第二类)注册技术审查指导原则(2017年修订版)现行2017-03-10 142腔镜用吻合器产品注册技术审查指导原则现行2017-03-13 143牙科纤维桩产品注册技术审查指导原则现行2017-03-13 144聚氨酯泡沫敷料产品注册技术审查指导原则现行2017-03-13 145胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)注现行2017-03-30 146超声多普勒胎儿心率仪注册技术审查指导原则现行2017-04-24 147电动牵引装置注册技术审查指导原则(2017年修订版)现行2017-04-24 148电动手术台注册技术审查指导原则(2017年修订版)现行2017-04-24 149影像型超声诊断设备(第二类)注册技术审查指导原则现行2017-04-24 150无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)现行2017-05-12 151牙科种植机注册技术审查指导原则现行2017-08-02 152红外乳腺检查仪注册技术审查指导原则(2017年修订版)现行2017-09-05 153医用臭氧妇科治疗仪注册技术审查指导原则(2017年修订版)现行2017-09-05 154骨组织手术设备注册技术审查指导原则(2017年修订版)现行2017-09-05 155酶标仪注册技术审查指导原则现行2017-09-25 156一次性使用心电电极注册技术审查指导原则现行2017-09-25 157动态血压测量仪注册技术审查指导原则现行2017-09-25 158心电图机注册技术审查指导原则(2017年修订版)现行2017-09-25 159病人监护产品(第二类)注册技术审查指导原则(2017年修订版)现行2017-09-25 160红外线治疗设备注册技术审查指导原则(2017年修订版)现行2017-11-02 161医用控温毯注册技术审查指导原则(2017年修订版)现行2017-11-02162中频电疗产品注册技术审查指导原则(2017年修订版)现行2017-11-02 163脉搏血氧仪注册技术审查指导原则(2017年修订版)现行2017-11-02 164牙科手机注册技术审查指导原则(2017年修订版)现行2017-11-02 165超声多普勒胎儿监护仪注册技术审查指导原则(2017年修订版)现行2017-11-02 166超声理疗设备注册技术审查指导原则(2017年修订版)现行2017-11-02 167超声洁牙设备注册技术审查指导原则(2017年修订版)现行2017-11-02 168视野计注册技术审查指导原则(2017年修订版)现行2017-11-02 169防褥疮气床垫注册技术审查指导原则(2017年修订版)现行2017-11-02 170超声骨密度仪注册技术审查指导原则现行2017-11-06 171电动轮椅车注册技术审查指导原则现行2017-11-06 172耳腔式医用红外体温计注册技术审查指导原则现行2017-11-06 173医用吸引设备注册技术审查指导原则(2017年修订版)现行2017-11-06 174小型分子筛制氧机注册技术审查指导原则(2017年修订版)现行2017-11-06 175医疗器械注册单元划分指导原则现行2017-11-17 176小型蒸汽灭菌器注册技术审查指导原则现行2017-12-06 177动态心电图系统注册技术审查指导原则现行2017-12-06 178血管内球囊扩张导管用球囊充压装置注册技术审查指导原则现行2017-12-06 179验光仪注册技术审查指导原则现行2017-12-06 180中央监护软件注册技术审查指导原则现行2017-12-06 181紫外治疗设备注册技术审查指导原则现行2017-12-06 182生物显微镜注册技术审查指导原则 现行2017-12-06 183裂隙灯显微镜注册技术审查指导原则现行2017-12-06 184输液泵注册技术审查指导原则 现行2017-12-06 185电动洗胃机注册技术审查指导原则(2017年修订版)现行2017-12-06 186全自动血型分析仪注册技术审查指导原则现行2017-12-14 187ABO、RhD血型抗原检测卡(柱凝集法)注册技术审查指导原则现行2017-12-14 188人表皮生长因子受体2基因扩增检测试剂盒(荧光原位杂交法)注册技术现行2017-12-14189丙型肝炎病毒核酸基因分型检测试剂盒注册技术审查指导原则现行2017-12-14 190治疗呼吸机临床评价技术审查指导原则现行2017-12-18 191子宫内膜去除(热传导、射频消融)设备临床评价技术审查指导原则现行2017-12-18 192促黄体生成素检测试剂(胶体金免疫层析法)注册技术审查指导原则现行2017-12-18 193心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶MB检测试剂(胶体金免疫层析现行2017-12-18 194电解质钾、钠、氯、钙测定试剂注册技术审查指导原则现行2017-12-18 195高密度脂蛋白胆固醇测定试剂注册技术审查指导原则现行2017-12-18 196胱抑素C测定试剂(胶乳透射免疫比浊法)注册技术审查指导原则现行2017-12-18 197移动医疗器械注册技术审查指导原则现行2017-12-22 198动物源性医疗器械注册技术审查指导原则(2017年修订版)现行2017-12-25 199全血及血液成分贮存袋注册技术审查指导原则现行2018-01-03 200一次性使用输注泵(非电驱动)注册技术审查指导原则现行2018-01-03 201血液浓缩器注册技术审查指导原则现行2018-01-03 202医疗器械临床试验设计指导原则现行2018-01-04 203质子碳离子治疗系统临床评价技术审查指导原则现行2018-01-04 204丙氨酸氨基转移酶测定试剂注册技术审查指导原则现行2018-01-08 205尿液分析试纸条注册技术审查指导原则现行2018-01-08 206同型半胱氨酸测定试剂注册技术审查指导原则现行2018-01-08 207胰岛素测定试剂注册技术审查指导原则现行2018-01-08 208C-肽测定试剂注册技术审查指导原则现行2018-01-08 209载脂蛋白A1测定试剂注册技术审查指导原则现行2018-01-08 210载脂蛋白B测定试剂注册技术审查指导原则现行2018-01-08 211D-二聚体测定试剂(免疫比浊法)注册技术审查指导原则现行2018-01-08 212接受医疗器械境外临床试验数据技术指导原则现行2018-01-10 213X射线计算机体层摄影设备注册技术审查指导原则现行2018-02-01 214人表皮生长因子受体(EGFR)突变基因检测试剂(PCR法)注册技术审查现行2018-02-11 215幽门螺杆菌抗原/抗体检测试剂注册技术审查指导原则现行2018-02-11216抗人球蛋白检测试剂注册技术审查指导原则现行2018-02-11 217肠道病毒核酸检测试剂注册技术审查指导原则现行2018-02-11 218超声软组织切割止血系统注册技术审查指导原则现行2018-02-11 219眼科光学相干断层扫描仪注册技术审查指导原则现行2018-02-26 220眼科飞秒激光治疗机注册技术审查指导原则现行2018-03-16 221眼科超声诊断设备注册技术审查指导原则现行2018-03-16 222持续葡萄糖监测系统注册技术审查指导原则现行2018-03-16 223结核分枝杆菌特异性细胞免疫反应检测试剂注册技术审查指导原则现行2018-03-16 224硬性光学内窥镜(有创类)注册技术审查指导原则现行2018-03-16 225口腔曲面体层X射线机注册技术审查指导原则现行2018-04-11 226气腹机注册技术审查指导原则现行2018-04-17 227医用低温保存箱注册技术审查指导原则现行2018-04-17 228电子尿量计注册技术审查指导原则现行2018-04-17 229电子阴道显微镜注册技术审查指导原则现行2018-04-17 230软性接触镜注册技术审查指导原则现行2018-04-25 231人类体外辅助生殖技术用液注册技术审查指导原则现行2018-04-25 232冠状动脉药物洗脱支架临床前研究指导原则现行2018-05-04 233冠状动脉药物洗脱支架临床试验指导原则现行2018-05-04 234手术显微镜注册技术审查指导原则现行2018-05-10 235医用洁净工作台注册技术审查指导原则现行2018-05-10 236眼压计注册技术审查指导原则现行2018-05-10 237脉搏波速度和踝臂指数检测产品注册技术审查指导原则现行2018-05-10 238麻醉咽喉镜注册技术审查指导原则现行2018-05-25 239内镜清洗消毒机注册技术审查指导原则现行2018-05-25 240睡眠呼吸监测产品注册技术审查指导原则现行2018-05-25 241无源植入性医疗器械临床试验审批申报资料编写指导原则现行2018-06-04 242角膜塑形用硬性透气接触镜临床试验指导原则现行2018-06-29243软性接触镜临床试验指导原则现行2018-06-29 244鼻饲营养导管注册技术审查指导原则(2018年修订)现行2018-08-28 245一次性使用无菌导尿管注册技术审查指导原则(2018年修订)现行2018-08-28 246定制式义齿注册技术审查指导原则(2018年修订)现行2018-08-28 247用于罕见病防治医疗器械注册审查指导原则现行2018-10-12 248骨科外固定支架注册技术审查指导原则(2018年修订)现行2018-10-25 249一次性使用医用喉罩注册技术审查指导原则(2018年修订)现行2018-10-25 250骨水泥套管组件注册技术审查指导原则现行2018-10-25 251护脐带注册技术审查指导原则(2018年修订)现行2018-11-07 252全瓷义齿用氧化锆瓷块注册技术审查指导原则(2018年修订)现行2018-11-07 253手动轮椅车注册技术审查指导原则现行2018-11-07 254外科纱布敷料注册技术审查指导原则(2018年修订)现行2018-11-28 255吻(缝)合器产品注册技术审查指导原则(2018年修订)现行2018-11-28 256一次性使用吸痰管注册技术审查指导原则现行2018-11-28 257一次性使用胆红素血浆吸附器注册技术审查指导原则现行2018-12-10 258一次性使用活检针注册技术审查指导原则现行2018-12-10 259医用激光光纤产品注册技术审查指导原则现行2018-12-17 260主动脉覆膜支架系统临床试验指导原则现行2019-02-25 261生物可吸收冠状动脉药物洗脱支架临床试验指导原则现行2019-02-25 262经导管植入式人工主动脉瓣膜临床试验指导原则现行2019-02-25 263眼科高频超声诊断仪注册技术审查指导原则现行2019-02-28 264双能X射线骨密度仪注册技术审查指导原则现行2019-02-28 265麻醉机注册技术审查指导原则现行2019-02-28 266口腔颌面锥形束计算机体层摄影设备临床评价指导原则现行2019-02-28 267脑利钠肽 氨基末端脑利钠肽前体检测试剂注册技术审查指导原则现行2019-03-05 268总甲状腺素检测试剂注册技术审查指导原则现行2019-03-05 269孕酮检测试剂注册技术审查指导原则现行2019-03-05270降钙素原检测试剂注册技术审查指导原则现行2019-03-05 271人工晶状体临床试验指导原则现行2019-03-18 272透明质酸钠类面部注射填充材料临床试验指导原则现行2019-03-18 273用于角膜制瓣的眼科飞秒激光治疗机临床试验指导原则现行2019-03-18 274牙科车针注册技术审查指导原则现行2019-04-03 275一次性使用配药用注射器注册技术审查指导原则现行2019-04-03 276一次性使用皮肤缝合器注册技术审查指导原则(2019年修订)现行2019-04-03 277医疗器械动物实验研究技术审查指导原则 第一部分:决策原则现行2019-04-18 278腹腔内置疝修补补片动物实验技术审查指导原则现行2019-04-18 279有源医疗器械使用期限注册技术审查指导原则现行2019-05-08 280离心式血液成分分离设备临床评价注册技术审查指导原则现行2019-05-10 281合成树脂牙注册技术审查指导原则现行2019-05-20 282宫内节育器注册技术审查指导原则现行2019-05-20 283植入式给药装置注册技术审查指导原则现行2019-05-20。
浅析b型超声诊断设备的检测技术

浅析b型超声诊断设备的检测技术
b型超声诊断设备可以诊断内部结构的改变,一般是通过发射电磁波来检测的,可以帮助医生诊断出患者体内的疾病。
随着新一代b 型超声诊断设备的出现,检测技术也发生了变化,下面我们就介绍一下b型超声诊断设备的检测技术。
第一、工作原理:b型超声诊断设备是一种通过利用电磁波来诊断患者体内疾病的设备,它的工作原理是电磁波的发射和接收,首先,该设备会发射一个包含频率的高能电磁波到患者体内,接着电磁波从患者体内的器官传回,之后由超声诊断设备进行接收,接收的信号需要经过计算机分析,再进行数据处理,最终能够得到患者内脏等器官的结构信息,从而帮助医生诊断出患者体内的疾病。
第二、技术特性:超声诊断设备的优势在于它能够提供准确、及时、多维度的信息,除了能够诊断患者体内疾病外,还能够检测患者血流量、血管状况以及其他信息,检测准确度比传统的诊断手段高出很多,而且操作简便,无需手术,安全性很高,病人可以进行检查,而不用担心伤害到自己。
第三、检测方法:b型超声诊断设备的检测方法有多种,比如,它可以通过回波检测和表面检测来进行检测,回波检测是通过发射电磁波,并记录由器官返回的回波信号来进行检测,可以检测出内部组织的变化,而表面检测则主要用来检测每种器官的位置、尺寸、形状、结构以及血管状况等。
综上所述,b型超声诊断设备的检测技术比传统诊断手段有着很
大的改进,无论是快速检测、准确率还是安全性,都实现了质的飞跃。
b型超声诊断技术在医疗诊断中有着重要作用,使得医生能够更准确地诊断出患者体内的疾病,可以更好地为患者服务。
(完整word版)10152-_B型超声诊断设备

(完整word版)GB10152-2009_B型超声诊断设备
GB 10152—2009 B型超声诊断设备
基本信息
【英文名称】B mode ultrasonic diagnostic equipment
【标准状态】现行
【全文语种】中文简体
【发布日期】1988/12/22
【实施日期】2010/12/1
【修订日期】2009/11/15
【中国标准分类号】C41
【国际标准分类号】11。
40.55;11。
040.50
关联标准
【代替标准】GB 10152-1997
【被代替标准】暂无
【引用标准】GB 9706.1,GB 9706.9,GB 9706。
15,GB/T 14710,YY/T 0108-2008,YY/T 1142-2003
适用范围&文摘
本标准规定了B型超声诊断设备(以下简称B超)的定义、要求、试验方法和检验规则。
本标准适用于标称频率在1.5 MHz~15 MHz范围内的B型超声诊断设备,包括彩色多普勒超声诊断设备(彩超)中的二维灰阶成像部分。
本标准不适用于眼科专业超声诊断设备和血管内超声诊断设备。
B型超声诊断设备技术指导原则

附件1:B型超声诊断设备(第二类)产品注册技术审查指导原则本指导原则旨在指导和规范第二类B型超声诊断设备的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则适用于《医疗器械分类目录》中第二类B型超声诊断设备(以下简称B型超声诊断仪),类别代号为6823。
二、技术审查要点(一)产品名称的要求B型超声诊断设备产品的命名应采用《医疗器械分类目录》或国家标准、行业标准中的通用名称,或以产品结构和应用范围为依据命名。
B型超声诊断仪是指频率范围在2~7.5 MHz以内,主要采用B型成像方式,用于医学临床诊断的通用设备(依据GB 10152-1997标准)。
依据GB 10152-1997标准,其产品名称应为B型超声诊断设备,但在实际应用中常采用的名称有:B型超声诊断仪、机械扇扫B型超声诊断仪、数字化B型超声诊断仪、线阵扫描B型超声诊断仪、凸阵扫描B型超声诊断仪、相控阵扫描B型超声诊断仪等。
建议规范名称为XXX型(系列)+ B型超声诊断仪。
若采用数字化波束成形技术的数字化设备,其规范名称为XXX型(系列)+ 数字化B型超声诊断仪。
(二)产品的结构和组成B型超声诊断仪的结构型式可为便携式、台车式,主要由主机(含软件)、显示器、探头和附件(如图像记录仪、图像存储器、彩色打印机、穿刺架等)组成。
探头主要由阵列换能器、传输线、连接器(可以含有控制器)等组成。
探头应明示基元数(如64、80、96、128)、频率、阵列长度或曲率半径。
便携式B型超声诊断仪产品技术要求lepu

便携式B型超声诊断仪适用范围:该设备供腹部器官超声成像使用。
1.1规格型号:LeView-1001.2划分说明:“LeView”为乐为英文名称,“100”为该设备的规格型号。
1.3结构组成:产品由便携式B型超声诊断仪主机和手机APP软件(版本为1.0.0)组成。
2.1正常工作条件1)环境温度:10℃~40℃2)相对湿度:≤70%3)大气压力:86~106kPa4)探头参数:64阵元 R60,标称频率为3.5MHz2.2产品性能指标2.2.1声工作频率声工作频率为3.5MHz,与标称频率的偏差应在±15%范围之内。
2.2.2探测深度≥160mm2.2.3侧向分辨力≤3mm(深度≤80mm)≤4 mm(80mm<深度≤130mm)2.2.4轴向分辨力≤2mm (深度≤80mm)≤3 mm(80mm<深度≤130mm)2.2.5盲区≤5mm2.3 外观a)表面整洁、色泽均匀、无伤痕、破损等缺陷;b)文字、符号和标志应清晰可见。
2.4 电气安全要求应符合GB 9706.1-2007《医用电气设备第1部分:安全通用要求》、 GB 9706.9-2008《医用电气设备第2-37部分:超声诊断和监护设备安全专用要求》的要求,电气安全基本特征见附录A。
2.5电磁兼容性要求应符合YY 0505-2012《医用电气设备第1-2部分:安全通用要求》的要求。
2.6环境要求环境试验按GB/T 14710-2009《医用电器环境要求及试验方法》及附录B的规定。
2.7 软件要求2.7.1 产品说明符合GB/T 25000.51-2010《软件工程软件产品质量要求与评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则》要求:详见附录C。
2.7.2 用户文档集符合GB/T 25000.51-2010《软件工程软件产品质量要求与评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则》要求:详见附录C。
北京汇影便携式B型超声诊断设备产品技术要求
便携式B型超声诊断设备结构组成:产品由便携式B型超声诊断设备(探头)和配套软件(软件名称:手持超声,版本V1.0.0)组成,手持超声(软件)需安装在配合使用的移动终端内(移动终端本身不属于产品组成)。
产品示意图见图1,各产品型号规格见表1。
图1 产品示意图表1 便携式B型超声诊断设备各型号规格预期用途:用于临床超声诊断检查。
2.1 正常工作条件1)环境温度:5℃~40℃2)相对湿度:≤80%3)大气压力:700hPa-1060hPa4)使用电源:移动终端内置电源(DC+5V)2.2 产品性能指标2.2.1 声工作频率标称频率及工作频率范围见表3。
声工作频率与标称频率的偏差应在±15%范围内。
2.2.2 探测深度具体指标见表3。
2.2.3 侧向分辨力具体指标见表3。
2.2.4 轴向分辨力具体指标见表3。
2.2.5 盲区具体指标见表3。
2.2.6 切片厚度具体指标见表3。
2.2.7 横向几何位置精度具体指标见表3。
2.2.8 纵向几何位置精度具体指标见表3。
表3、产品主要性能指标2.2.9 周长和面积测量偏差周长和面积的测量偏差在±20%范围内;2.2.10 电源电压适应范围在额定电压的±10%范围内,设备应能正常工作。
2.2.11 连续工作时间连续工作时间≥8h2.3 外观和结构1) 外表应色泽均匀、表面整洁、无划痕、裂痕等缺陷。
2) 面板上的文字和标记应清楚易认、持久。
3) 控制和调节机构应灵活、可靠,紧固部位无松动。
2.4 使用功能要求产品应具有下列功能:数据资料的设置、显示功能:应能在屏幕显示日期时间、灰度条、应用类型、探头型号。
屏幕上/下翻转功能图像显示方式:图像冻结、回放功能。
测量功能:B模式常规测量2.5 软件信息1)软件名称:手持超声,版本:V1.0.02)硬件配置:软件运行于Android 6.0以上版本安卓设备,且需要与全数字手持式超声诊断仪设备配合使用。
B型超声技术操作规程(标准版)
B型超声技术操作规程
一、工作室温20-25摄氏度。
二、开机前必须检查电源,电压,地线与仪器,看是否符合要求。
三、实行专人管理、专人操作,其他人不得开机使用。
四、加强机器维修保保管,注意防尘防潮防震,恒温稳压,通风,防止强光照射。
五、开机顺序:(1)接通电源;(2)开稳压器使用电压在220mv;(3)打开B 超机电源。
六、导线不要弯曲,探头不能使用有机溶液消毒,不要碰硬物,用后用柔软、浸润的砂布擦干净。
七、检查时要核对姓名、性别、年龄,检查中要认真仔仔细,图像要清晰准确。
八、加强财产管理,仪器要配套使用,严禁任意搬动,注意安全。
九、关机顺序:(1)先关B超机电源;2)再关稳压器电源;(3)最后关总电源;(4)关机后不能马上使用,需等一刻钟后,按开机顺序进行操作。
十、仪器发生故障时,立即向有关领导汇报,征得同意后请专人修理,较大的故障请厂家修理。
眼科超声诊断设备注册技术审查指导原则(2022年)
眼科超声诊断设备注册技术审查指导原则(2022年)本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围本指导原则适用于眼科A型超声测量仪和眼科B型超声诊断仪(以下简称眼科A 超、眼科B超,同时具备两种功能的称为眼科A/B超)。
通用型超声诊断设备适用范围若包括眼部,或眼科诊断/治疗设备中集成了眼科A/B超的功能,也应满足本指导原则的相应要求。
本指导原则所称眼科A超指YY/T0107—2022《眼科A型超声测量仪》中所规定的产品,其中专用于角膜厚度测量的眼科A超在业内通常被称为“P超”(Pachymeter,以下简称P超),本文提到眼科A超时若无特殊说明均包括P超。
本指导原则所称眼科B超指YY0773—2022《眼科B型超声诊断仪通用技术条件》中所规定的产品。
本指导原则不适用于高频眼科超声诊断仪或超声生物显微镜(UltrasoundBiomicroscope,以下简称UBM)。
二、产品介绍(一)眼科B超眼科B超成像的基本原理与通用B型超声诊断设备相同。
依据其预期对眼内和眼眶组织结构检查的需要,通常采用10MHz—25MHz的高频探头,并且其几何尺寸及声窗结构要适合人眼的结构。
通常采用单阵元高频机械扫描探头,也可采用适用于小器官扫查的高频线阵探头,不排除未来出现其他结构的眼科B超探头(如多阵列)。
探头直接接触眼睑皮肤或角膜对眼球和眼睛内部及周边结构进行成像。
最常见的单阵元机械扫描探头目前尚无法实现彩色多普勒模式,而小器官高频线阵探头用于眼部扫描时能够实现彩色多普勒成像。
彩色多普勒由于声输出能量较高通常不适用于眼部检查,仅在非常必要的特殊情况下可谨慎使用,如眼部恶性肿瘤诊断,严重眼外伤制定眼球手术方案。
眼科B超设备经常提供伪彩色模式,以提高病灶识别的敏感性。
单阵元机械扫描探头通过将机械扫描模式改为“直线+旋转”或平面扫描可实现三维成像。
浅析b型超声诊断设备的检测技术
浅析b型超声诊断设备的检测技术
B型超声诊断设备的检测技术目前已经成为影像学家和医学诊断领域的一种必不可少的工具,因为它具有优良的精确性、可靠性和高度可操作性等优点。
本文将详细介绍B型超声诊断设备的检测技术,以便让读者更好地了解该诊断设备。
首先,B型超声检测技术需要使用一种精确的压力传感器来检测被检测物体内部的压力。
该压力传感器需要与被检测物体的表面紧密接触,以便准确读取内部的压力值。
此外,B型超声诊断设备还需要使用一种精确的坐标系统来定位被检测物体的表面,确保检测的准确性和有效性。
其次,B型超声诊断设备还需要使用一种可以模拟内部压力分布的数值模型。
它可以根据压力传感器检测到的压力数据,模拟出被检测物体内部不同部位的压力分布情况。
在这个模型中,在检测前,可以根据坐标系统的不同定位将不同部位的压力设定为最佳值,以便在检测过程中准确读取内部压力数据。
最后,B型超声诊断设备还可以使用一种声发射装置来检测被检测物体的内部结构。
该声发射装置可以发射出一种高频声波,通过声波的反射进而检测出被检测物体内部的结构信息。
该技术目前已经成为影像学家和医学诊断领域中最常用的技术之一,因为其具有精确性强、可靠性高和可操作性好等优点。
综上所述,B型超声诊断设备的检测技术包括压力传感器检测,坐标系统定位检测和数值模型模拟以及声发射装置检测。
此外,结构
反射技术也可以彻底发挥出B型超声诊断设备的最大检测性能,从而有效提高医院和诊断室的诊断水平。
同时,在安装使用B型超声诊断设备时,一定要检查其规格参数,确保检测质量符合要求,以便为医疗诊断提供有效的实时信息和数据支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1:B型超声诊断设备(第二类)产品注册技术审查指导原则本指导原则旨在指导和规范第二类B型超声诊断设备的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则适用于《医疗器械分类目录》中第二类B型超声诊断设备(以下简称B型超声诊断仪),类别代号为6823。
二、技术审查要点(一)产品名称的要求B型超声诊断设备产品的命名应采用《医疗器械分类目录》或国家标准、行业标准中的通用名称,或以产品结构和应用范围为依据命名。
B型超声诊断仪是指频率范围在2~7.5 MHz以内,主要采用B型成像方式,用于医学临床诊断的通用设备(依据GB 10152-1997标准)。
依据GB 10152-1997标准,其产品名称应为B型超声诊断设备,但在实际应用中常采用的名称有:B型超声诊断仪、机械扇扫B型超声诊断仪、数字化B型超声诊断仪、线阵扫描B型超声诊断仪、凸阵扫描B型超声诊断仪、相控阵扫描B型超声诊断仪等。
建议规范名称为XXX型(系列)+ B型超声诊断仪。
若采用数字化波束成形技术的数字化设备,其规范名称为XXX型(系列)+ 数字化B型超声诊断仪。
(二)产品的结构和组成B型超声诊断仪的结构型式可为便携式、台车式,主要由主机(含软件)、显示器、探头和附件(如图像记录仪、图像存储器、彩色打印机、穿刺架等)组成。
探头主要由阵列换能器、传输线、连接器(可以含有控制器)等组成。
探头应明示基元数(如64、80、96、128)、频率、阵列长度或曲率半径。
产品图示举例:图1 B型超声诊断仪图2 B型超声诊断仪探头(三)产品工作原理:超声波频率在20kHz以上。
医学常用的诊断性超声频率范围一般在1~10MHz。
超声波波长短,易于集中成一束射线,因此具有很好的直线定向传播特性。
超声波在体内传播过程中,各种组织的声学界面产生不同的反射波和透射波,其中一部分可以返回换能器,再由换能器将声信号转换成电信号,并由主机接收放大以声像图形式显示于屏幕上。
B型超声诊断仪主要由探头和主机两部分组成。
超声波的发射与接受均由探头来完成。
主机供给一定频率、一定激励电压的电讯号作用于探头,探头产生一定频率的超声波。
B型超声诊断仪以光点亮度明暗显示体内某一断层界面回声信号的强弱。
信号强弱用灰阶表示(通过多阵元探头的多声束连续扫描,可将不同亮度光点组合成平面断层二维图像)。
B超诊断仪可获得人体软组织器官的实时二维断层图像,清晰地观察脏器形态、解剖层次及毗邻关系。
超声波能够区分两个相邻界面回声信号最短距离的能力称为分辨力。
通常,频率越高,则波长越短,分辨力越高,穿透能力越弱;反之,频率越低,则波长越长,分辨力越低,穿透能力越强。
因此检查浅表器官如甲状腺、乳腺等,多采用高频探头,如线阵7.5MHz探头,而对心脏、腹部等深部脏器,则采用低频探头,如凸阵3.5MHz探头,以增加其穿透性。
(四)产品作用机理因该产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(五)产品适用的相关标准目前与B型超声诊断仪产品相关的常用标准列举如下:表1 相关产品标准上述标准包括了注册产品标准中经常涉及到的标准。
有的企业还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
产品适用及引用标准的审查可以分两步来进行。
首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。
可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。
此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。
其次对引用标准的采纳情况进行审查。
即,所引用的标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。
这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
注意“规范性应用文件”和编制说明的区别,通常不宜直接引用或全面引用的标准不纳入规范性引用文件,而仅仅以参考文件在编制说明中出现。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
(六)产品的预期用途产品具体适用范围应与申报产品性能、配臵等一致,必要时应有相应的临床试验资料支持。
常见的预期用途如下:配3.5MHz线阵或凸阵探头:主要供人体腹部脏器超声诊查用。
若有M型辉度调制显示功能并有临床试验资料支持,还可用于心功能参数的测量;如配7.5MHz高频线阵探头,可用于人体浅表器官如甲状腺、乳腺的超声诊查;如配6.5MHz R13凸阵探头,可用于经阴道腔内女性生殖器官的超声诊查。
(七)产品的主要风险B型超声诊断仪的风险管理报告应符合YY/T 0316-2008《医疗器械风险管理对医疗器械的应用》的有关要求,判断与产品有关的危害,估计和评价相关风险,控制这些风险并监视控制的有效性。
主要的审查要点包括:1.与产品有关的安全性特征判定,可参考YY/T 0316-2008的附录C,附录C的清单是不详尽的,确定产品安全性特征应具有创造性,应当仔细考虑“会在哪儿出错”;2.危害、可预见的事件序列和危害处境判断,可参考YY/T 0316-2008附录E、I;3.风险控制的方案与实施、综合剩余风险的可接受性评价及生产和生产后监视相关方法,可参考YY/T 0316-2008附录F、G、J。
B型超声诊断仪的初始可预见性危害主要存在于产品设计、生产和使用环节。
如产品设计方面的初始可预见危害主要有:超声能量不恰当输出、电能危害,热能危害(探头表面温度)、生物不相容性(如探头材料等),等等;生产方面的初始可预见危害主要有:不合格材料、部件的非预期使用(采购或供方控制不充分),部件焊接、粘合和连接的不完整(制造过程控制不充分),等等;使用的初始可预见危害有:未限制非预期使用,未限制使用环境及人员,未告知正确使用、维护、保养设备的方法等导致设备不能正常使用、误诊等。
以下依据YY/T0316-2008的附录E(表E.2)从九个方面提示性列举了B型超声诊断仪的可能存在的初始危害因素,提示审查人员从以下方面考虑。
表2 产品主要初始危害因素(八)产品的主要技术指标产品标准的审查是产品主要技术性能指标审查中最重要的环节之一。
B型超声诊断仪主要技术性能指标可以分解为技术性能要求和安全要求两部分。
其中有些技术性能要求和安全要求又是相关联的。
标准中规定的要求部分是否齐全,可以通过对是否具有以下主要内容进行审评:1.安全要求(1)安全要求应符合GB 9706.1-2007和GB 9706.9-2008标准规定。
若为医用电气系统,则还应符合GB 9706.15-2008的要求。
(2)声输出参数公布要求:设备的声输出参数必须按GB/T 16846-2008的规定检验,若声输出参数不能满足免于公布条件,应以技术手册、使用说明书、背景资料的形式予以公布。
免于公布的声输出参数的数据必须经国家食品药品监督管理局认可的检验机构的认可。
2.环境试验要求设备的环境试验应按GB/T14710-1993中第2章的规定,明确所属气候环境试验组别和机械环境试验组别,并在注册产品标准、使用说明书中说明。
设备的环境试验条件除应根据所属组别按GB/T14710-93确定外,试验时间、恢复时间及检测项目按GB10152-1997表1的补充规定执行。
3.整机性能指标对设备主机和与之配套的(含选配探头)每一个探头必须给出下列参数:探头标称频率(单位MHz)探测深度(单位mm)侧向(横向)、轴向(纵向)分辨力(单位mm)横向、纵向几何位臵精度(%)盲区(单位mm)上述参数指标原则上应符合GB10152-1997附录B的相关要求。
通常第二类管理B型超声诊断仪属C档或D档,整机性能参数高于C档的,制造商可参考B档要求在注册产品标准明示整机性能指标,但不得声称为B档设备。
具体要求详见GB10152-1997附录B。
若配臵宽频探头,则应分别明示同一宽频探头在系统不同工作频率下的性能指标。
例:96基元R60宽频凸阵探头(频率范围2.0MHz-5.0MHz),则应给出系统工作频率在特定频率点(例如:2.5、3.5、5.0MHz)指定模式下的整机性能指标。
例:配臵 3.5MHz R60凸阵宽频探头(频率范围2.0MHz-5.0MHz)的整机性能指标表3 性能参数4.电源电压适应范围:额定电压±10%5.连续工作时间:>8h6.正常工作条件(包括环境温度、相对湿度、大气压力、电源等);7.外观和结构要求:由制造商在注册产品标准中明确,如:(1)B超表面应光洁、色泽均匀、无伤斑、划痕、裂纹等缺陷,面板上文字和标志应清晰;(2)控制和调节机构应灵活、可靠,紧固部位应无松动。
8.探头的生物相容性要求:预期与体表及粘膜表面进行一时接触(〈24h),按GB/T16886.1-2001给出的指导原则进行评估,提供相关资料证明细胞毒性试验、过敏试验和皮内刺激试验符合相关标准要求。
9.使用功能要求(包括软件功能):例如:主机工作频率切换、探头自动识别、电影回放、增益调节范围、图像放大倍率、焦点选择、灰阶分级、工作模式选择、边缘增强级数选择、动态范围级数、体标组和体标选择、字符和标志显示、测量和计算、管理功能、图像处理或打印功能等。
10.附件要求(若有):如穿刺架的材质、尺寸、耐腐蚀性等。
11. 电磁兼容性要求:应符合YY 0505-2005等相关标准要求。
12.若有M型辉度调制显示功能,则应按YY/T0108-2008要求,增加M模式下相关技术指标,主要有距离显示误差、时间显示误差并在制造商随机文件中公布。
(九)产品的检测要求产品的检测包括出厂检验和型式检验。
出厂检验前至少应逐台检测第八部分产品主要技术指标中的:外观和结构要求、整机性能指标(探头标称频率、探测深度、侧向或横向、轴向或纵向分辨力、横向、纵向几何位臵精度、盲区)、软件功能、电气安全要求中的接地阻抗、漏电流、电介质强度;其它应检测项目(如附件穿刺架要求)。
若有M型辉度调制显示功能,还应检测距离显示误差和时间显示误差。
型式检验为产品标准全性能检验。
(十)产品的临床要求1.符合《医疗器械注册管理办法》附件12规定,执行国家标准、行业标准的B型超声诊断仪,国内市场上有同类型产品,不要求提供临床试验资料。
