无机化学课件氮族元素
合集下载
无机化学第20讲 氮族元素

Ag 2NH3
Ag(NH )
3 2
Zn 4NH3
Co3 6NH3
2
BF3 NH3
Zn(NH ) Co(NH ) F3 BNH3
2 3 4 3 3 6
取代性:NH3中H原子可被其他原子或原子团取代 (氨解反应),如
4NH3 COCl 2 HgCl 2 2NH3 2Na 2NH3
17.3.2 氮的氧化物
N2O、NO、N2O3、NO2、N2O4、N2O5等
一氧化氮NO:分子轨道式为
[kk( σ 2s ) (σ ) (σ 2p x ) (π 2p y ) (π 2p z ) (π
2 * 2s 2 2 2 2 * 2p y
) ]
1
NO 是单电子分子。一般含有单电子的分子是有颜 色的,而且不稳定,但 NO既是无色气体又较稳定, 因此,有人称之为“稳定的自由基”。
无机化学
17.2.3 砷、锑、铋
As
Sb
Bi
单质砷和锑各有灰、黄、黑三种同素异形体,而铋没有 结构呈正四面体的黄砷(As4)与黄锑(Sb4)不稳定,温度高 时分解为As2、Sb2 常温下灰砷和灰锑是稳定单质;常温常压下,单质砷、锑、铋 均为固体 砷是非金属,锑、铋是金属,但熔点较低且易挥发 一般金属熔化时导电性能降低,铋却相反,固体铋的导电性仅 为液体的48%左右。
氨的工业制备 N2 + 3H2
Fe 触煤 500℃ 300~700atm
2NH3
无机化学
铵盐
一般为无色晶体,绝大多数易 溶于水,易水解,受热易分解
H
N
H
H H
NH 的鉴定
石蕊试纸 (红→蓝)
4
氮族元素PPT课件全文

NH2OH可与醛、酮形成肟,是聚酰胺纤维和尼龙的中间体
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
无机化学教学15章氮族元素PPT课件

THANKS FOR WATCHING
感谢您的观看
应;而一氧化氮与氢气反应生成氨气,氮元素从+2价降低到-3价,发
生还原反应。
氮族元素的配位反应
01
02
03
配位键的形成
氮族元素可以与配位体形 成配位键,如氮元素与氢 离子形成配位键。
配位反应的规律
配位反应遵循电子配对原 则,即电子总数为偶数的 电子对。
配位反应的实例
硫酸铵与氢氧化钡反应生 成硫酸钡沉淀和氨气,其 中硫酸根离子中的硫与氢 离子形成配位键。
砷在历史上曾用于制造杀 虫剂、防腐剂和颜料等, 但现在已被禁止或限制使 用,因为其具有剧毒性和 致癌性。
无机化学教学15章氮族元 素ppt课件
02 氮族元素的物理性质
氮族元素的原子结构
氮族元素位于元素周期表第VA 族,包括氮(N)、磷(P)、
砷(As)、锑(Sb)和铋 (Bi)。
氮族元素的原子结构特点是价电 子数为5,最外层电子排布为 ns²np³。
总结
磷的含氧酸和含氧酸盐是无机化学中重要的化合物,它们在自然界 中广泛存在,并具有多种应用,如磷肥可用于农业生产。
砷的含氧酸和含氧酸盐
含氧酸
砷酸、亚砷酸、次砷酸等。
含氧酸盐
砷酸盐、亚砷酸盐、次砷酸盐等。
总结
砷的含氧酸和含氧酸盐在无机化学中具有一定的研究价值, 它们在自然界中广泛存在,并具有潜在的应用前景,如砷 化合物在药物和农药等领域的应用。
由于价电子数相同,氮族元素的 原子半径相近,具有相似的电子
结构和性质。
氮族元素的单质和化合物
氮族元素的单质包括氮气、磷 单质、砷单质等。
氮族元素的化合物种类繁多, 包括氧化物、氢化物、含氧酸 及其盐等。
第20章 氮族元素 大学一年级 无机化学 课件

第20章 氮族元素
20.1通性
1.位置:VA 2.价电子构型 非金属 N -3 ,-2,-1,+1
P+2,+3,+4,+5 半金属 As -3,+3,+5 金属 Sb+3,+5
Bi+3,+5
2S22P3 3S23P3 4S24P3
5S25P3 6S26P3
3.原子半径4.离子半径5.第一电离势 6.电负性
结构化合物
NN
4.N2分子中孤电子对可以配位 [(NH3)5RuN2Ru(NH3)5]4+
二.氮在自然界中的分布和单质 Nhomakorabea1.地壳中:0.0046%
大气中: 78%
2.N≡N
3.实验室中制得N2:
NH4Cl+NaNO3=NaCl+NH4NO2
NH4NO2
N2+H2O
三.氨
1.制法N2+3H2 2.化学性质
共价半径 M3- M3+ M5+ 0.74A0 1.71 0.16 0.13 335
3.07
1.10 2.12 0.44 0.35 253 2.06
1.21 2.22 0.58 0.46 230 2.20
1.41 2.45 0.76 0.62 199 1.82
1.55 — 0.96 0.74 185 1.67
高温高压 Fe
2NH3
化肥原料
①加合反应-配位反应 :NH3 配体 配合物
②取代反应: CoCl2+NH3→Co(NH3)2+NH4Cl
③氧化反应:NH3+O2 Pt NO+H2O
四.氮的氧化物 P508
20.1通性
1.位置:VA 2.价电子构型 非金属 N -3 ,-2,-1,+1
P+2,+3,+4,+5 半金属 As -3,+3,+5 金属 Sb+3,+5
Bi+3,+5
2S22P3 3S23P3 4S24P3
5S25P3 6S26P3
3.原子半径4.离子半径5.第一电离势 6.电负性
结构化合物
NN
4.N2分子中孤电子对可以配位 [(NH3)5RuN2Ru(NH3)5]4+
二.氮在自然界中的分布和单质 Nhomakorabea1.地壳中:0.0046%
大气中: 78%
2.N≡N
3.实验室中制得N2:
NH4Cl+NaNO3=NaCl+NH4NO2
NH4NO2
N2+H2O
三.氨
1.制法N2+3H2 2.化学性质
共价半径 M3- M3+ M5+ 0.74A0 1.71 0.16 0.13 335
3.07
1.10 2.12 0.44 0.35 253 2.06
1.21 2.22 0.58 0.46 230 2.20
1.41 2.45 0.76 0.62 199 1.82
1.55 — 0.96 0.74 185 1.67
高温高压 Fe
2NH3
化肥原料
①加合反应-配位反应 :NH3 配体 配合物
②取代反应: CoCl2+NH3→Co(NH3)2+NH4Cl
③氧化反应:NH3+O2 Pt NO+H2O
四.氮的氧化物 P508
氮族元素PPT课件

(一) 氨和铵盐
1、 氨的制备
工业制备:ຫໍສະໝຸດ 催化剂N2 + 3 H2 高温、高压 2 NH3
300×105~700×105 Pa,约400~450 ℃
实验室制备: 2 NH4Cl(s) + Ca(OH)2(s) △ CaCl2(s) + 2 NH3↑+ 2 H2O
Mg3N2 + 6 H2O = 3 Mg(OH)2 + 2 NH3↑
氮元素
(二)联氨(肼)
2、 联氨的制备
2 NH3 + C1O- = N2H4 + C1- + H2O (NH2)2CO + NaClO + 2 NaOH = N2H4 + NaCl +
高温高压 与氢气反应: N2 + 3 H2 催 化 剂 2 NH3
与氧气反应: 与金属反应:
放电
N2 + O2
2 NO
250℃ 6 Li + N2 △ 2 Li3N
(IA 族)
3 Ca + N2 = Ca3N2 (IIA 族)
氮元素
(三)N2 的制备
1、工业制备 液体空气分馏,氮气先逸出
150×105 Pa 左右压强下钢瓶运输和使用
氮元素
2 、 氨分子的结构
不等性 sp3 杂化,有一对孤电子对 , 分子呈三角锥形结构,键角变小至 10718’ 。
3、 氨的物理性质
气态:常温常压下是具有刺激性气味的无色气体 溶液:在 20℃ 时 l dm3 水可溶解 700 dm3 氨 液态:2NH3 NH4+ + NH2-
KӨ = 1.9 10-33(-55 ℃)
工科大学化学----无机结构基础 《无机化学》第17章 《氮族元素》 课件

2013/12/23
第 17 章
氮族元素
Chapter 17 Nitrogen Family Elements
本章教学内容
17.1 氮族元素概述 17.2 氮族元素的单质 17.3 氮的化合物 17.4 磷的化合物 17.5 砷锑铋的化合物
17.1 氮族元素概述
氮族元素在周期表中的位置
氮族
~ 氮族元素的基本性质 ~
惰性气氛手套箱
1
2013/12/23
氮的结构
N 原子的价电子构型为 2s2 2p3,在 N2 形成时,两 个氮原子之间形成 1 个σ键和 2 个π键,所以结构式表示 为 :N N: 。
氮的性质
在一般情况下,N2 的化学 性质稳定,不易于与其他物质
N2 分子模型
发生反应,但常温下可与金属锂直接反应生成 Li3N,高 温时能和 Mg、Ca、Ba、Al、B、Si 等化合生成氮化物。
2P + 3X2 = 2PX3 PX3 + 3X2 = 2PX5 4P + 3S = P4S3 (P4S6, P4S10)
白磷和碱作用,发生歧化反应,生成膦和次磷酸盐。 P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO4
白磷能将 Au、Ag、Cu 等从它的盐溶液中还原出来。 11P+ 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4 2P+ 5CuSO4 + 8H2O = 5Cu + 2H3PO4 + 5H2SO4
元素 氮 (N) 磷 (P) 砷 (As) 锑 (Sb) 铋 (Bi)
原子序数
7
15
第 17 章
氮族元素
Chapter 17 Nitrogen Family Elements
本章教学内容
17.1 氮族元素概述 17.2 氮族元素的单质 17.3 氮的化合物 17.4 磷的化合物 17.5 砷锑铋的化合物
17.1 氮族元素概述
氮族元素在周期表中的位置
氮族
~ 氮族元素的基本性质 ~
惰性气氛手套箱
1
2013/12/23
氮的结构
N 原子的价电子构型为 2s2 2p3,在 N2 形成时,两 个氮原子之间形成 1 个σ键和 2 个π键,所以结构式表示 为 :N N: 。
氮的性质
在一般情况下,N2 的化学 性质稳定,不易于与其他物质
N2 分子模型
发生反应,但常温下可与金属锂直接反应生成 Li3N,高 温时能和 Mg、Ca、Ba、Al、B、Si 等化合生成氮化物。
2P + 3X2 = 2PX3 PX3 + 3X2 = 2PX5 4P + 3S = P4S3 (P4S6, P4S10)
白磷和碱作用,发生歧化反应,生成膦和次磷酸盐。 P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO4
白磷能将 Au、Ag、Cu 等从它的盐溶液中还原出来。 11P+ 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4 2P+ 5CuSO4 + 8H2O = 5Cu + 2H3PO4 + 5H2SO4
元素 氮 (N) 磷 (P) 砷 (As) 锑 (Sb) 铋 (Bi)
原子序数
7
15
第15章-氮族元素ppt课件

NH 4Cl NaNO 2 NaCl 2H2O N2
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
氮族元素--精品PPT课件_OK
第十二章 氮族元素
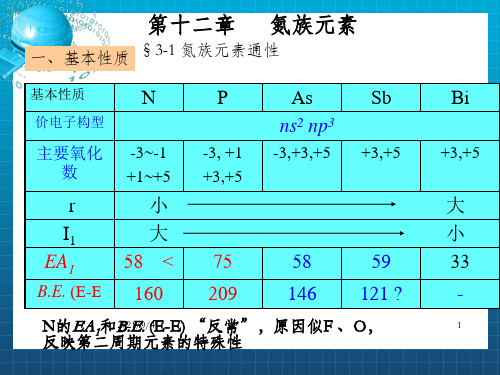
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(iii) 王水的氧化性:浓HNO3:浓HCl为3:1 叫做 王水,它的氧化性比硝酸更强,可溶解金、铂等不活 泼金属(实际上是多种氧化剂+配位剂Clˉ在起作用)
D.硝化反应—— 与有机化合物发生反应,生成 硝基化合物(RNO2).
硝酸盐NO3ˉ: (i) 结构: 正三角形,sp2杂化,有个大π36键
盐溶液显酸性(水解) 与碱溶液的反应:
NH4+ + OH- == NH3 + H2O
(iii) NH4+ 的鉴别: A. 若NH4+量多,可用加强碱加热,用湿润的蓝 色石蕊试纸(变兰)检验气体;
B. 若NH4+量少,加Nessler试剂(K2[HgI4]的KOH 溶液)检验(通常为红棕色)
NH4+ + [HgI4]2- + OH-
白磷、红磷的物理性质
白磷
红磷
色、态
白色蜡状
红棕色粉末
溶解性 毒性
着火点
不溶于水,溶于CS2 剧毒
40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 用途 分子结构
相互转化
密封,保存于冷水中
密封,防止吸湿
制高纯度磷酸
制安全火柴、火药
P4 正四面体 键角60°
结构复杂
白磷
隔绝空气加热到260℃ 红磷
氨气的化学性质:
可发生三类反应:
A. 加合反应:NH3作为一种典型的Lewis碱,可与许多 金属离子(如Ag+、Cu2+、Co3+、Ni2+)形成配合物;与某些盐 晶体加合(如8NH3+CaCl2 → CaCl2·8NH3 )
B. 取代反应:NH3中的氢可被活泼的金属取代生成氨 基化合物(-NH2)和氢气。
Hg
[O
NH2]I
Hg
联氨(肼)、羟胺
OH-
NH2OH 无色固体
-NH2
N2H4 无色液体
奇数电子分子与NO、NO2:
(i)奇数电子分子—— 分子中各原子的价电子总数 为奇数的分子,即含有未成对电子,是顺磁性分子。
NO: (σ2s)2 (σ*2s)2 (σ2px)2 (π2py)2 (π2pz)2 (π*2py)1 顺磁性
色不亚溶硝) 酸盐绝大部分无色,易溶于水,(AgNO2浅黄
金属活泼性差,对应亚硝酸盐稳定性差。
HNO3:
(1)、 制备—— 硝酸HNO3极不稳定,仅存在于冷 而稀的溶液中。
(2)、 结构—— sp2杂化,有个大π34键。
(3)、 性质: A.不稳定——硝酸HNO3溶液中带有黄色或红棕色 是由于见光或受热分解生成的NO2溶解而造成的。
(ii) 固体铵盐受热易分解——不稳定性
分解产物与组成铵盐的酸的性质有关:
1、分为挥发性酸HCl(NH3+HCl) 2、不易挥发性酸H2SO4、H3PO4(氨+酸或酸式盐) 3、氧化性酸HNO3(氮气或一氧化二氮)
NH4Cl == NH3 + HCl
NH4HCO3 == NH3 + H2O + CO2 NH4NO3 △ N2O + 2H2O 或4NH4NO3 △ 3N2 + NO2 + 8H2O
4NO2 + H2S →4NO + SO3 + H2O 10NO2+2MnO4-+2H2O → 2Mn2++10NO3-+4H+
2NO+3I2+4H2O → 2NO3-+ 8H++6I-
2NO2 + 2NaOH
NaNO2 + NaNO3 +H2O
光化学烟雾 氮氧化物(NOx)主要是指NO和NO2。NO和NO2都是对人体 有害的气体。氮氧化物和碳氢化合物在大气环境中受强烈的太 阳紫外线照射后产生一种新的二次污染物——光化学烟雾,在 这种复杂的光化学反应过程中,主要生成光化学氧化剂(主要 是O3)及其他多种复杂的化合物,统称光化学烟雾。
第十四章 p区元素(二)
一. 氮族元素 二. 氧族元素
§13.1 氮族元素-----P516-547
氮族元素包括:
氮N、 磷P、 砷As、 锑Sb、 铋Bi
氮族元素的价层电子构型: 本节要求:
ns2np3
1. 熟悉氮族元素的性质规律 2. 熟悉N、P单质及主要化合物(NH3与铵盐、硝酸与 硝酸盐、磷酸和磷酸盐 )的结构特点和性质 3. 熟悉等电子体、奇数电子分子及其规律。
性质稳定,所以常温下不与任何元素化合,可作保护
气。但在高温下,N2是活泼的非金属:
1、氮气与氢气反应
Haber F. 获1916年诺贝尔奖
高温、高压
N2 + 3H2
2 NH3 催化剂
2、氮气与氧气反应 N 2 O2 放电 2NO
2NO + O2 == 2NO2
无色
红棕色
3NO2 +H2O == 2HNO3 +NO
C. 氧化还原反应:NH3的N为-3价,可被强氧化剂 (如O2)氧化。
溶于水、与水的反应 喷泉实验
NH3+H2O (大部分) NH3·H2O (小部分) NH4++OH-
与酸的反应 NH3+HCl
NH4Cl (白烟)
与氧化剂反应
4NH3+5O2
催化剂 4NO+6H2O
(氨氧化法制硝酸)
2NH3+3Cl2
HNO2、NO2-:
(i) NO + NO2在冷水中可生成亚硝酸,HNO2极不 稳定,仅存在于冷而稀的溶液中。
(ii) NO2ˉ则比较稳定,但却是致癌物质,通常在 腐烂的菜叶中含有。
亚硝酸盐遇到仲胺可形成 亚硝酰,可引起消化系统癌症
(iii) HNO2、NO2ˉ的结构如下(V形,sp2杂化,有
个大π33、π34键)。在酸性条件下是常用的氧化剂:
N2+6HCl (NH3不足)
2NH3+3CuO
3Cu+N2+3H2O
氨气用途 制纤维、塑料、染料
氨 制铵盐、
制纯碱
制尿素
制硝酸
制医用稀氨水、 用做致冷剂
氮的固定
豆 科 植 物 的 根 瘤 菌
氮 、 氧 直 接 化 合
将空气中游离的氮转变为化合态氮的 方法,统称氮的固定
铵盐NH4+ :
(i) 与碱金属的钾盐性质相似(K+、NH4+半径相近) —— 如溶解性
如N2-CO-CNˉ-NO+; CH4-NH3; H2SO4-H3PO4等
2. 氮的主要化合物:
NH3
(i)制备 —— 实验室用铵盐与强碱共热;工业上用 N2+H2合成得到。
(ii)结构 —— 三角锥形,sp3不等性杂化形成三个σ键、 一对孤对电子。
(iii) 性质
氨气的物理性质:
无色、有剌激性气味的气体 比空气轻 极易溶于水(极性+氢键) 易液化(分子间作用力大)
最高价氧物 对应水化物
酸性
氮
磷
砷
锑
铋
N
P
As
Sb
Bi
ns2np3
VA族,第二周期-----第六周期
+1—+5 -3
逐渐增大
+3、+5 -3
+3、-3 +5
+3、+5
+3、+5
递变性:非金属性逐渐减弱,金属性逐渐增强
NH3
PH3 AsH3
SbH3 BiH3
逐渐减弱
HNO3
H3PO4 H3AsO4
逐渐减弱
白磷(水) 红磷NP源自AsSbBi
一. 氮族元素的概述:
1、氮主要以单质形态存在空气中。除土壤中含有一些铵 盐、硝酸盐外,氮以无机化合物形式存在于自然界是很少的。 氮普遍存在于有机体中,它是组成动植物蛋白质的重要元素。
2、磷在自然界中总是以磷酸盐的形式出现的,例: Ca3(PO4)2——磷酸钙,Ca5F(PO4)3——磷灰石。磷是生物体 不可缺少的元素之一。在植物体中磷主要含于种子的蛋白质中, 在动物体中,则含于脑、血液和神经组织的蛋白质中,骨骼中 也含有磷。磷有多种同素异形体,最常见的是白磷和红磷。
(ii) 性质:
A. 一般都是离子化合物,易溶于水; B. 常温下,水溶液或固体都比较稳定;但加热也 容易分解,而且分解产物各异但有规律;K-Ca-Na、 Mg-Al-Zn-Fe-Sn-Pb-Cu、Hg-Ag-Pt-Au:
C. 在常温下,固体硝酸盐和水溶液 无氧化性; 但加热或酸性条件时表现出氧化性。
2P + 3Cl2 (不足) = 2PCl3 (液体)
氮气及其化合物之间的转化关系:
Mg3N2
NH3
NH3·H2O
铵盐
空气 N2 NO
NO2 HNO3
硝酸盐
三. 磷单质及其主要化合物: 1. 磷单质 —— 有三种同素异形体:白磷、红磷和
黑磷,结构与性质各不相同,它们的结构分别为
白磷的分子结构:
P4 (正四面体,键角为60°)
60°
109°28′
红、黑磷的分子结构分别为:
1. 由非金属(N、P、As)向金属(Sb、Bi )过渡
2. 氧化值一般为+3、+5,且从上到下+5价化合 物稳定性降低,而+3价化合物的稳定性增强(惰性电子
对效应) 。 3. 形成的化合物主要是共价化合物。
二. 氮单质及其主要化合物:
1. N2、等电子体
(i)制备 —— 实验室用NH4NO2(或NaNO2+NH4Cl)
加热 ;工业上用液化空气分馏得到。
自然界里氮主要以游离态存在于大气中,
其体积分数为78%,质量分数为_7_5_%___
(ii)氮气的物理性质、化学性质
无色气体,比空气稍轻,难溶于水,难液化
