高考化学元素周期律综合题汇编
高考化学压轴题专题元素周期律的经典综合题含详细答案

高考化学压轴题专题元素周期律的经典综合题含详细答案一、元素周期律练习题(含详细答案解析)1.高温下,正硅酸锂(Li 4SiO 4)能与CO 2发生反应,对控制CO 2的排放具有重要的理论意义和实用价值。
完成下列填空:(1)硅原子核外电子占有_____种能量不同的轨道;Li 、C 、Si 的最高价氧化物中,属于原子晶体的是_____。
(2)钠元素的金属性比锂强,用原子结构的知识说明理由_____。
一定温度下,在2L 的密闭容器中,Li 4SiO 4与CO 2发生如下反应:Li 4SiO 4(s)+CO 2(g)Li 2SiO 3(s)+Li 2CO 3(s)。
(3)该反应的平衡常数表达式K=_____,反应20min ,测得容器内固体物质的质量增加了8.8g ,则0~20min 内CO 2的平均反应速率为_____。
(4)在T 1、T 2温度下,恒容容器中c(CO 2)随时间t 的变化关系如图所示。
该反应是_____反应(选填“放热”或“吸热”)。
若T 1温度下,达到平衡时c(CO 2)为amol·L -1,保持其他条件不变,通入一定量的CO 2,重新达到平衡时c(CO 2)为bmol·L -1。
试比较a 、b 的大小,并说明理由_____。
【答案】5 SiO 2 钠元素和锂元素均为第ⅠA 族元素,Na 原子有3个电子层,Li 原子有2个电子层,原子半径Na>Li ,则原子核对外层电子的吸引能力:Na<Li ,失电子能力:Na>Li ,因此金属性Na 强于Li ()21c CO 0.005mol·L -1·min -1 放热 a=b ,通入一定量的CO 2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=()21c CO 不变,故达到新平衡时c (CO 2)不变,即a=b【解析】【分析】【详解】(1)硅是14号元素,基态硅原子的核外电子排布式为1s 22s 22p 63s 23p 2,其核外电子共占有5种能量不同的轨道;Li 、C 、Si 的最高价氧化物分别为Li 2O 、CO 2、SiO 2,Li 2O 是离子晶体、CO 2是分子晶体、SiO 2是原子晶体,故答案为:5;SiO 2;(2) 钠元素的金属性比锂强,从原子结构解释:钠元素和锂元素均为第ⅠA 族元素,Na 原子有3个电子层,Li 原子有2个电子层,原子半径Na>Li ,则原子核对外层电子的吸引能力:Na<Li ,失电子能力:Na>Li ,因此金属性Na 强于Li ,故答案为:钠元素和锂元素均为第ⅠA 族元素,Na 原子有3个电子层,Li 原子有2个电子层,原子半径Na>Li ,则原子核对外层电子的吸引能力:Na<Li ,失电子能力:Na>Li ,因此金属性Na 强于Li ;(3)平衡常数等于生成物的平衡浓度幂之积除以反应物的平衡浓度幂之积,根据化学反应方程式Li 4SiO 4(s)+CO 2(g)Li 2SiO 3(s)+Li 2CO 3(s),反应物为气体的是二氧化碳,生成物均为固体,则平衡常数()21K=c CO ;反应中固体增加的质量即为消耗的CO 2的质量,反应20min 消耗的CO 2的质量为8.8g ,∆c(CO 2)=8.8g÷44g/mol÷2L=0.1mol·L -1,则0~20min 内CO 2的平均反应速率()()-12-1-12c CO 0.1mol L CO ===0.005mol L min t 20minυ∆⋅⋅⋅∆,故答案为:()21c CO ;0.005mol·L -1·min -1; (4)由图像分析可知,T 1先达到平衡,则温度T 1>T 2,T 2到T 1的过程是升温,c(CO 2)增大,平衡逆向移动,则该反应是放热反应;若T 1温度下,达到平衡时c(CO 2)为amol·L -1,保持其他条件不变,通入一定量的CO 2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=()21c CO 不变,故达到新平衡时c (CO 2)不变,即a=b ,故答案为:放热;a=b ,通入一定量的CO 2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=()21c CO 不变,故达到新平衡时c (CO 2)不变,即a=b 。
专题23 元素周期律(学生版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题23元素周期律1.【2022年湖南卷】科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。
下列说法错误的是A.原子半径:X>Y>Z B.非金属性:Y>X>WC.Z的单质具有较强的还原性D.原子序数为82的元素与W位于同一主族2.【2022年全国甲卷】Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。
Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q 原子内层电子数的2倍。
下列说法正确的是A.非金属性:X>Q B.单质的熔点:X>YC.简单氢化物的沸点:Z>Q D.最高价含氧酸的酸性:Z>Y 3.(2021·山东真题)X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。
下列说法错误的是A.原子半径:X>Y B.简单氢化物的还原性:X>YC.同周期元素形成的单质中Y氧化性最强D.同周期中第一电离能小于X的元素有4种4.(2021·河北真题)用中子轰击N Z X原子产生α粒子(即氮核42He)的核反应为:NX+10n→7p Y+42He。
已知元素Y在化合物中呈+1价。
下列说法正确的是ZA.H3XO3可用于中和溅在皮肤上的NaOH溶液B.Y单质在空气中燃烧的产物是Y2O2C.X和氢元素形成离子化合物D.6Y和7Y互为同素异形体5.(2020·全国高考真题)1934年约里奥–居里夫妇在核反应中用α粒子(即氦核42He)轰击金属原子W Z X,得到核素30Z+2Y,开创了人造放射性核素的先河:W Z X+42He→30Z+2Y+10n。
其中元素X、Y的最外层电子数之和为8。
下列叙述正确的是A.W Z X的相对原子质量为26B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸6.(2018·天津高考真题)下列有关物质性质的比较,结论正确的是A.溶解度:Na2CO3<NaHCO3B.热稳定性:HCl<PH3C.沸点:C2H5SH<C2H5OHD.碱性:LiOH<Be(OH)27.(2017·天津高考真题)根据元素周期表和元素周期律,判断下列叙述不正确的是A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族8.(2014·山东高考真题)根据原子结构及元素周期律的知识,下列推断正确的是A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.核外电子排布相同的微粒化学性质也相同C.Cl‾、S2‾、Ca2+、K+半径逐渐减小D.3517Cl与3717Cl得电子能力相同9.(2015·重庆高考真题)下列说法正确的是A.I的原子半径大于Br,HI比HBr的热稳定性强B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强C.Al2O3和MgO均可与NaOH溶液反应D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 10.(2020·全国高考真题)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。
全国高考化学元素周期律的综合高考模拟和真题分类汇总含详细答案

全国高考化学元素周期律的综合高考模拟和真题分类汇总含详细答案一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
高考化学十年真题专题汇编解析-物质结构-元素周期表、周期律

题型一:原子结高考化学十年真题专题汇编-物质结构 元素周期表、周期律构化学键1.(2019·北京)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
铟与铷(37Rb)同周期。
下列说法不正确的是A.In 是第五周期第ⅢA 族元素B.的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In(OH)3>RbOH 【答案】D【解析】本题考查原子结构、元素周期表和元素周期律,考查的核心素养是证据推理与模型认知。
Rb 为碱金属,属于第五周期元素,故In 亦为第五周期元素,In 与Al 同主族,即为第ⅢA 族元素,A项正确;的中子数为115-49=66,质子数为49,质子数等于核外电子数,故中子数与电子数之差为17,B 项正确;同主族元素,从上到下,原子半径逐渐增大,故原子半径:In >Al ,C 项正确;同周期主族元素从左到右,金属性逐渐减弱,故其最高价氧化物对应水化物的碱性逐渐减弱,即碱性In(OH)3<RbOH ,D 项错误。
2.(2019·浙江)下列说法正确的是A.18O 2和16O 3互为同位素B.正己烷和2,2-二甲基丙烷互为同系物C.C 60和C 70是具有相同质子数的不同核素D.H 2NCH 2COOCH 3和CH 3CH 2NO 2是同分异构体【答案】B【解析】本题考查核素、同位素、同系物以及同分异构体的概念。
同位素的研究对象为原子,而18O 2和16O 3为单质,A 项错误;正己烷和2,2-二甲基丙烷结构相似,在分子组成上相差1个“CH 2”原子团,两者互为同系物,B 项正确;C 60和C 70均为单质,不是核素,C 项错误;H2NCH2COOCH3的分子式为C3H7NO2,而CH3CH2NO2的分子式为C2H5NO2,两者不是同分异构体,D项错误,故选B。
全国各地高考化学分类:元素周期律综合题汇编含答案解析
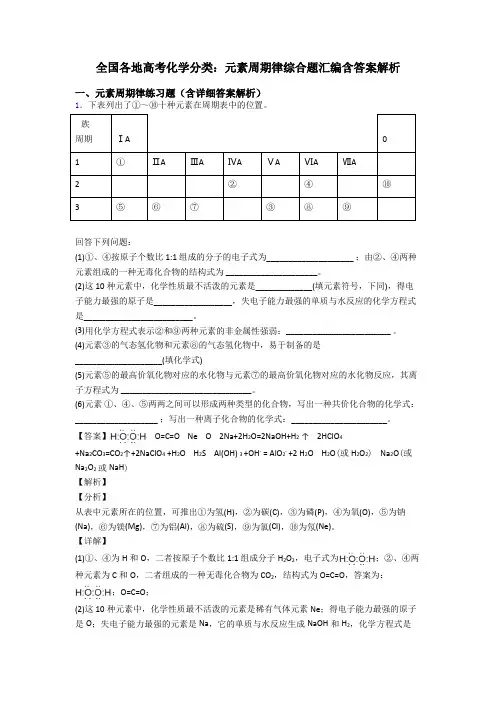
全国各地高考化学分类:元素周期律综合题汇编含答案解析一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
全国高考化学元素周期律的综合高考真题分类汇总及答案
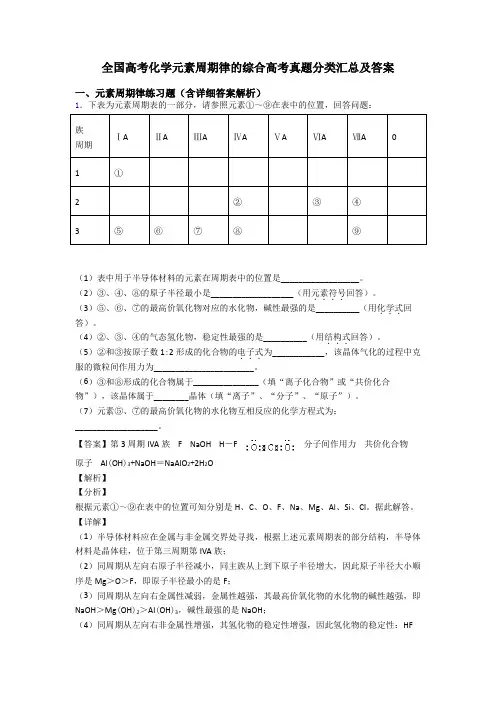
全国高考化学元素周期律的综合高考真题分类汇总及答案一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H2O>CH4,最稳定的氢化物是HF,其结构式为H-F;(5)②和③按原子数1:2形成的化合物是CO2,其电子式为:,CO2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH,⑦是Al,其最高价氧化物的水化物是Al(OH)3,Al(OH)3表现两性,与碱反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
高中化学元素周期律高考化学三年真题专项汇编卷20192021
高考化学三年真题专项汇编卷(2019-2021)(6)元素周期律1.【2020年•浙江,16】X 、Y 、Z 、M 、Q 五种短周期元素,原子序数依次增大。
Y 元素的最高正价为+4价,Y 元素与Z 、M 元素相邻,且与M 元素同主族;化合物24Z X 的电子总数为18个;Q 元素的原子最外层电子数比次外层少一个电子。
下列说法不正确的是( )A.原子半径:Z<Y<MB.最高价氧化物对应水化物的酸性:Z > Y > MC.22X Z ZX -易溶于水,其水溶液呈碱性D.X 、Z 和Q 三种元素形成的化合物一定是共价化合物2.【2020年•天津,8】短周期元素X 、Y 、Z 、W 的原子序数依次增大。
用表中信息判断下列说法正确的是( )XY Z W 分子式34H ZO 10.1mol L -⋅溶液对应的pH (25℃) 1.00 13.00 1.570.70 C.元素第一电离能:Z<W D.简单氢化物的沸点:X<Z3.【2020年•新高考Ⅰ卷,3】短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物22Z X ,Y 、W 最外层电子数相同。
下列说法正确的是( )A.第一电离能:W>X>Y>ZB.简单离子的还原性:Y>X>WC.简单离子的半径:W>X>Y>ZD.氢化物水溶液的酸性:Y>W4.【2020年•全国Ⅲ卷,14】W 、X 、Y 、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z ;化合物3XW 与WZ 相遇会产生白烟。
下列叙述正确的是( )A.非金属性:W> X>Y> ZB.原子半径:Z>Y>X>WC.元素X 的含氧酸均为强酸D.Y 的氧化物水化物为强碱5.【2020年•全国Ⅱ卷,14】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W 、X 、Y 、Z 的原子序数依次增大、且总和为24。
高考化学元素周期律综合题汇编及答案
高考化学元素周期律综合题汇编及答案一、元素周期律练习题(含详细答案解析)1.已知元素X 、Y 均为短周期元素,X 元素的一种核素常用于测文物的年代,Y 元素原子半径是所有原子中最小的,元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56。
N 是一种常用溶剂,它的实验式XY 。
回答下列问题:(1)符合条件的M 的有 ______种。
(2)任意写一种不带支链的M 的结构简式__________。
(3)若在N 与液溴的混合液中加入铁粉可以发生反应(在如图装置a 容器中反应),则:①写出a 容器中发生的所有反应的化学方程式:_____________。
②d 容器中NaOH 溶液的作用是_____________。
(4)在碘水中加入N 振荡静置后的现象是__________。
(5)等质量M 、N 完全燃烧时消耗O 2的物质的量较多的是________(填“M ”或“N ”)。
【答案】3 CH 2=CH -CH 2-CH 3 2Fe +3Br 2=2FeBr 3、+Br 23FeBr −−−→+HBr 吸收HBr 和Br 2,防止污染环境 溶液分层,下层无色,上层紫红色 M【解析】【分析】短周期元素X 元素的一种核素常用于测文物的年代,则X 为碳(C );Y 元素原子半径是所有原子中最小的,则Y 为氢(H )。
元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56,则M 为分子式C 4H 8的烯烃;N 是一种常用溶剂,它的实验式XY ,则N 为苯(C 6H 6)。
【详解】由以上分析可知,M 是分子式为C 4H 8的烯烃,N 是分子式为C 6H 6的苯。
(1)符合条件的M 有CH 2=CHCH 2CH 3、CH 3CH =CHCH 3、(CH 3)2C =CH 2,共3种。
高考化学元素周期律综合经典题附答案解析
高考化学元素周期律综合经典题附答案解析一、元素周期律练习题(含详细答案解析)1.已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大.B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素中原子半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍.请回答下列问题:(1)画出F的原子结构示意图_____。
(2)B、C、E对应简单离子的半径由大到小的顺序为_____(用具体微粒符号表示)。
(3)A的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于_____(填“离子化合物”或“共价化合物”)。
(4)加热条件下,B单质与C单质的反应产物的电子式为______。
(5)D元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物的溶液反应的化学方程式为______。
【答案】 S2- > O2-> Na+离子化合物Al(OH)3 + NaOH = NaAlO2 + 2H2O【解析】【分析】A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,D 是地壳中含量最多的金属元素,则D为Al元素;E、F原子序数均大于Al,处于第三周期,而E元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,故E为S元素,F为Cl;B和E同主族,则B为O元素;A、B在元素周期表中处于相邻的位置,A为N元素;C元素原子在同周期主族元素中原子半径最大,处于IA族,原子序数介于氧、铝之间,故C为Na,以此分析解答。
【详解】(1)根据上述分析可知:F为Cl元素,原子结构示意图为,故答案:。
(2)根据上述分析可知:B为O元素,C为Na元素,E为S元素,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2- > O2-> Na+,故答案为:S2- > O2-> Na+;(3)根据上述分析可知:A为N元素,A的气态氢化物、最高价氧化物对应水化物分别为氨气、硝酸,二者反应生成硝酸铵,属于离子化合物,故答案为:离子化合物;(4)根据上述分析可知:B为O元素,C为Na元素,加热条件下氧气与钠的反应生成Na2O2,含有离子键、共价键,所以电子式为:,故答案:;(5)根据上述分析可知:D为Al元素,C为Na元素。
新高考专用2024_2025三年高考化学真题分项汇编专题06物质结构元素周期律
专题06 物质结构元素周期律1.(2024·湖南卷)下列说法错误的是A.氢键,离子键和共价键都属于化学键B.化学家门捷列夫编制了第一张元素周期表C.药剂师和养分师必需具备化学相关专业学问D.石灰石是制造玻璃和水泥的主要原料之一【答案】A【解析】A.离子键和共价键都属于化学键,氢键属于分子间作用力,A说法错误;B.第一张元素周期表是俄国化学家门捷列夫编制的,B说法正确;C.药剂师和养分师的工作分别与药剂和养分物质有关,因此必需具备相关的化学专业学问才能胜任相关工作,C说法正确;D.制造玻璃的主要原料是石灰石、石英和纯碱,制造水泥的主要原料是石灰石和黏土,D说法正确;综上所述,本题选A。
2.(2024·广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。
戊的最高价氧化物对应的水化物为强酸。
下列说法不正确的是A.原子半径:丁>戊>乙B.非金属性:戊>丁>丙C.甲的氢化物遇氯化氢肯定有白烟产生D.丙的最高价氧化物对应的水化物肯定能与强碱反应【答案】C【解析】甲~戊是短周期元素,戊中的最高价氧化物对应水化物为强酸,则可能是硫酸或高氯酸,若是高氯酸,则戊为Cl,甲为N、乙为F、丙为P、丁为S,若是硫酸,则戊为S,甲为C、乙为O、丙为Si、丁为P。
A.依据层多径大,同电子层结构核多径小原则,则原子半径:丁>戊>乙,故A正确;B.依据同周期从左到右非金属性渐渐增加,则非金属性:戊>丁>丙,故B正确;C.甲的氢化物可能为氨气,可能为甲烷、乙烷等,若是氨气,则遇氯化氢肯定有白烟产生;若是甲烷、乙烷等,则遇氯化氢不反应,没有白烟生成,故C错误;D.丙的最高价氧化物对应的水化物可能是硅酸、也可能是磷酸,都肯定能与强碱反应,故D正确。
综上所述,答案为C。
3.(2024·湖南卷)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学元素周期律综合题汇编一、元素周期律练习题(含详细答案解析)1.元素周期表是打开物质世界奧秘之门的一把金钥匙,1869年,门捷列夫发现了元素周期律并发表了元素周期表。
下图为元素周期表的一部分,回答下列问题。
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
【答案】Ar F HNO3制光电池 Mg>C>O KOH Al2O3 +2OH-=2AlO2- +H2O【解析】【分析】由元素周期表可知,a为Li、b为C、c为N、d为O、e为F、f为Mg、g为Al、h为Si、i 为Ar、j为K。
【详解】(1)0族元素的化学性质最稳定,故上述元素中化学性质最稳定的是Ar;F元素的非金属性最强;(2)c为N,其最高价氧化物对应的水化物为HNO3;(3)h为Si,核电荷数为14,原子的核外电子数也是14,Si的原子结构示意图为;Si单质的一种用途是可以制光电池;(4)b为C、d为O、f为Mg,当电子层数相同时,核电荷数越大原子半径越小;电子层数越多原子半径越大,故b、d、f三种元素原子半径由大到小的顺序是Mg>C>O;(5)a为Li、g为Al、j为K,K的金属性最强,金属性越强,最高价氧化物对应的水化物的碱性越强,故a、g、j的氢氧化物中碱性最强的是KOH;g的氧化物为Al2O3,Al2O3与KOH溶液反应的离子方程式为Al2O3 +2OH-=2AlO2- +H2O 。
2.南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:N、O、Mg元素的前3级电离能如下表所示:元素I1/kJ∙mol-1I2/kJ∙mol-1I3/kJ∙mol-1X737.71450.77732.7Y1313.93388.35300.5Z1402.32856.04578.1①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。
科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号πnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则N4-中的大π键应表示为_________。
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。
若晶体中紧邻的N5-与Ag+的平均距离为a nm,N A表示阿伏加德罗常数的值,则AgN5的密度可表示为_____g∙cm-3(用含a、N A的代数式表示)。
【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态,其失去第一个电子较难,I1较大,则Z为氮元素配位键氢键 sp254π 12223A8.910 N a⨯⨯【解析】【分析】(1)根据构造原理书写出25号Mn元素的原子核外电子排布式,Mn原子失去最外层2个电子得到Mn2+;根据原子结构与元素在周期表的位置确定Ag在周期表所属区域;(2)①根据元素的电离能大小结合原子结构确定X、Y、Z三种元素,然后判断哪种元素是N元素;②根据图示,判断晶体中阳离子、阴离子中含有的作用力类型;③结合N 5-为平面正五边形结构,结合原子杂化类型与微粒构型关系分析判断,结合微粒的原子结构分析大π键的形成;(3)根据晶胞中离子的相对位置判断Ag +的配位数,利用均摊方法计算1个晶胞中含有的AgN 5的个数,结合ρ=m V 计算密度大小。
【详解】(1)Mn 是25号元素,根据构造原理可得Mn 原子的核外电子排布式为1s 22s 22p 63s 23p 63d 54s 2,Mn 原子失去最外层2个电子得到Mn 2+,其价电子排布式为3d 5;Ag 、Cu 在周期表中位于第IB ,发生变化的电子有最外层的s 电子和次外层的d 电子,属于ds 区元素;(2)①X 的第一、第二电离能比较小且很接近,说明X 原子最外层有2个电子,容易失去,则X 为Mg 元素,Z 的第一电离能在三种元素中最大,结合N 原子2p 轨道处于半充满的稳定状态,其失去第一个电子较难,I 1较大,可推知Z 为N 元素,Y 是O 元素;②在该晶体中阳离子[Mg(H 2O)6]2+的中心离子Mg 2+含有空轨道,而配位体H 2O 的O 原子上含有孤电子对,在结合时,Mg 2+提供空轨道,H 2O 的O 原子提供孤电子对,二者形成配位键;在阴离子[(N 5)2(H 2O)4]2-上N 5-与H 2O 的H 原子之间通过氢键结合在一起,形成N…H -O ,故二者之间作用力为氢键;③若原子采用sp 3杂化,形成的物质结构为四面体形;若原子采用sp 2杂化,形成的物质结构为平面形;若原子采用sp 杂化,则形成的为直线型结构。
N 5-为平面正五边形,说明N 原子的杂化类型为sp 2杂化;在N 5-中,每个N 原子的sp 2杂化轨道形成2个σ键,N 原子上还有1个孤电子对及1个垂直于N 原子形成平面的p 轨道,p 轨道间形成大π键,N 5-为4个N 原子得到1个电子形成带有1个单位负电荷的阴离子,所以含有的电子数为5个,其中大π键是由4个原子、5个电子形成,可表示为54π;(3)根据AgN 5的晶胞结构示意图可知,假设以晶胞顶点Ag +为研究对象,在晶胞中与该Ag +距离相等且最近的Ag +在晶胞面心上,通过该顶点Ag +可形成8个晶胞,每个面心上的Ag +被重复使用了2次,所以与Ag +距离相等且最近的Ag +的数目为382⨯=12个;在一个晶胞中含有Ag +的数目为8×18+6×12=4,含有N 5-的数目为1+12×14=4,晶胞体积为V =(2a×10-7)3cm 3,则ρ=()22A/mol 3373A 4178?g /mol N m 8.910V N a 2a 10cm-⨯⨯==⨯⨯ g/cm 3。
【点睛】本题考查了物质结构,涉及电离能的应用、作用力类型的判断、大π的分析、晶胞计算,掌握物质结构知识和晶体密度计算方法是解题关键,要注意电离能变化规律及特殊性,利用均摊方法分析判断晶胞中含有微粒数目,结合密度计算公式解答。
3.硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O,相对分子质量392]晶体又称莫尔盐,易溶易电离但却比一般的亚铁盐稳定,因此广泛应用于制药、电镀以及定量分析。
回答下列与之有关的问题:(1)在莫尔盐所涉及的五种元素中:①S元素在门捷列夫元素周期表中的位置是 ______________ ;②其中处于同主族的两种元素非金属性更强的是:_____________。
(2)为检验莫尔盐是否变质,可用的试剂为_______________。
碘是合成人体甲状腺激素的重要原料,食盐中加KIO3是我国为解决普遍性碘缺乏问题的国家规定,下图是自动电位滴定法测定食盐中碘含量的实验过程:(3)已知“溶解”过程中IO3-的还原产物为碘单质,写出该反应的离子反应方程式:______________________________。
(4)取50. 00 mL样品,用0.005 mol/L酸性K2Cr2O7溶液滴定剩余Fe2+,滴定操作时使用的锥形瓶未干燥,导致结果_____________(填“偏大”“偏小”或“无影响”)【答案】第三周期第ⅥA族 O 硫氰化钾(KSCN)溶液 2IO3-+10Fe2++12H+=I2+10Fe3++6H2O 无影响【解析】【分析】【详解】(1)①S元素在元素周期表中的位置为第三周期第ⅥA族,故答案为:第三周期第ⅥA族;②莫尔盐中处于同主族的两种元素是O和S,其中非金属性更强的是O,故答案为:O;(2)硫酸亚铁铵中含有Fe2+,Fe2+容易被氧化成Fe3+,可加入硫氰化钾(KSCN)溶液检验是否有Fe3+生成,故答案为:硫氰化钾(KSCN)溶液;(3)溶解过程中,IO3-与Fe2+发生氧化还原反应生成I2和Fe3+,根据得失电子守恒、原子守恒和电荷守恒,反应的离子反应方程式为2IO3-+10Fe2++12H+=I2+10Fe3++6H2O,故答案为:2IO3-+10Fe2++12H+=I2+10Fe3++6H2O;(4)滴定操作时使用的锥形瓶未干燥,不会影响Fe2+的物质的量,因此对滴定结果无影响,故答案为:无影响。
4.下表为元素周期表的一部分,表中列出12种元素在周期表中的位置,请回答:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期一①二⑦⑨⑫三②④⑥⑧⑩四③⑤⑪(1)这12种元素中,化学性质最不活泼的元素是______(填元素符号或化学式,下同),得电子能力最强的原子是______,常温下单质为液态的非金属单质是____________。
(2)失电子能力最强的单质与水反应的离子反应方程式是________________,(3)写出⑦⑧⑨与①形成的简单化合物中最稳定的分子式________。
写出⑧⑩两种元素最高价氧化物对应水化物中酸性较弱的化学式________ 。
(4)写出⑨⑩⑪与①形成的化合物中沸点最低的化学式______酸性最强的化学式_______。
(5)写出④的单质置换出⑦的单质的化学反应方程式:__________________。
②和⑥两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
(6)用电子式表示⑤与⑨组成的二元化合物的形成过程________________________。
【答案】Ne F Br2 2K+2H2O=2K++H2↑+2OH- HF H3PO4 HCl HBr 2Mg+CO22MgO +C OH-+Al(OH)3=AlO2-+2H2O【解析】【分析】由元素在周期表中位置,可知①为H、②为Na、③为K、④为Mg、⑤为Ca、⑥为Al、⑦为C、⑧为P、⑨为F、⑩为Cl、⑪为Br、⑫为Ne。
