2021高考化学二轮专题强化训练 专题十三化学能与热能
高三化学二轮复习 化学能与热能精选练习高三全册化学试题

证对市爱幕阳光实验学校专题17化学能与热能1、:3CH4(g) + 2N2(g)3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如以下图所示:以下说法正确的选项是A. n(CH4)/n(N2)越大,CH4的转化率越高B. n(CH4)/n(N2)不变时,假设升温,NH3的体积分数会增大C. b点对的平衡常数比a点的大D. a点对的NH3的体积分数约为26%【答案】B2、以下热化学方程式正确的选项是〔的绝对值均正确〕〔〕A.C2H5OH〔l〕+3O2〔g〕==2CO2〔g〕+3H2O〔g〕;△H=—1367.0 kJ/mol〔燃烧热〕B. NaOH〔aq〕+HCl〔aq〕==NaCl〔aq〕+H2O〔l〕;△H=+5kJ/mol〔热〕C.S〔s〕+O2〔g〕===SO2〔g〕;△H=—26kJ/mol〔反热〕D. 2NO2==O2+2NO;△H=+11kJ/mol〔反热〕【答案】C3、以下反属于吸热反的是( )A.C6H12O6(葡萄糖)+ 6O2 == 6CO2 + 6H2OB.CH3COOH + KOH == CH3COOK + H2OC.所有高温条件下发生的反D.破坏生成物化学键所需能量小于破坏反物化学键的能量【答案】D 4、常温、常压下:N2(g)+3H2(g)2NH3(g) ΔH=-9 kJ/mol 。
在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反到达平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、 mol H2和1 mol NH3,相同条件下到达平衡时放出热量为Q2 kJ。
那么以下关系式正确的选项是〔〕A.2Q2=Q1=9 B.Q l<Q2<92.4 C.Q2<Q1<9 D.Q l=Q2<9【答案】C5、某家利用二氧化铈〔CeO2〕在太阳能作用下将H2O、CO2转变成H2、CO。
2021届高三化学二轮复习——化学能与热能

2021届高三化学二轮复习——化学能与热能一、单选题1.若A N 为阿伏加德罗常数的值。
下列说法不正确...的是( ) A .已知甲烷的燃烧热为1890kJ mol -⋅,则一定条件下甲烷燃烧生成A N 个2H O(l)时释放445kJ 热量B .已知34CH COONH 溶液呈中性,则1341L1.0mol L CH COONH -⋅溶液中有A N 个4NH +C .A N 个32H PO 分子与1molNaOH 完全中和,推测32H PO 为一元酸D .23gNa 与11L0.5mol L -⋅的盐酸反应,转移的电子数为A N2.下列说法正确的是( )A .利用键长及键能的数据可判断:稳定性44CH <SiHB .金属的电子气理论,可以解释金属易导电易腐蚀的原因C .化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因D .活化能越大就代表化学反应需要吸收或放出的能量就越大3.人们发现氧化铁硫杆菌能促使黄铁矿(FeS 2)氧化成硫酸铁和硫酸,氧化铁硫杆菌能把矿物中的硫或硫化物氧化成硫酸,而硫酸和硫酸铁能将某些矿石中的金属元素转化成金属硫酸盐,从而开辟了“细菌冶金”的先河。
氧化铁硫杆菌的活动过程如图所示,其中a 过程发生的反应为4FeS 2+15O 2+2H 2O细菌2Fe 2(SO 4)3+2H 2SO 4。
则下列说法错误的是A .a 过程中释放能量B.细菌在反应a过程中起了催化剂的作用C.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中D.有些细菌可直接把含铅、汞等重金属的矿石溶解,得到重金属离子的溶液4.KI可催化H2O2分解,机理为:①H2O2+I-→H2O+IO-;②H2O2+IO-→H2O+O2↑+I-。
反应过程中能量变化如图所示,下列判断错误的是( )A.KI改变了反应的途径B.KI不能改变总反应的能量变化C.H2O2+Iˉ→H2O+IOˉ是放热反应D.反应物总能量高于生成物总能量5.反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X 的活化能。
高中化学专题训练化学能与热能
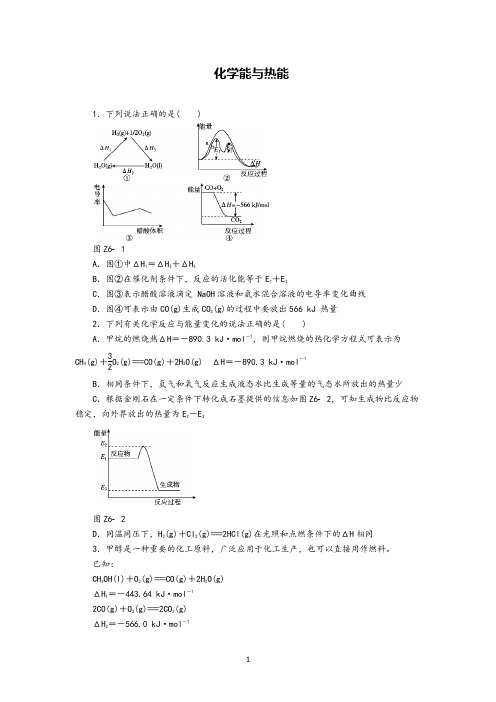
化学能与热能1.下列说法正确的是( )图Z6 1A .图①中ΔH 1=ΔH 2+ΔH 3B .图②在催化剂条件下,反应的活化能等于E 1+E 2C .图③表示醋酸溶液滴定 NaOH 溶液和氨水混合溶液的电导率变化曲线D .图④可表示由CO(g)生成CO 2(g)的过程中要放出566 kJ 热量 2.下列有关化学反应与能量变化的说法正确的是( )A .甲烷的燃烧热ΔH =-890.3 kJ ·mol -1,则甲烷燃烧的热化学方程式可表示为CH 4(g)+32O 2(g)===CO(g)+2H 2O(g) ΔH =-890.3 kJ ·mol -1B .相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少C .根据金刚石在一定条件下转化成石墨提供的信息如图Z62,可知生成物比反应物稳定,向外界放出的热量为E 2-E 3图Z6 2D .同温同压下,H 2(g)+Cl 2(g)===2HCl(g)在光照和点燃条件下的ΔH 相同 3.甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH 3OH(l)+O 2(g)===CO(g)+2H 2O(g) ΔH 1=-443.64 kJ ·mol -12CO(g)+O 2(g)===2CO 2(g) ΔH 2=-566.0 kJ ·mol -1下列说法或热化学方程式正确的是( ) A .CO 的燃烧热为566.0 kJ ·mol -1B .2 mol CO 和1 mol O 2的总能量比2 mol CO 2的总能量低C .完全燃烧20 g 甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJD .2CH 3OH(l)+3O 2(g)===2CO 2(g)+4H 2O(g) ΔH =-1 453.28 kJ ·mol -14.反应A +B →C ΔH<0,分两步进行①A +B →X ΔH>0,②X →C ΔH<0。
2021届高考化学二轮专项练习卷:化学能与热能【有答案】

化学能与热能1.下列关于反应热的说法正确的是(D)A.在稀溶液中所有酸和碱反应的中和热数值都相等B.已知C(s)+O2(g)===CO(g)ΔH=-110.5 kJ/mol,说明碳的燃烧热为110.5 kJ/mol C.需要加热才能发生的反应一定是吸热反应D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关[解析]A.在稀溶液中弱酸或弱碱发生中和反应时,弱酸或弱碱电离吸热,错误,不选A;B.燃烧热是指1摩尔可燃物完全燃烧生成稳定的氧化物时放出的热量,反应中产物为一氧化碳,错误,不选B;C.某些放热反应也需要加热条件才能发生,需要加热的不一定是吸热反应,错误,不选C;D.物质能量一定,对于确定的反应,反应的反应热只与体系始态和终态有关与变化途径无关,正确,选D。
2.下列有关热化学反应的描述中正确的是(B)A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/molB.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ/molC.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量[解析]A.酸碱发生中和反应产生1 mol水时放出的热量,所以H2SO4和Ca(OH)反应的中和热与HCl和NaOH反应的中和热相同,都是ΔH=-57.3 kJ/mol,A错误;B.CO(g)的燃烧热是283.0 kJ/mol,表示 1 mol CO完全燃烧产生CO2放出热量是283.0 kJ,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ/mol,B正确;C.1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,C错误;D.由于醋酸是弱酸,电离吸收热量,所以稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ,D错误,答案选B。
2021届高三化学二轮复习——化学能与热能学案及分类训练

2021届高三化学二轮复习——化学能与热能学案及分类训练核心知识梳理1.理解化学反应热效应的两种角度(1)从微观的角度说,是旧化学键断裂吸收的能量与新化学键形成放出的能量的差值,如下图所示:a表示旧化学键断裂吸收的能量;b表示新化学键形成放出的能量;c表示反应热。
(2)从宏观的角度说,是反应物的总能量与生成物的总能量的差值,在上图中:a表示活化能;b表示活化分子结合成生成物所释放的能量;c表示反应热。
2.反应热的量化参数3.燃烧热、中和热的比较燃烧热中和热相同点能量变化放热ΔH及其单位ΔH<0,单位均为kJ·mol-1不同点反应物的量 1 mol不一定为1 mol生成物的量不确定生成液态水的物质的量为1 mol反应热的含义25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量在稀溶液里,酸与碱发生中和反应生成1 mol H2O时所放出的热量表示方法燃烧热ΔH=-a kJ·mol-1(a>0)强酸与强碱反应的中和热ΔH=-57.3 kJ·mol-14.ΔH计算的几种方法(1)从宏观角度分析计算ΔH=H1(生成物的总能量)-H2(反应物的总能量)(2)从微观角度分析计算ΔH=E1(反应物的键能总和)-E2(生成物的键能总和)(3)从活化能角度分析计算ΔH=E1(正反应的活化能)-E2(逆反应的活化能)(4)根据盖斯定律计算计算步骤(5)根据反应过程中的热量变化Q计算ΔH=+(-)Qn kJ·mol-1分类训练角度一反应热的基本概念、能量图像1我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如图。
高三化学二轮复习热点题型和提分秘籍同步专题.《化学能与热能》.doc

届高三化学二轮复习热点题型和提分秘籍同步专题.《化学能与热能》.doc————————————————————————————————作者:————————————————————————————————日期:【高频考点解读】1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义。
4.了解能源是人类生存和社会发展的重要基础,了解化学在解决能源危机中的重要作用。
5.了解焓变与反应热的含义。
了解ΔH =H (反应产物)—H (反应物)表达的含义。
6.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
【热点题型】题型一 依据图形,理清活化能与焓变的关系1.某反应过程中体系的能量变化如图所示,下列说法错误的是( )A .反应过程可表示为A +BC 反应物―→[A…B…C]过渡态―→AB +C 生成物 B .E 1为反应物的总能量与过渡态的能量差,称为正反应的活化能 C .正反应的热效应ΔH =E 1-E 2<0,所以正反应为放热反应D .此图中逆反应的热效应ΔH =E 1-E 2<0,所以逆反应为放热反应 答案 D【提分秘籍】正确理解活化能与反应热的关系1.催化剂能降低反应所需活化能,但不影响焓变的大小。
2.在无催化剂的情况,E1为正反应的活化能,E2为逆反应的活化能,即E1=E2+|ΔH|。
【举一反三】某反应的ΔH=+100kJ·mol-1,下列有关该反应的叙述正确的是()A.正反应活化能小于100kJ·mol-1B.逆反应活化能一定小于100kJ·mol-1C.正反应活化能不小于100kJ·mol-1D.正反应活化能比逆反应活化能小100kJ·mol-1答案 C解析某反应的ΔH=+100kJ·mol-1,说明该反应的正反应为吸热反应,且正反应的活化能比逆反应的活化能大100kJ·mol-1,正反应的活化能应大于100kJ·mol-1,无法确定逆反应的活化能大小。
高考化学二轮复习专题突破练习:化学能与热能 (解析版)

1 / 26 化学能与热能1.(2020·河北衡水中学高三月考)肼(H 2N —NH 2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol 化学键所需的能量(kJ):N ≡N 键为942、O =O 键为500、N —N 键为154,则断裂1 mol N —H 键所需的能量(kJ)是( )A .194B .391C .516D .658【答案】B 【解析】根据图中内容,可以看出N 2H 4(g)+O 2(g)=2N(g)+4H(g)+2O(g),△H 3=2752 kJ/mol -534 kJ/mol=2218 kJ/mol ,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1 mol N ―H 键所需的能量为X ,旧键断裂吸收的能量:154+4X+500=2218,解得X=391,故选项B 正确。
2.(2020·甘肃省岷县第二中学月考)已知:CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l) ΔH 1=-890.3 kJ ·mol -1;H 2(g)+12O 2(g)=H 2O(l) ΔH 2=-285.8 kJ ·mol -1。
CO 2与H 2反应生成甲烷与液态水的热化学方程式为CO 2(g)+4H 2(g)=CH 4(g)+2H 2O(l) ΔH 3,则ΔH 3=()A.-252.9 kJ·mol-1B.+252.9 kJ·mol-1C.-604.5 kJ·mol-1D.+604.5 kJ·mol-1【答案】A【解析】已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1;O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1②H2(g)+12根据盖斯定律,由4×②-①可得所求热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(l),则ΔH3=4ΔH2-ΔH1=-252.9 kJ·mol-1。
2021届高三化学第二轮复习-化学反应原理:化学能与热能专题复习

2021届高三化学第二轮复习-化学反应原理:化学能与热能专题复习一、单选题1.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是A.诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能B.诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定可通过物理方法得到C.诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应D.诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象2.下列放热反应的说法中正确的是()A.只要是释放热量的变化就是放热反应B.只要是释放热量的化学变化就是放热反应C.不需要加热就能反应的化学反应就是放热反应D.反应物的总能量小于生成物的总能量的化学反应就是放热反应3.下列热化学方程式中的反应热下划线处表示燃烧热的是()A.NH3(g)+34O2(g)=12N2(g)+32H2O(g);ΔH= -a kJ·mol-1B.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);ΔH= -b kJ·mol-1 C.C(s)+H2O(g)=CO(g)+H2(g);ΔH= -c kJ·mol-1D.CH3CH2OH(l)+12O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-14.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ/mol。
向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是()A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH3<ΔH2C.ΔH1<ΔH2<ΔH3D.ΔH1>ΔH3>ΔH25.关于化学反应与能量的说法中错误..的是A.中和反应是放出能量的B.化学反应中有物质变化也有能量变化C.如图所示的反应为放热反应D.化学键断裂吸收能量,化学键生成放出能量6.我国科学家研制出的新型高效光催化剂能利用太阳能分解水制取氢气,主要过程如图所示,下列说法正确的是()A.与电解相比,光解水过程中消耗的能量较低B.过程I、Ⅱ都要吸收能量C.过程Ⅱ既有极性键形成,又有非极性键形成D.利用膜分离技术分离氢气和氧气具有良好的应用前景7.已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为:A.吸收183kJ B.吸收366kJ C.放出366kJ D.放出183kJ8.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题十三化学能与热能高考帮·备考方向导航考点1 化学反应中能量变化的有关概念1.[2020天津,10,3分]理论研究表明,在101 kPa和298 K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是( )A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·mol-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热2.[2018北京,7,6分]我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如图。
下列说法不正确的是( )A.生成CH3COOH总反应的原子利用率为100%B.CH4→CH3COOH过程中,有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率3.[2018海南,12,4分][双选]炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。
活化过程的能量变化模拟计算结果如图所示。
活化氧可以快速氧化二氧化硫。
下列说法正确的是( )A.每活化一个氧分子吸收0.29 eV的能量B.水可使氧分子活化反应的活化能降低0.42 eVC.氧分子的活化是O—O的断裂与C—O键的生成过程D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂考点2 热化学方程式4.[2021四川石室中学开学考试]H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。
下列说法错误是( )A.有MnO2条件下的变化曲线是bB.该反应能量变化类型与氢气燃烧反应的相同C.加MnO2后,正反应速率增大,逆反应速率减小O2(g) ΔH=(E1-E2) kJ·mol-1D.该反应的热化学方程式为H 2O2(l)H2O(l)+125.[2017全国卷Ⅰ,28(2),5分]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 、 ,制得等量H 2所需能量较少的是 。
考点3 盖斯定律的应用及反应热的计算和大小比较 6.[2020浙江7月选考,22,2分]关于下列ΔH 的判断正确的是( )C O 32−(aq)+H +(aq)HC O 3-(aq) ΔH 1C O 32−(aq)+H 2O(l)HC O 3-(aq)+OH -(aq) ΔH 2 OH -(aq)+H +(aq)H 2O(l) ΔH 3OH -(aq)+CH 3COOH(aq)CH 3COO -(aq)+H 2O(l) ΔH 4A.ΔH 1<0 ΔH 2<0B.ΔH 1<ΔH 2C.ΔH 3<0 ΔH 4>0D.ΔH 3>ΔH 47.[2019浙江4月选考,23,2分]MgCO 3和CaCO 3的能量关系如图所示(M=Ca 、Mg):已知:离子电荷相同时,半径越小,离子键越强。
下列说法不正确的是 ( )A.ΔH 1(MgCO 3)>ΔH 1(CaCO 3)>0B.ΔH 2(MgCO 3)=ΔH 2(CaCO 3)>0C.ΔH 1(CaCO 3)-ΔH 1(MgCO 3)=ΔH 3(CaO)-ΔH 3(MgO)D.对于MgCO 3和CaCO 3,ΔH 1+ΔH 2>ΔH 3 8.(1)[2019全国卷Ⅲ,28(2)改编]已知: CuCl 2(s)CuCl(s)+12Cl 2(g) ΔH 1=83 kJ ·mol -1CuCl(s)+12O 2(g)CuO(s)+12Cl 2(g) ΔH 2=-20 kJ ·mol -1CuO(s)+2HCl(g)CuCl 2(s)+H 2O(g) ΔH 3=-121 kJ ·mol -1 则4HCl(g)+O 2(g)2Cl 2(g)+2H 2O(g)的ΔH = kJ ·mol -1。
(2)[2017全国卷Ⅲ,28(3),2分]已知:H2(g)+2O2(g)H3AsO4(s) ΔH1As(s)+32O2(g)H2O(l) ΔH2H 2(g)+122As(s)+5O2(g)As2O5(s) ΔH32则反应As 2O5(s)+3H2O(l)2H3AsO4(s)的ΔH= 。
拓展变式1.“一碳化工”是重要的化学工业,部分原理如下:O2(g)CO(g) ΔH1反应①C(s)+12反应②C(s)+H 2O(g)CO(g)+H2(g) ΔH2=+130 kJ·mol-1反应③CO(g)+2H 2(g)CH3OH(g) ΔH3=-90.1 kJ·mol-1反应④2CH 3OH(g)CH3OCH3(g)+H2O(g) ΔH4反应④的能量变化如图所示:反应⑤3CH 3OH(g)CH3CH CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1已知:H2的燃烧热为285.8 kJ·mol-1,H2O的汽化热(在一定压强下,1 mol 物质在一定温度下蒸发所需要的热量)为44 kJ·mol-1。
回答下列问题:(1)反应①的ΔH1= kJ·mol-1。
(2)反应③中正反应的活化能(填“大于”“小于”或“等于”)逆反应的活化能。
(3)反应④中代表使用催化剂的曲线是(填“Ⅰ”或“Ⅱ”),曲线Ⅰ的峰中出现小波谷的原因是,反应④的ΔH4= kJ·mol-1。
(4)用适量的CO与H 2反应,每生成420 g CH3CH CH2(g)时, (填“吸收”或“放出”) kJ的热量。
2.(1)[2016天津,7(4)改编]Si与Cl两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ。
已知该化合物的熔、沸点分别为-69 ℃和58 ℃。
写出该反应的热化学方程式: 。
(2)[2015安徽, 27(4),3分]NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。
在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是。
3.[高考组合]请回答下列问题:(1)[2015新课标全国卷Ⅰ,28(3),2分]已知反应2HI(g)H 2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ 的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为kJ。
(2)[2015新课标全国卷Ⅱ,27(1),4分]甲醇既是重要的化工原料,又可作为燃料。
利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H 2(g)CH3OH(g) ΔH1②CO 2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2③CO 2(g)+H2(g)CO(g)+H2O(g) ΔH3已知反应①中相关的化学键键能数据如下:化学键H—H C—O H—O C—HE/(kJ·mo436 343 1 076 465 413l-1)由此计算ΔH1= kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=kJ·mol-1。
4.[2020贵州贵阳摸底考试]2 mol金属钠和1 mol 氯气反应的能量关系如图所示,下列说法不正确的是( )A.相同条件下,K(s)的(ΔH'2+ΔH'3)<Na(s)的(ΔH2+ΔH3)B.ΔH4的数值和Cl—Cl共价键的键能的数值相等C.ΔH5<0,在相同条件下,2Br(g)的ΔH'5>ΔH5D.ΔH7<0,且该过程形成了分子间作用力5.[2018浙江下半年选考,21,2分]已知:H 2O(g)H2O(l) ΔH1C 6H12O6(g)C6H12O6(s) ΔH2C 6H12O6(s)+6O2(g)6H2O(g)+6CO2(g) ΔH3C 6H12O6(g)+6O2(g)6H2O(l)+6CO2(g) ΔH4下列说法正确的是( )A.ΔH1<0,ΔH2<0,ΔH3<ΔH4B.6ΔH1+ΔH2+ΔH3-ΔH4=0C.-6ΔH1+ΔH2+ΔH3-ΔH4=0D.-6ΔH1+ΔH2-ΔH3+ΔH4=0答案专题十三化学能与热能1.D HNC的能量比HCN高,能量越低越稳定,则稳定性较好的是HCN,A项正确;该异构化反应的ΔH=+59.3 kJ·mol-1,为吸热反应,则正反应的活化能大于逆反应的活化能,B、C 项正确;使用催化剂能改变反应的历程,但是不影响反应的反应热,D项错误。
2.D CO2和CH4制备CH3COOH的化学方程式为CO2+CH4CH3COOH,反应中没有副产物生成,所以总反应的原子利用率为100%,A项正确;CH4分子中含有4个C—H键,而CH3COOH 分子中含有3个C—H键,显然CH 4CH3COOH过程中必有C—H键发生断裂,B项正确;观察反应的示意图可知,①→②过程中放出能量,且在此过程中形成了新化学键,即乙酸分子中的C—C键,C项正确;催化剂能改变化学反应速率,而不影响化学平衡,不能提高反应物的平衡转化率,D项错误。
3.CD 根据题图可知,每活化一个氧分子放出0.29 eV能量,A项错误;水可使氧分子活化反应的活化能降低0.18 eV,B项错误;根据题图可知,氧分子的活化是O—O键的断裂和C—O键的生成过程,C项正确;大气中二氧化硫转化为三氧化硫,炭黑颗粒为该反应的催化剂,D项正确。
4.C 使用催化剂可降低反应的活化能,结合题图知,b曲线表示使用了催化剂,A项正确;该反应的反应物总能量比生成物总能量高,属于放热反应,氢气的燃烧反应也是放热反应,B项正确;催化剂对正反应速率和逆反应速率均能起到增大的作用,C项错误;由能量O2(g) ΔH=(E1-E2)变化曲线可知,该反应的热化学方程式为H 2O2(l)H2O(l)+12kJ·mol-1,D项正确。
O2(g) ΔH=286 kJ·mol-1(2分) H2S(g)H2(g)+S(s) ΔH=205.H 2O(l)H2(g)+12kJ·mol-1(2分) 系统(Ⅱ)(1分)O2(g) ΔH1=327 【解析】整理热化学方程式如下:①H 2SO4(aq)SO2(g)+H2O(l)+12kJ·mol-1;②SO 2(g)+I2(s)+2H2O(l)2HI(aq)+H2SO4(aq) ΔH2=-151 kJ·mol-1;③2HI(aq)H 2(g)+I2(s) ΔH3=110 kJ·mol-1;④H2S(g)+H2SO4(aq)S(s)+SO2(g)+2H2O(l) ΔH 4=61 kJ·mol-1。
