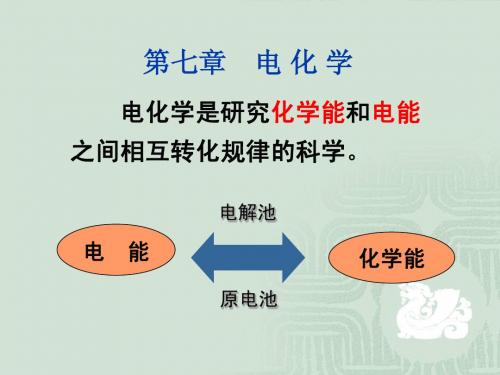
第八章电化学
第八章 电化学腐蚀与防护

资源/环 境负荷
腐蚀破坏
材料的源泉和归宿 —资源/环境
腐蚀的钢管
严重的锅炉管腐蚀
F-22A锈蚀问题是发动机 俄罗斯米格-29战机曾发生 舱盖漏雨所致 空中爆炸 解决腐蚀问题的办法 是更换机身上四块最大的 铝合金口盖,将用钛合金 口盖来代替,每一个口盖 更换成本大约为5万美元。
我护航舰队人员 设法防止舰载机 遭盐分腐蚀
常温下酸性溶液中铁的腐蚀其他物质为去极化剂如酸性溶液中fefe酸洗过程锈层溶于酸形成一定量的fe可作为去极化剂使钢铁腐蚀若酸液面上有空气fe成为去极化剂形成循环fe起着氧的输送的作用有fe存在时腐蚀速度增加均匀腐蚀全面腐蚀阴阳极共扼反应在金属相同位臵同时发生或交替发生阴阳极没有时间和空间上的区别整个表面用ecorr表征在此电位下表面均匀溶解腐蚀
• 电偶腐蚀在化工/日常生活中很普遍现象
• 电偶腐蚀 — 金属电极构成宏观腐蚀电池
• 电位较低的金属腐蚀增大,电位较高的金属腐 蚀速度减小
M1 M1n+ + ne
2H+ + 2e H2 M2 M2 n+ + ne 2H+ + 2e H2
异种金属接触构成电偶腐蚀
5.脱成分腐蚀
合金中某特定成分由于腐蚀溶解而减少, 称为脱成分腐蚀
表面膜
磨蚀
水流
磨蚀
高速水流
磨蚀现象和机理
局部腐蚀形式多样性 — 电偶腐蚀、缝隙腐蚀、小 孔腐蚀(点腐蚀)、晶间腐蚀、应力腐蚀开裂等。
局部腐蚀普遍性 —工业中局部腐蚀很常见(全 面腐蚀10%),局部腐蚀(化工)80%,因 此对局部腐蚀的研究和防护尤为重要。
局部腐蚀危害性 — 腐蚀集中在个别位臵急剧发 生、腐蚀破坏快速、隐蔽性强、难以预计、控制 难度大、危害大,易突发灾难事故
第八章 电化学分离法

同理,如发生阳极反应,由于金属的溶解 将使阳极表面的金属离子浓度比主体溶液的浓 度大,使阳极电势变得更正一些。由于这种浓 度差别所引起的极化,称为浓差极化。与之相 应的超电势称为浓差超电势。其数值大小由浓 差大小决定,而浓差大小又与搅拌情况、电泳 密度等因素有关。由于浓差极化的存在,使一 些干扰离子也可能在电极上反应,导致电解分 离不完全,影响了电解分析的准确性。要减小 浓差极化,可以采用增大电极面积、减小电流 密度、提高溶液温度以及强化机械搅拌等方法。
Hale Waihona Puke 1 2已知[O2]同大气中氧气的分压相等,水的 活度为1,[H+]=1.0mol/l,于是有
E阳 1.229 0.0296 lg( PO2 [ H ] ) 1.229 0.0296lg(0 .21 2 12 ) 1.219(V)
2 1 2 1
在这些条件下,电解产物组成的原电池的自 发反应是 1 2
RT EE ln M n nF
式中,n为金属离子的价数;αMn+为离子 Mn+的活度;EӨ为该金属电对的标准电极电势; R为摩尔气体常数;T为热力学温度;F为法拉 第常数。
对于高度稀释的溶液,例如无载体的放射性核 素溶液,能斯特方程式是否适用是个问题。通常, 检验能斯特方程式适用性的方法是直接测量不同 浓度的离子溶液中的电极电势。但当被沉积的元 素量非常少时,由于离子的沉积还不足以在电极 上形成单原子层,从而使得实际的电极电势与根 据能斯特公式计算出来的理论电极电势常常发生 偏离,并且显得缺乏规律性,曾有不少学者试图 对能斯特公式进行各种校正和解释,但至今仍无 很满意的结果。当然,也有个别元素,即使其离 子浓度很低,能斯特公式仍是适用的。例如,浓 度在1.44×10-7~5×10-4mol/l之间的放射性Po在 Au电极的沉积。
第八章 电化学
说明
n 电解 为通过电解池电荷的物质的量,可 由通过电解池的总电量求得。
n电极反应根据实际电极反应而得,其值等 于n电解;但对于不参加反应的惰性电极, 在阳极区要特别注意。 希托夫法原理简单,但所得结果不够准 确。
(2)界面移动法
原理:测定溶液界 面在迁移管中移动 的距离来测定离子 的迁移数。 条件:使用的两种 电解质溶液具有一 种共同的离子。有 明显分界面。
在无限稀释溶液中,每种离子独立移动,不受 其它离子影响,电解质的无限稀释摩尔电导率可 认为是两种离子无限稀释摩尔电导率之和。
M+A- = +Mz+ + - Az则:
m
m,
m,
弱电解质无限稀释摩尔电导率的求法:根 据离子独立运动定律,利用强电解质无限 稀释摩尔电导率来计算。
t+ + t- = 1
(2)影响离子迁移数的因素 影响离子迁移数的因素:温度、溶 液浓度、离子本性、溶剂性质。 温度越高,阴、阳离子的迁移数趋 于相等。
3.离子的电迁移率(离子淌度)
vB uB dE / dl dl u v dE
几点说明:
dl u v dE
(1)uB 与温度、浓度、离子本性、溶剂性 质有关。
阳极区 t+ = n+,迁出/n电解, t- = n-,迁入/n电解
阳离子:n终态=n起始+n电极反应-n迁出 n迁出=n起始+n电极反应-n终态 阴离子:n终态=n起始-n电极反应+n迁入 n迁入=n终态-n起始+n电极反应
阴极区 t- = n-,迁出/n电解, t+ = n+,迁入/n电解
电化学 第8章 金属电极的阳极过程

图8.1 金属的阴阳极极化曲线第8章 金属阳极过程8.1 金属阳极溶解8.1.1 概述化学电源、电解冶炼、电镀工业等都广泛地使用可溶性金属阳极,它往往要求金属阳极能够正常的溶解。
金属以离子形式进入溶液的阳极过程是由许多步骤组成的(阴极过程逆过程)。
从位置因素考虑金属的边角处先溶解。
包括金属晶格的破坏、电子转移、金属离子水化(或络合)等,并由对流、电迁移、扩散等方式使它们离开电极表面,用图表示如下:一般金属离子的水解过程速度很快,不会成为控步,金属晶格的破坏、电子转移步骤往往是控步。
以电化学步骤为例:()根据“微观可逆”原理,由于多价金属离子还原过程中往往是第一个电子还原步骤最慢,因此在阳极溶液过程中是失去最后一个电子的步骤最慢,即为控制步骤。
(为表观传递系数)显然, 即阳极的表观传递系数较阴极大。
对应的极化曲线如右图。
8.1.2金属阳极溶解的影响因素1、 金属本性的影响。
金属阳极溶解的条件为: 可能性,速度视大小而定。
(典型:氢氧反应生成水,热力学上没问题,但必须提供一定能量后反应才会发生)即只要电极位高于金属的平衡电位与过电位之和即可发生电极的溶解。
:热力学参数,表示反应的可能性。
越小,反应越容易进行。
一定时,大,则 小,小,则大。
注:这里高、中、低与氢过电位金属无关。
(上述过电位是指在一定电流密度下的相对大小,而氢过电位是指时的过电位)2、 溶液组成的影响即浓度C 、络离子、表面活性剂、阴离子(卤素等)的影响。
这里主要介绍阴离子的影响。
1 阴离子对阳极反应的影响比对阴极反应的影响大溶液中阴离子浓度记为,一般为卤素或等。
此时(单电子为例)=1、2、3之中的某一正数。
不仅影响电位,还可以以一定的反应级数参加反应。
这说明与金属表面上的金属形成了表面络和物。
2 并不是所有的阴离子都能加速阳极过程。
如果生成的表面络合物可溶,则使金属上的键变弱,容易使金属离子进入溶液,从而加速电极过程;而有些阴离子则无此能力,在表面上吸附后阻化了反应的进行。
第八章电化学分析法

二、电化学分析法的特点
(1)灵敏度、准确度高,选择性好 被测物质的最低量可以达到10-12mol/L数量级。 (2)电化学仪器装置较为简单,操作方便 直接得到电信号,易传递,尤其适合于化工生产中的自动控 制和在线分析。 (3)应用广泛 传统电化学:无机离子分析H+、F-、Cl-、K+; 有机电化学分析:蛋白质、氨基酸 药物分析:磺胺类药物含量分析 活体分析:肌苷含量、酶活性分析
1、直接电位法:电极电位与溶液中电活性物质活度有关,通 过测量溶液的电动势,根据能斯特方程计算被测物质的含量 如饮用水中氟离子含量测定 研制各种高灵敏度、高选择性的电极是电位分析法最活跃的 研究领域之一。目前应用最多、选择性最好的是膜电极
2、理论基础:能斯特方程(电极电位与溶液中待测离子间 的定量关系式)。
对于氧化还原体系: Ox + ne- = Red
O Ox/RedR nFTlnaaROedx
对于金属电极(还原态为金属,活度定为1):
M On/MR nF TlnaMn
二、离子选择性电极种类、结构与原理 1、种类
离子选择性电极(又称膜电极)。
1976年IUPAC基于膜的特征,推荐将其分为以下几类: 重点使用 原电极(primary electrodes)
电池工作时,电流必须在电池内部和外 部流过,才能构成回路。
溶液中的电流:正、负离子的移动。
1、原电池
负极:发生氧 化反应的电极。
正极:发生还 原反应的电极。
电极电位较高 的为正极
电极电位较低 的为负极
电池总反应是 两个电极反应 的加合
2、电解电池
阳极:与直流 电源正极相连 的一段,发生 氧化反应。
电化学分析的学习参考资料
高中化学 第八章电解质溶液及电化学系统

第八章电解质溶液及电化学系统主要内容1.电解质溶液及电化学系统研究的内容和方法2.电解质溶液的热力学性质3.电解质溶液的导电性质4.电化学系统的热力学重点1.重点掌握了解电解质溶液的导电机理,理解离子迁移数、表征电解质溶液导电能力的的物理量(电导率、摩尔电导率)、电解质活度和离子平均活度系数的概念;2.重点掌握离子氛的概念和德拜—休克尔极限定律;3.重点掌握理解原电池电动势与热力学函数的关系;掌握能斯特方程及其计算;难点1.电解质溶液的导电机理,理解离子迁移数、表征电解质溶液导电能力的的物理量(电导率、摩尔电导率)、电解质活度和离子平均活度系数的概念;2.离子氛的概念和德拜—休克尔极限定律;3.原电池电动势与热力学函数的关系;能斯特方程及其计算教学方式1. 采用CAI课件与黑板讲授相结合的教学方式。
2. 合理运用问题教学或项目教学的教学方法。
教学过程第8.1节电解质溶液及电化学系统研究的内容和方法一、电解质溶液及电化学系统研究的内容1、电解质溶液①电解质溶液的热力学性质电解质由于存在电离,正负离子之间的静电作用力使其偏离理想稀薄溶液所遵从的热力学规律,所以引入了离子平均活度和离子平均活度因子等概念。
思考:理想稀薄溶液所遵从的热力学规律是什么?②电解质溶液的导电性质高中阶段就学过电解质溶液的导电性质,为了表征电解质溶液的导电能力,则引入了电导、电导率、摩尔电导率等概念。
2、电化学系统在两相或数相间存在电势差的系统称为电化学系统。
①电化学系统的热力学性质电化学系统的热力学主要研究电化学系统中没有电流通过时系统的性质,即有关电化学平衡的规律。
②电化学系统的动力学电化学系统的动力学主要研究电化学系统中有电流通过时系统的性质,即有关电化学反应速率的规律。
二、电化学研究的对象第8.2节电解质溶液的热力学性质一、电解质的类型1、电解质的分类电解质的定义:解离:电解质在溶剂中解离成正、负离子的现象。
强电解质:弱电解质:强弱电解质的分类除与电解质本身性质有关外,还取决于溶剂的性质。
物理化学 电化学

能导电的物质称为导电体,通常分为两类: 第一类导体又称电子导体,如金属、石墨等 第一类导体的特点是: A. 自由电子作定向移动而导电 B. 导电过程中导体本身不发生变化 C. 温度升高,电阻也升高
D. 导电总量全部由电子承担
第二类导体又称离子导体,如电解质溶液、熔 融电解质等 第二类导体的特点是: A. 正、负离子作反向移动而导电 B. 导电过程中有化学反应发生 C. 温度升高,电阻下降
阳极上发生氧化作用
2 H 2 O l O 2 (g ) 4 H 4 e
-
电源 +
-
Pt
e
e
+
-
阴极上发生还原作用
2H
Pt
aq 2 e H 2 (g )
N a 2S O 4
电解池
电极上的反应次序由 离子的活泼性决定
在电解池中, 都用铜作电极
阳极上发生氧化作用
发生氧化作用的极称为阳极。 在原电池中,阳极是负极;在 电解池中,阳极是正极。 发生还原作用的极称为阴极。
阴极:
在原电池中,阴极是正极;在 (Cathode) 电解池中,阴极是负极。
在原电池中
负载电阻
阳离子迁向阴极
正 极 -
负 极
在阴极上发生还原的是
Cu
2
Zn
e
-
Cu
2+
e
aq 2e
l A
1
面 积 =A
单位长方体
m
1
电导率
电导率也就是电阻率的倒数:
R k 1
(a )
电导率的定义
电导率与电解质性质、浓度、溶液浓度有关。
8章电位法和永停滴定法

Ag+Cl-
= φΘAg+/Ag+ 0.059lgKsp,AgCl/aCl= φΘAg+/Ag+ 0.059lgKsp,AgCl-0.059lgaClφ= φΘAgCl/Ag- 0.059lgaCl或φ= φΘ’
AgCl/Ag
- 0.059lgcCl-
(三)离子浓度的测量方法 1、电池电动势与离子浓度的关系
(-)离子选择电极|试液‖KCl(饱和),Hg2Cl2(s)|Hg(+)
电池电动势为:E = φ甘 – φ离 E =φ甘–[K’±(2.303RT/nF)lgci] E = K
±(2.303RT/nF)lgci
注:总离子强度调节剂(TISAB):将惰性电解质、缓冲 溶液和掩蔽剂的混合物溶液称为总离子强度调节剂(TISAB)。
氨气敏电极、 CO2、 NO2、SO2、O2、H2S、HCN、HF等气 敏电极。
φ= K-(RT/F)lnaH+=K-(RT/F)lnpNH3
3、酶电极 是利用酶在生化反应中高选择性的催化作用使生物大 分子迅速分解或氧化,催化反应的产物可由相应的离子选择 电极检测.因此酶电极由原电极和生物膜制成的复膜电极. 生物膜主要由具有分子识别能力的生物活性物质如酶、 微生物、生物组织、核酸、抗原和抗体组成。
第八章 电位法和永停滴定法 第 一 节 电化学分析法概述 根据所测的电化学参数不同可分四类:
电位分析法:
直接电位法、电位滴定法。
电解分析法:电重量法、库仑法、库仑滴定法
电导分析法:直接电导法 电导滴定法
伏安法:极谱法、溶出伏安法、电流滴定法
第 二 节 电位法的基本原理 一、化学电池 由二个电极、电解质溶液和外电路组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学(第2版)
熟练掌握pH计的操作技术和用直接电位法测定 溶液的pH;熟练掌握永停滴定仪的操作技术和确 定滴定终点的方法;学会用电位滴定法确定滴定 终点。
4
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2பைடு நூலகம்)
第一节 概 述
电化学分析法 :根据物质在溶液中的电化学性质及其 变化来进行分析的方法。
22
全国高职高专药品类专业卫生部“十一五”规划教材
分析化学(第2版)
第二节 直接电位法
(3)不对称电位:从理论上讲,玻璃膜内、外两侧
溶液的H+浓度相等时,膜电位应为零,但实际上并
不为零,此电位差称为不对称电位。使用前将玻璃
电极放入水或酸性溶液中充分浸泡(一般浸泡24小
时左右),可以使不对称电位值降至最低,并趋于
28
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
两次测定法方法为:先测量已知pHS的标准溶液的 电池电动势为ES,然后再测量未知pHX的待测液的 电池电动势为EX 。在25℃时,电池电动势与pH之 间的关系满足下式:
EX = K + 0.059pHX (1)
Fe3+ + e = Fe2+
= + 0.059lg cFe3
cFe 2
15
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2版)
2.离子选择性电极 离子选择性电极(ISE)也称膜电极,是20世纪
60年代发展起来的一类新型电化学传感器,是一 种利用选择性的电极膜对溶液中的待测离子产生 选择性的响应,而指示待测离子浓度的变化的电 极。其产生电位的机制是基于离子的交换与扩散。
第二节 直接电位法
分析化学(第2版)
存在于外膜相界电位与内膜相界电位之间的电
位差,则称为玻璃电极的膜电位( 膜 )。 膜 = K+ 0.059lg [H ]外 = K- 0.059pH外
玻璃电极的电位是由膜电位与内参比电极的电 位决定,在25℃时玻璃电极的电位可表示为:
GE = K′+ 0.059lg [H ]外 = K′- 0.059pH外
6
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
(一)甘汞电极
分析化学(第2版)
甘汞电极是由金属汞、甘汞(Hg2Cl2)和 KCl溶液组成。如右图
电极反应式:Hg2Cl2 + 2e = 2Hg + 2Cl-
7
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2版)
24
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
课堂互动
您能回答玻璃电极在使用前应在 水中浸泡24小时以上的原因吗?
25
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
(二)测定原理和方法 电位法测定溶液pH,常以玻璃电极为指示电极,
21
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
3.pH玻璃电极的性能
(1)电极斜率:当溶液中的pH值改变一个单位时, 引起玻璃电极电位的变化值称为电极斜率。
(2)碱差和酸差:普通玻璃电极在pH大于9的溶液 中测定时,对Na+也有响应,因此测得的浓度高于 真实值,这种误差称为碱差。若用pH玻璃电极测定 pH小于1的酸性溶液时,pH读数大于真实值,即称 酸差。
25℃(298.15K)时,其电极电位表示为:
Hg2Cl 2 /Hg
Hg2Cl2/Hg
0.059
lg
c Cl
可以看出,甘汞电极的电位随氯离子浓度的变 化而变化,当氯离子浓度一定时,则甘汞电极的 电位就为一定值。
8
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2版)
恒定。
(4)温度:一般玻璃电极只能在0~50℃范围内使 用 ,并且在测定标准溶液和待测溶液的pH时,温度 必须相同。
23
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
知识拓展
复合pH电极
将指示电极和参比电极组装在一起就构成了复合电极。目前 使用的复合pH电极,通常是由玻璃电极与银-氯化银电极或玻璃 电极与甘汞电极组合而成。它是由两个同心玻璃管构成,内管为 常规的玻璃电极,外管为一参比电极:电极外套将玻璃电极和参 比电极包裹在一起,并把敏感的玻璃泡固定在外套的保护栅内, 参比电极的补充液由外套上端的小孔加入。把复合pH电极插入试 样溶液中,就组成了一个完整的电池系统。复合pH电极的优点在 于使用方便,并且测定值较稳定。
pH玻璃电极的构造如图8-3所示。它的 主要部分是电极下端接的玻璃球形薄 膜,球膜是有特殊成分的玻璃制成, 膜的厚度约为0.05~0.1mm,膜内盛有 一定浓度的KCl的pH缓冲溶液,作为 内参比液,溶液中插入一支银-氯化银 电极作为内参比电极。
19
全国高职高专药品类专业卫生部“十一五”规划教材
ES = K + 0.059pHS (2)
两式相减并整理得:
pHX
pHS
ES EX 0.059
29
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
课堂互动 请您阐述用电位法测定溶液的pH 采用两次测定法的原因?
30
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
二、电位法测定其他离子浓度 测定其他离子浓度,目前多采用离子选择性电极
(ISE)作指示电极。 (一)离子选择电极 1.电极基本结构与电极电位 离子选择性电极是一种对溶液中待测离子有选择性
响应能力的电极,属于膜电极。
31
全国高职高专药品类专业卫生部“十一五”规划教材
电位法 :根据测定原电池的电动势,以确定待测物含 量的分析方法 。
5
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2版)
一、参比电极
定义:电位值不随待测离子浓度的变化而变化,具有 恒定电位值的电极,称为参比电极。
参比电极分类:标准氢电极(SHE)为一级参比电极, 但其使用不方便,常用的参比电极是甘汞电极、银–氯 化银电极,为二级参比电极。下面重点介绍这两种参 比电极 。
对阳离子Mn有响应的电极,其电极电位为:
K
0.059 n
lg
cMn
对阴离子R n 有响应的电极,其电极电位为:
K
0.059 n
lg
cRn
33
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
K 0.059pH
分析化学(第2版)
该式表明,电池的电动势与溶液pH呈线性关系。
27
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
分析化学(第2版)
实际测定时每支玻璃电极的K′均不同,并且每一支 玻璃电极的不对称电位也不相同,因此导致公式中 常数K值很难确定。在具体测定时常采用两次测量 法以消除其影响。
在25℃时,三种不同浓度的KCl溶液的甘汞电极的 电位分别为:
KCl溶液浓度 0.1mol/L 1 mol/L
饱和
电极电位(V) 0.3337
0.2801
0.2412
在电位分析法中最常用的参比电极是饱和甘汞电极 (SCE)。其电位稳定,构造简单,保存和使用都 很方便。
9
全国高职高专药品类专业卫生部“十一五”规划教材
(2)金属-金属难溶盐电极:由表面涂有同一种 难溶盐的金属插入该难溶盐的阴离子溶液中组成。 其电极电位随溶液中阴离子浓度的变化而变化。 例如,将表面涂有AgCl的银丝插入到溶液中, 组成银-氯化银电极,电极反应和电极电位为:
AgCl + e = Ag + + Cl-
= -0.059lg cCl
11
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
分析化学(第2版)
课堂互动 请您回答:甘汞电极作为参比电 极的条件是什么?
12
全国高职高专药品类专业卫生部“十一五”规划教材
第一节概 述
二、指示电极
分析化学(第2版)
定义:电位值随溶液待测离子浓度的变化而变化的电极 称为指示电极。
电位法所用的指示电极有多种,一般分为以下两大类:
饱和甘汞电极为参比电极,浸入待测溶液中组成原 电池。其原电池符号表示为:
(-) GE︱待测溶液‖SCE (+)
26
全国高职高专药品类专业卫生部“十一五”规划教材
第二节 直接电位法
25℃时,该电池的电动势E为:
E SCE GE
0.2412 (K'0.059pH)
0.2412 K'0.059pH
第二节 直接电位法
2.pH玻璃电极的原理 玻璃电极浸泡水中后,在玻
璃膜表面形成一层很薄的水 化凝胶层,浸泡好的玻璃电 极插入到待测溶液中时,水 化凝胶层与溶液接触,H+便 从浓度高的一侧向浓度低的 一侧迁移,当达到平衡时就 产生了一定的内、外膜相界 电位。如右图。
分析化学(第2版)
20
全国高职高专药品类专业卫生部“十一五”规划教材
