浙江省2018高考化学一轮复习10电解池原理及应用课件苏.ppt
2018年浙江高考一轮 专题6 第3单元 电解池的工作原理及应用 金属的腐蚀与防护(加试要求)

阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 (3)a d
学考+选考总复习
分析电解过程的一般思路 (1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。 (2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液 中的H 和OH )。 (3)然后排出阴、阳两极的放电顺序 (4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和 电荷守恒。 (5)最后写出电解反应的总化学方程式或离子方程式。
学考+选考总复习
(2)电极反应式的书写
①判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放 电。阳极为金属活性电极时,电极材料放电。 ②根据离子放电顺序,确定放电的离子种类,分析电极反应,并判断电极产 物,按照“阳极氧化、阴极还原”写出电极反应式。 ③电解水溶液时, 应注意水电离出的 H+、 OH-放电时电极反应式的书写, H+、 OH-之后的离子一般不参加放电反应。
A.整套装置工作时A连接D、B连接C B.VB2极发生的电极反应为:2VB2+22OH--22e-===V2O5+2B2O3+ 11H2O C.电极F产生3 mol气体时电极E得到的氧化产物为2 mol D.储氢装置工作时,右侧电极区的pH减小
学+选考总复习 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯
学考+选考总复习
考 点 一
第三单元
电解池的工作原理及应用
金属的腐蚀与防护(加试要求)
考 点 二
课 后 限 时 训 练
学考+选考总复习
知识条目 必考要求 加试要求
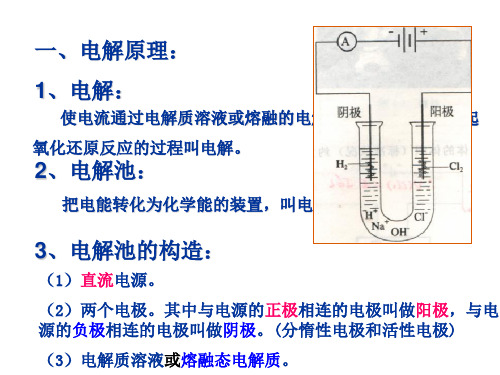
(1)电解池的概念、构造与工作原理
(2)电解CuCl2溶液的原理及电极反应式 (3)电解池的构成条件 浙江考试标准 (4)电解池的电极反应式与电解反应方程式 (5)电解原理在金属冶炼、氯碱工业、电镀等生产 生活中的应用 (6)原电池、电解池的判断 (7)金属腐蚀的危害 (8)金属发生电化学腐蚀的基本原理 (9)金属的防护
2018-2019年最新人教版高考化学一轮复习6-3电解池课件PPT课件

解析:(1)电解池的标志是有外加电源,①③中都有直流电 源,是电解池。 (2)装置③中是用惰性阳极电解氯化钾溶液,生成氢气、氯 气、KOH,其中Cl2与KOH会发生氧化还原反应。
答案:(1)①③
答案:B
2.某电解池内盛有 CuSO4 溶液,插入两根电极,接通直流电 源后,欲达到如下要求:①阳极质量不变;②阴极质量增加;③电 解液 pH 减小,则应选用的电极是( A.阴阳两极不都是石墨 C.铁作阳极,铜作阴极 ) B.铜作阳极,铁作阴极 D.铂作阳极,铜作阴极
答案:D
3.下列描述中,不符合生产实际的是(
)
答案:B
答案:C
A.在①中Cu棒为阳极;在②中Cu棒为负极 B.电极上析出物质的质量:①<② C.电极反应式:①中阳极:4OH -4e ===2H2O+O2↑; ②中负极:2H +2e ===H2↑ D.c(Cu2 ):①中不变;②中减小
+ + - - -
解析:由装置特点可知,①为电解池,②为原电池。A项,① 中Cu棒与电源正极相连,作阳极;②中Cu棒为正极。B项,①中 Cu棒失电子而溶解变细,Fe棒有Cu析出:Cu2 +2e ===Cu;②
)
A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极
答案:A
4.用电解法提取氯化铜废液中的铜,方案正确的是( A.用铜片连接电源的正极,另一电极用铂片 B.用碳棒连接电源的正极,另一电极用铜片 C.用氢氧化钠溶液吸收阴极产物 D.用带火星的木条检验阳极产物
第六章
第三节 电解池
核心知识图
课堂师生互动 方法警示探究
自主复习
学科素养提升
高考电解池的工作原理及其应用专题复习PPT课件

复习过关
1、下图是电解饱和NaCl溶液的实验装置,其中c、 d为石墨电极。则下列有关判断中正确的是( A )
A.a为正极、b为负极
B.c为阴极、d为阳极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
2[02名0届 师高 课考 堂电 教解 学池 ]的 高工 考作 电原 解理 池及 的其 工应 作 用 原专 理题 及 复 其习 应用 专课题件复(习共1P6PT张课PP件T)(完 整版PP T)
2[02名0届 师高 课考 堂电 教解 学池 ]的 高工 考作 电原 解理 池及 的其 工应 作 用 原专 理题 及 复 其习 应用 专课题件复(习共1P6PT张课PP件T)(完 整版PP T)
2[02名0届 师高 课考 堂电 教解 学池 ]的 高工 考作 电原 解理 池及 的其 工应 作 用 原专 理题 及 复 其习 应用 专课题件复(习共1P6PT张课PP件T)(完 整版PP T)
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
3、在电解时使用非惰性电极,分析电镀及电 解精炼。
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
1、分析电解熔融的氯化钠(工业上制钠)
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
[名师课堂教学]高考电解池的工作 原理及 其应用 专题复 习PPT课 件(完 整版PP T)
化学第一轮复习电解池
阳极:氧化反应、溶液中 的阴离子失电子,或电极 金属失电子
阴极:还原反应,溶液中 的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中的阳离子 得电子
(08全国Ⅰ卷)电解100mLc(H+)=0.30mol/L的下列溶液,
当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg+
B.H+>X3+>Cu2+
C.X3+>H+>Cu2+
D.Cu2+>H+>X3+
练习
1、(08全国Ⅱ卷)右图为直流电源电解稀Na2SO4水溶液的装 置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验 现象正确的是(D )
A.逸出气体的体积:a电极的小于b电 极的 B.一电极逸出无味气体,另一电极逸 出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色 D.a电极附近呈蓝色,b电极附近呈红色
将电能转化成化学能 的装置
应用电解原理在某些金属表 面镀上一层其它金属的装置
①两电极接直流电源
②两电极插入电解质溶液 中 ③形成闭合回路
①镀层金属接电源正极, 待镀金属接电源负极 ②电镀液必须含有镀层 金属的离子
阳极:与电源正极相连 阴极:与电源负极相连
名称同电解,但有限制条件。 阳极:必须是镀层金属 阴极:镀件
电解质 增大 氯化铜
电解质 和水
增大
氯化氢
放O2 生酸型
阴极:电解质阳离子放电 阳极:H2O放O2生酸
CuSO4
电解质 减小 CuO或
和水
CuCO3
②当阳极为活性电极(银以前金属)时,阳极金属失电子
高考化学第一轮复习专题电解原理及应用学案苏教版(2021年整理)

2018年高考化学第一轮复习专题电解原理及应用学案苏教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年高考化学第一轮复习专题电解原理及应用学案苏教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年高考化学第一轮复习专题电解原理及应用学案苏教版的全部内容。
电解原理及应用【本讲教育信息】一。
教学内容:电解原理及应用二。
教学目标理解电解原理,掌握电极反应式的书写及电解原理的应用三。
教学重点、难点电解原理[教学过程]一、电解原理:电解是电流通过电解质溶液而在阴、阳两极发生氧化还原反应的过程;电解池是将电能转化为化学能的装置;构成条件为:必须连接有直流电源,要有电极(阴、阳极),以及电解质溶液或熔融电解质。
在电解过程中与电源正极相连的极称为阳极,在阳极上发生氧化反应;与电源负极相连的极称为阴极,在阴极上发生还原反应;电解质溶液中的阴离子移向阳极,阳离子移向阴极。
说明:1、电解质溶液的导电过程实质上就是其电解过程。
在电解池中电子流向:电子由电源的负极→电解池的阴极,再由电解质溶液→电解池的阳极→电源正极。
溶液中离子的移动方向:溶液中阳离子向阴极移动,阴离子向阳极移动。
2阴、阳离子定向移动, 在两极上失、得电子成为原子或分子, 如CuCl2=Cu(阴极)+Cl2(阳极)3有外加电源的装置一定是电解池,无外加电源的装置一定是原电池, 多池组合时,一般是含有活泼金属的池为原电池,其余都是在原电池带动下工作的电解池;若最活泼的电极相同时,则两极间活泼性差别较大的是原电池,其余为电解池.4、电解池的反应原理:放电:阳离子得到电子或阴离子失去电子。
(浙江选考)2018高考化学大一轮复习专题6化学反应与能量变化第3单元电解池的工作原理及应用金属的腐蚀与防

(2)电解池工作原理(以电解CuCl2溶液为例)
(3)电解池中电子和离子的移动 ①电子:从电解池的 阳极 流向电源的 正 极,流向电源 负 极,流向电
解池的 阴极 。 ②离子:阳离子移向电解池的 阴极 ,阴离子移向电解池的 阳极 。
3.电解原理的应用 (1)电解饱和食盐水
(2)电解精炼铜
(3)电镀铜
(6)原电池、电解池的判断
(7)金属腐蚀的危害
(8)金属发生电化学腐蚀的基本原理
(9)金属的防护
必考要 求
加试要 求
b b b b
b
c a c b
1.电解、电解池
考点 1| 电解原理及应用 [基础知识自查]
2.电解池的构成和工作原理 (1)构成条件 ①有与 外接直流电源相连的两个电极。 ②电解质溶液(或 熔融电解质)。 ③形成 闭合回路 。
【答案】 B
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯 的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的 离子交换膜只允许阳离子通过。
完成下列填空: (1)写出电解饱和食盐水的离子方程式_______________________。 (2)离子交换膜的作用为:_________________________________、 ________________________________________________。 (3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________ 位置流出。(选填“a”“b”“c”或“d”)
【解析】 (1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2 逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化 反应,产生Cl2。反应的离子方程式是2Cl-+2H2O=通==电==Cl2↑+H2↑+2OH-。
高考化学一轮复习专题课件:电解池 (共23张PPT)上课用
电极 方程式
电解 物质
总化学 方程式
含氧酸(如H2SO4) 阳极:_4_O_H__-_
强碱(如NaOH) -__4_e_-_=_=_=_O__2↑__
活泼金属的含 +__2_H_2_O__
H2O
氧酸盐(如
阴极:__4_H_+__ +__4_e_-_=_=_=_2_H__2↑_
KNO3、Na2SO4)
电解池及其应用
1. 了解电解池工作原理,及其在生产生活中的应用。 能写出简单的电极反应式和总反应方程式。
2. 理解金属发生电化学腐蚀的原因、金属腐蚀的 危害、 防止金属腐蚀的措施。
高考对本节内容的考查,一是电解过程的分析, 多借助于图像考查电极上离子的放电顺序与产 物的判断,电极反应式的书写;二是注重原电池 与电解池相结合考查新型充电电池;三是考查新 情景下电解原理的实际应用,如氯碱工业,电解 精炼铜、电镀、电解除污,结合离子交换膜进行 电解;四是金属腐蚀的原因与防护措施。
通电
2NaCl+2H2O 2NaOH +H2↑+Cl2 ↑
Cl—
H+
Na+
Na+
OH—
探讨7:电解槽内插入阳离子交换膜,你知道
它的作用是什么吗?
NaOH 溶液
知识点二 电解原理的应用
应用2------粗铜的精炼
粗铜(含有Zn、Ni、Fe、Ag、Au杂质),如何得到 纯铜?画出简易的装置图并写出阴阳极的电极反应式。
试一试:写出工业上冶炼金属铝的电极反应?
阳极: 6O2- -12e- == 3O2↑ 阴极:4Al3+ + 12e- == 4Al 总反应:2Al2O3(熔融) 通电 4Al + 3O2 ↑
高考化学一轮总复习讲电解池新人教版PPT课件
6. 如图所示,a、b、c均为石墨电极,d为碳钢电极, 通电进行电解。假设在电解过程中产生的气体全部 逸出,下列说法正确的是( ) D
A.甲、乙两烧杯中溶液的pH 均升高 B.当b极增重5.4 g时,d极产 生的气体为2.24 L(标准状况) C.当电解一段时间后,将甲、乙两溶液混合,一 定会生成沉淀 D.乙烧杯中c的电极反应式为2Cl--2e-===Cl2↑
【解析】 解本题的关键有两点:一是正确写 出电极反应式。根据活性材料作阴极不参加反应, 作阳极时被氧化,可知粗铜为阳极,铁为阴极; 二是根据“电解时,通过各串联电极的电子的物 质的量相等”建立关系式。
13
设参加反应的 Cu和Zn 的物质的量分别为 x mol和y mol。生成的Cu的物质的量
14
Zn%=
1
28
写在最后
经常不断地学习,你就什么都知道。你知道得越多,你就越有力量 Study Constantly, And You Will Know Everything. The More
You Know, The More Powerful You Will Be
谢谢大家
荣幸这一路,与你同行
26
7.下图是一个乙醇燃料电池工作时的示意图,乙池中 的两个电极一个是石墨电极,一个是铁电极,工作时 M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是_铁___,电极名称是_阴__极__,N的电极反 应式为_4_O_H_-_-_4_e-_=_=_=_2_H__2O__+_O_2_↑_,加入乙醇的铂电极的电 极反应式为_C_2_H_5_O_H__-1_2_e_-_+_1_6_O_H__-=_=_=__2_C_O_+_1_1_H__2_O_。
高中化学《电解池的工作原理及应用》公开课PPT多媒体课件
通电
4Ag + O2 ↑+ 4H+
想一想、做一做: 若以铜和石墨为电极,电解硫酸铜溶液, 情况会如何?并写出电极反应式。
石墨
铜
阳极: 2H2O - 4e- = 4H+ + O2↑ 阴极: 2Cu2+ + 4e- = 2Cu 总反应: 2Cu2++2H2O===
通电
通电 体,能使 湿 润的KI-淀 粉 试纸变蓝
想一想: CuCl2溶液中除了Cu2+、Cl-, 还有什么离子?
CuCl2= Cu2+ +2Cl-
H2O
OH- + H+
OH-
H+
H+
OH-
H+
OHOH-
H+
想一想: H+ 和 OH-为什么没有参与电解?
4、电解时离子放电顺序
阴极——得到电子,发生还原反应。 活性电极受保护,不反应 根据氧化性强弱 Ag+> Fe3+> Cu2+>H+(酸)>Fe2+ >Zn2+>H+(水) >Al3+>Mg2+>Na+… 阳极—— 失去电子,发生氧化反应 根据还原性强弱 活性电极>S2->I->Br->Cl->OH->其它含氧 (Mg~Ag) 酸根离子
2、铜的电解精炼 ①粗铜所含的杂质 Zn、Fe、Ni、Ag、Au等 ②粗铜的精炼 以粗铜为阳极,以纯铜为 阴极, 以CuSO4溶液为电 解质溶液进行电解 阳极: Zn -2e-=Zn2+ Ni -2e-=Ni2+ 阴极: Cu2+ +2e-=Cu 长时间电解后必须补充电解液
2018届高考化学:第18讲-电解池及其应用ppt课件
< c( C H 3C O O H )
+
, 加 水 稀 释 促 进 醋 酸
c(H )大 于 盐 酸 , 要 使 稀 释 后 溶
液的pH相 等 , 则 醋 酸 应 该 加 入 水 多 些 , 盐 酸 中 加 入 水 少 些 , 即 m< n,D正 确 。
高考总复习 一轮复习导学案 · 化学
课前自测 考点导学 随堂检测
专题三 化学反应与能量变化
[解析]
d 处 是 电 解 池 的 阴 极 , 电 极 反 应 为 2H2O + 2e -
===H2↑+2OH-,生成OH-使溶液呈碱性,pH试纸变蓝,A正 确; b 处变红,局部褪色,说明是溶液中的氢氧根和氯离子同 时放电, B错误;c处为阳极,铁失去电子生成亚铁离子, C 正 确;实验一中 a、c形成电解池,d、b形成电解池,所以实验二 中铜珠的两端分别为电解池的阴、阳极,两个铜珠的右侧(m、 n)均为电解池的阴极,n侧H+得电子生成H2,其左侧Cu失去电 子生成 Cu2 + ,两个铜珠之间 Cu2 + 浓度较大,故 m 侧 Cu2 + 得电
专题三 化学反应与能量变化
2. ( 2 0 1 7 · 广 东 惠 州 调 研
)某 同 学 设 计 下 图 装
置 探 究 氯 碱 工 业 原 理 , 下 列 说 法 正 确 的 是 ( B ) A . 石 墨 电 极 与 直 流 电 源 负 极 相 连 B . 铜 电 极 的 电 极 反 应 式 为 ===H2↑ C . 氢 氧 化 钠 在 石 墨 电 极 附 近 产 生 , D . 变 蓝 色 用 湿 润 的 K I Na 向 石 墨 电 极 迁 移
两者都是在两电极上发生氧化还原反应 __________________________________________
