初中化学除杂总结
初中化学除杂知识点归纳

初中化学除杂知识点归纳一、溶液的分离与纯化1. 蒸馏法:利用溶液中组成物质的沸点不同,通过加热和冷凝来使沸点较低的物质蒸发并冷凝回收,实现分离纯化的方法。
2. 结晶法:利用溶液中溶质的溶解度随温度变化而变化,通过加热浓缩溶液,然后冷却结晶,使溶质从溶液中析出,实现分离纯化的方法。
3. 过滤法:利用溶液中溶质与溶剂的颗粒大小不同,通过过滤器进行筛选,使颗粒较大的溶质被滤除,实现分离纯化的方法。
4. 萃取法:利用溶质在两种不同溶剂中的溶解度不同,通过溶剂的选择和分离,使溶质从溶液中转移到另一溶剂中,实现分离纯化的方法。
二、气体的分离与纯化1. 气体的分离:利用气体的密度和溶解度不同,通过物理方法如液体吸附、分子筛吸附等,或化学方法如催化剂反应等,使混合气体中的组分分离出来。
2. 气体的纯化:利用物理方法如冷凝、吸附等,或化学方法如催化剂反应等,去除混合气体中的杂质,使气体纯化。
三、固体的分离与纯化1. 磁性分离:利用固体中含有磁性物质而其他物质不具备磁性的特点,通过外加磁场使磁性物质被吸附到磁铁等磁体上,实现分离纯化的方法。
2. 晶体分离:利用固体中晶体的形状和大小不同,通过筛网或离心等方法,使晶体被分离出来,实现分离纯化的方法。
3. 溶液结晶:利用固体在溶液中的溶解度随温度变化而变化,通过加热浓缩溶液,然后冷却结晶,使溶质从溶液中析出,实现分离纯化的方法。
四、液体的分离与纯化1. 蒸馏法:利用液体的沸点不同,通过加热和冷凝来使沸点较低的液体蒸发并冷凝回收,实现分离纯化的方法。
2. 萃取法:利用液体在两种不同溶剂中的溶解度不同,通过溶剂的选择和分离,使溶质从液体中转移到另一溶剂中,实现分离纯化的方法。
3. 结晶法:利用液体中溶质的溶解度随温度变化而变化,通过加热浓缩溶液,然后冷却结晶,使溶质从液体中析出,实现分离纯化的方法。
五、电解质的分离与纯化1. 电解法:利用电解质在电场中的离子运动和电极反应,通过电解质溶液在电解槽中的电解分解,使正负离子分别在阳极和阴极上析出,实现分离纯化的方法。
初中化学除杂问题总结

初中化学常见物质的除杂总结一、概念理解首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。
二、除杂原则简单概括为:不增,不减,易分。
(1)不增:提纯过程中不能引入新的杂质。
(2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能与被提纯物反应。
(3)易分:操作简单,容易分离。
三、解题要领三要领:找差异,定方法,选试剂。
(1)找差异:根据混合物各物质特征,物理性质或者化学性质,找到突破口。
(2)定方法:找到突破口之后,根据物质特征,确定除杂方法。
(3)选试剂:根据物质特征和所选方法选择合适的试剂。
四、常用除杂方法:1、物理方法:过滤法、结晶法、蒸发法。
2、化学方法:沉淀法、气化法、转化法、中和法、吸收法。
五、初中常见物质提纯方法总结物质杂质除杂方法编号CO2O2通过灼热的铜网 1 CO2CO 通过灼热的氧化铜 2 H2、CO2、O2H2O 通过浓硫酸或氯化钙等干燥剂 3 O2、H2、CO CO2、SO2通入氢氧化钠溶液中洗气 4 CO2HCl 通入碳酸氢钠钠溶液中洗气 5Cu Fe、Zn 加入足量的稀盐酸或稀硫酸,过滤 6 Fe Cu 用磁铁将铁粉吸引出来7 Cu CuO 加入足量的稀盐酸或稀硫酸,过滤8 CuO Cu或C 在空气中灼烧9CaO CaCO3 高温煅烧10CaCO3 CaO 加足量水溶解,过滤,取滤渣11CaCO3 CaCl2 加足量水溶解,过滤,取滤渣12CaCl2 CaCO3 加足量水溶解,过滤,取滤液蒸发13NaCl NaHO 加入足量盐酸,蒸发14 KNO3 NaCl 冷却热饱和溶液15NaCl KNO3 蒸发结晶16NaNO3 NaCl 加入适量AgNO3过滤17 NaCl CuSO4 加入适量Ba(HO)2,过滤18 NaHO NaCO3 加入适量Ca(OH)2,过滤19 NaCl Na2SO4 加入适量BaCl2溶液,过滤20 Na2SO4 CuSO4 加适量NaOH溶液21 NaCl Na2CO3 加适量稀盐酸22 FeCl2溶液HCl 加过量铁粉,过滤,取滤液23 FeSO4 CuSO4 加过量铁粉,过滤,取滤液24 六、理解与提高这种题型常常结合物质的共存、溶解性、酸碱性等知识考查,只要对除杂混合物中各物质的物理性质、化学性质比较了解,那么做这类试题就不会太难,要求基础知识掌握比较扎实。
初中化学常见物质的除杂总结
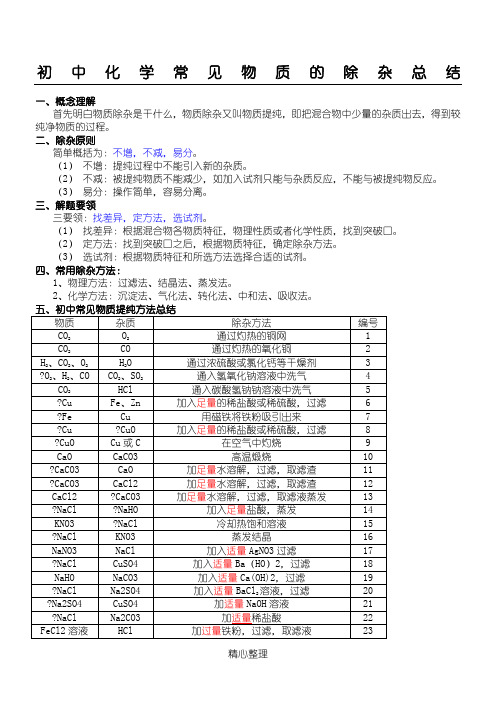
初中化学常见物质的除杂总结一、概念理解首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。
二、除杂原则简单概括为:不增,不减,易分。
(1)不增:提纯过程中不能引入新的杂质。
(2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能与被提纯物反应。
(3)易分:操作简单,容易分离。
三、解题要领三要领:找差异,定方法,选试剂。
(1)找差异:根据混合物各物质特征,物理性质或者化学性质,找到突破口。
(2)定方法:找到突破口之后,根据物质特征,确定除杂方法。
(3)选试剂:根据物质特征和所选方法选择合适的试剂。
四、常用除杂方法:1、物理方法:过滤法、结晶法、蒸发法。
2、化学方法:沉淀法、气化法、转化法、中和法、吸收法。
五、初中常见物质提纯方法总结物质杂质除杂方法编号CO2O2通过灼热的铜网 1CO2CO 通过灼热的氧化铜 2H2、CO2、O2H2O 通过浓硫酸或氯化钙等干燥剂 3?O2、H2、CO CO2、SO2通入氢氧化钠溶液中洗气 4CO2HCl 通入碳酸氢钠钠溶液中洗气 5 ?Cu Fe、Zn 加入足量的稀盐酸或稀硫酸,过滤 6 ?Fe Cu 用磁铁将铁粉吸引出来7 ?Cu ?CuO 加入足量的稀盐酸或稀硫酸,过滤8 ?CuO Cu或C 在空气中灼烧9 CaO CaCO3 高温煅烧10?CaCO3 CaO 加足量水溶解,过滤,取滤渣11 ?CaCO3 CaCl2 加足量水溶解,过滤,取滤渣12 CaCl2 ?CaCO3 加足量水溶解,过滤,取滤液蒸发13 ?NaCl ?NaHO 加入足量盐酸,蒸发14 KNO3 ?NaCl 冷却热饱和溶液15 ?NaCl KNO3 蒸发结晶16 NaNO3 NaCl 加入适量AgNO3过滤17 ?NaCl CuSO4 加入适量Ba(HO)2,过滤18 NaHO NaCO3 加入适量Ca(OH)2,过滤19 ?NaCl Na2SO4 加入适量BaCl2溶液,过滤20 ?Na2SO4 CuSO4 加适量NaOH溶液21 ?NaCl Na2CO3 加适量稀盐酸22 FeCl2溶液HCl 加过量铁粉,过滤,取滤液23?FeSO4 CuSO4 加过量铁粉,过滤,取滤液24六、理解与提高这种题型常常结合物质的共存、溶解性、酸碱性等知识考查,只要对除杂混合物中各物质的物理性质、化学性质比较了解,那么做这类试题就不会太难,要求基础知识掌握比较扎实。
初三化学除杂总结

初三化学除杂总结1. 什么是化学除杂?化学除杂是一种通过化学方法将混合物中的杂质分离出来的过程。
在化学实验中,杂质的存在会影响实验的准确性和结果的可靠性,因此除杂是非常重要的步骤。
化学除杂的方法多种多样,根据不同的实验需求,我们可以选择合适的方法来除去不同性质的杂质。
2. 常见的化学除杂方法2.1 过滤过滤是一种通过过滤介质的孔隙大小来实现杂质分离的方法。
在实验中,我们通常会使用过滤纸、玻璃棉、活性炭等物质作为过滤介质。
根据杂质的大小和性质,我们可以选择适当的过滤介质来实现有效的过滤。
2.2 沉淀通过沉淀可以将溶液中的固体杂质沉淀下来,从而实现杂质分离的目的。
常见的沉淀方法包括盐酸与氯化银溶液反应生成白色沉淀、碳酸钙与盐酸反应生成二氧化碳气体和水等。
沉淀是一种简单易行的化学除杂方法,适用于不同种类的溶液。
2.3 洗涤洗涤是一种通过溶液的溶解性来除去杂质的方法。
在实验中,我们通常会使用适当浓度的溶液来洗涤杂质,使其溶解或与溶液发生化学反应后被除去。
例如,使用稀硫酸来洗涤含铜的废水,通过与硫酸反应形成不溶于水的硫酸铜从而除去铜离子。
2.4 萃取萃取是一种通过溶剂的选择性溶解性来实现杂质分离的方法。
在实验中,我们通常会选择合适的溶剂与溶质发生反应,使溶质在其中溶解,从而与原混合物分离。
例如,使用醇类溶剂来萃取植物中的油脂,通过溶解油脂而将其与其他成分分离。
3. 化学除杂的实验注意事项在进行化学除杂的实验过程中,我们需要注意以下几点:3.1 安全性化学实验中的除杂步骤可能会涉及到一些有毒或腐蚀性的化学品,因此在进行实验时需要注意安全。
戴上实验手套、护目镜等个人防护用品,并确保实验操作台面整洁,并配备好相应的安全设施。
3.2 实验装置清洁在进行化学除杂实验之前,我们需要确保实验装置是干净的。
如果实验装置中有积存的化学物质或杂质,可能会对实验结果产生干扰。
因此,在进行实验之前,需要对实验装置进行细致的清洗,并确保干净无杂质。
初中化学物质除杂方法归纳

初中化学物质除杂⽅法归纳 除杂即去除物质中的杂质。
那么初中化学物质除杂⽅法有哪些呢?⼀起来看看,以下是店铺分享给⼤家的初中化学物质除杂⽅法,希望可以帮到你! 初中化学物质除杂⽅法 1、CO2(CO):把⽓体通过灼热的氧化铜, 2、CO(CO2):通过⾜量的氢氧化钠溶液 3、H2(⽔蒸⽓):通过浓硫酸/通过氢氧化钠固体 4、CuO(C):在空⽓中(在氧⽓流中)灼烧混合物 5、Cu(Fe) :加⼊⾜量的稀硫酸 6、Cu(CuO):加⼊⾜量的稀硫酸 7、FeSO4(CuSO4):加⼊⾜量的铁粉 8、NaCl(Na2CO3):加⼊⾜量的盐酸 9、NaCl(Na2SO4):加⼊⾜量的氯化钡溶液 10、NaCl(NaOH):加⼊⾜量的盐酸 11、NaOH(Na2CO3):加⼊⾜量的氢氧化钙溶液 12、NaCl(CuSO4):加⼊⾜量的氢氧化钡溶液 13、NaNO3(NaCl):加⼊⾜量的硝酸银溶液 14、NaCl(KNO3):蒸发溶剂 15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(⽔蒸⽓):通过浓硫酸。
除杂⽅法原理: 1、利⽤物理性质是否溶解于⽔,进⾏杂质去除; 2、利⽤化学反应,反应掉其中的杂质;燃烧、碱⽔吸收、酸液吸收等都算,都是化学反应;其中分为酸碱反应、氧化还原反应两种; 3、利⽤物理性质,升华、蒸发或者融化等进⾏分离,甚⾄可以使⽤磁铁、蚂蚁等⼿段; 注意的问题: (1)需净化的⽓体中含有多种杂质时,除杂顺序:⼀般先除去酸性⽓体,如:氯化氢⽓体,CO2、SO2等,⽔蒸⽓要在最后除去。
(2)除杂选⽤⽅法时要保证杂质完全除掉,如:除CO2最好⽤NaOH不⽤Ca(OH)2溶液,因为Ca(OH)2是微溶物,⽯灰⽔中Ca(OH)2浓度⼩,吸收CO2不易完全。
初中化学学习建议 ⼀、坚持课前预习 预习是学习的第⼀步,就是在上课前把要讲的内容先通读⼀遍,阅读时,对重要概念和定律要反复阅读,逐字逐句仔细推敲,对关键字、词、句应认真钻研,确实弄懂所读内容,了解本节课的基本知识,分清哪些是重点、难点和关键,哪些通过⾃⼰看课本就能掌握,哪些⾃⼰看不懂、想不通,就在旁边记上记号,这样在听课时才能有的放⽮,有张有弛,在轻松愉快中接受知识,取得较好效果。
初中化学除杂知识点归纳

初中化学除杂知识点归纳一、化学反应与化学方程式化学反应是物质之间发生的变化,可以通过化学方程式来表示。
化学方程式由反应物和生成物组成,反应物在方程式左侧,生成物在右侧。
在化学方程式中,需要保持原子数和电荷数的平衡。
二、离子反应离子反应是指在溶液中发生的以离子为反应物或生成物的反应。
离子反应中,正离子和负离子之间发生交换,形成新的化合物。
三、金属与非金属元素的反应金属元素与非金属元素之间的反应是常见的化学反应。
金属元素通常会与非金属元素发生电子转移,形成离子化合物。
例如,钠和氯反应生成氯化钠。
四、氧化还原反应氧化还原反应是指物质中的原子氧化态和还原态发生变化的反应。
氧化反应是指物质失去电子,还原反应是指物质获得电子。
五、酸碱反应酸碱反应是指酸和碱之间发生的中和反应。
酸是指能够释放出H+离子的物质,碱是指能够释放出OH-离子的物质。
酸和碱反应时会产生盐和水。
六、溶液的浓度溶液的浓度是指单位体积溶液中溶质的含量。
常用的表示浓度的单位有摩尔浓度、质量浓度和体积浓度。
七、离子反应的电离度离子反应中,物质的电离度是指溶液中电离的物质分子或离子的百分比。
电离度越高,反应越强。
八、化学反应速率化学反应速率是指单位时间内反应物消失或生成物出现的量。
化学反应速率受温度、浓度、催化剂等因素的影响。
九、化学平衡化学平衡是指化学反应达到动态平衡的状态,反应物和生成物浓度保持不变。
平衡常数是描述平衡位置的指标。
十、氧化还原反应与电化学氧化还原反应与电化学有密切关系。
氧化还原反应可以通过电化学方法进行观察和测量。
十一、化学元素与周期表化学元素是构成物质的基本单位,周期表是对化学元素进行分类和排列的工具。
周期表按原子序数、电子结构等特性进行排列。
十二、化学键与化合物化学键是原子之间形成的强力作用,化合物是由不同元素通过化学键结合而成的物质。
以上是初中化学除杂知识点的归纳,希望对你的学习有所帮助。
化学是一门有趣而重要的科学,通过学习化学,我们可以更好地理解和应用于日常生活中。
初中化学物质除杂方法归纳

初中化学物质除杂方法归纳初中化学物质除杂方法归纳化学是自然科学的一种。
化学是主要在分子、原子层面,研究物质的组成、性质、结构与变化规律的科学。
下面为大家带来初中化学物质除杂方法归纳,快来看看吧。
除杂即去除物质中的杂质。
初中化学物质除杂的原则是:不引入新的杂质(包括水蒸气等),不能将原有的物质反映掉,除杂选择试剂的原则是:不增、不减、不繁。
初中化学物质除杂方法归纳:1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体4、CuO(C):在空气中(在氧气流中)灼烧混合物5、Cu(Fe):加入足量的稀硫酸6、Cu(CuO):加入足量的稀硫酸7、FeSO4(CuSO4):加入足量的铁粉8、NaCl(Na2CO3):加入足量的盐酸9、NaCl(Na2SO4):加入足量的氯化钡溶液10、NaCl(NaOH):加入足量的盐酸11、NaOH(Na2CO3):加入足量的氢氧化钙溶液12、NaCl(CuSO4):加入足量的氢氧化钡溶液13、NaNO3(NaCl):加入足量的硝酸银溶液14、NaCl(KNO3):蒸发溶剂15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(水蒸气):通过浓硫酸。
除杂方法原理:1、利用物理性质是否溶解于水,进行杂质去除;2、利用化学反应,反应掉其中的杂质;燃烧、碱水吸收、酸液吸收等都算,都是化学反应;其中分为酸碱反应、氧化还原反应两种;3、利用物理性质,升华、蒸发或者融化等进行分离,甚至可以使用磁铁、蚂蚁等手段;注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca (OH)2浓度小,吸收CO2不易完全。
初中化学除杂总结大全

初中化学除杂总结大全
初中化学中的"除杂"是指在化学实验中净化或分离混合物中的杂质的过程。
以下是初中化学除杂的总结大全:
1.过滤法:通过将混合物倾倒在滤纸上,利用滤纸的孔隙将
固体颗粒分离出来。
适用于固体与液体混合物或固体与固体混合物中固体颗粒的分离。
2.蒸馏法:利用液体混合物的沸点差异进行分离,通过加热
混合物,使液体先蒸发,再冷凝回收。
适用于液体与液体混合物中沸点差异较大的情况。
3.结晶法:通过加热溶液使其饱和度增大,然后冷却过程中
使溶质结晶出来。
适用于溶液中有固体溶质的情况。
4.萃取法:利用溶解度差异,将混合物中的某一组分选择性
地溶解在适当的溶剂中,进行分离。
适用于固体与液体或液体与液体之间的分离。
5.汽分法:基于组分的挥发性差异,在恒温条件下,将混合
物加热使挥发性高的组分先蒸发,然后冷凝回收。
适用于液体与液体混合物中挥发性差异较大的情况。
6.电解法:通过电解将混合物中的离子分离出来。
适用于混
合物中包含离子的情况。
7.稀释法:通过加入适量溶剂,将浓度过高的溶液稀释至目
标浓度。
适用于溶液浓度超标的情况。
8.燃烧法:通过燃烧混合物,利用各组分的燃烧特性进行分
离。
适用于混合物中含有易燃物质的情况。
以上是初中化学中常见的除杂方法的总结。
每种除杂方法都有其适用的情况和操作步骤,根据具体实验要求和混合物的性质,选择合适的除杂方法进行操作,可以有效地分离和纯化混合物中的杂质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学除杂题型解题技巧总结
1. 除杂题:
解答除杂质一类的题目时,要注意三原则;三要领;六种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
六种常用方法:
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
( )例1. (07昆明)除去KCl溶液中混有的少量K2CO3,选用的试剂是
A.H2SO4溶液
B.稀盐酸
C.K2SO4溶液
D. AgNO3溶液
( )例2. (08哈尔滨)除去下列各物质中的少量杂质所
选用的试剂及操作方法均正确的是
( )例3. (08黄石)下列除杂方法正确的是
A.用NaOH除去CO2中混有的HCl
B.用点燃的方法除去CO2中混有少量的CO
C.用水除去MnO2中混有的KCl
D.用硝酸除去NaCl中混有的Na2CO3
( )例4. (08盐城)下表列出了除去物质中所含少量杂质的方法,其中错误的是
( )例5. (08南通)除去下列物质中所含少量杂质的方法正确的是
( )例6.(08淄博)下列除杂质的方法不正确...
的是
中考链接
( )1.(08大庆)下表中,除去物质所含杂质的方法正确的是
( )2.(07雅安)除去下列各组物质中的杂质,所用试剂和方法均正确的是
()3.(11扬州)下列除杂选用试剂正确的是A.用过量的O2除去CO2中CO
B.用过量的FeSO4溶液除去Zn中的Fe
C.用过量的NaOH除去CaCl2溶液中HCl
D.用过量HCl溶液除去Cu中CuO
()4.(11无锡)除去下表所列物质中含有的杂质,所用试剂和操作方法均正确的是
()5.(11泰州)除去下列物质中括号内少量杂质的方法,合理的是
A. CaO(CaCO3):加入足量的稀盐酸
B. CO2 (CO ):在氧气中点燃
C. H2 (HCl 、 H2O):把混合气体通过盛有足量生石灰和烧碱混合固体的干燥管
D.KNO3(K2SO4):溶解,加入过量的硝酸钡溶液、过滤
()6.(09南通)下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
A. NaCl( Na2CO3 ):加入足量稀盐酸、蒸发、结晶
B. CaCl2 ( CaCO3 ) :加入足量稀硫酸、蒸发、结晶
C. Fe (Cu) :加入足量稀盐酸、过滤、洗涤、干燥
D. MnO2 (KCl):加入足量的水溶解、过滤、洗涤、干燥
()7.(09扬州)下列除杂试剂选用正确的是
()8.(09连云港)除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
()9.(09淮安)除去下列物质中少量的杂质,所用方法错误的是
()10.(09盐城)下表中,除去物质中所含少量杂质的方法错误的是
()11.(09泰州)为了除去物质中杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是
A CO
2(
CO)O2点燃
B Cu(Fe)稀盐酸加入稀盐酸充分反应
后过滤、洗涤
C CuSO
4溶
液(H2SO4)氧化铜加入氧化铜粉末充分
反应后过滤
D 盐酸(H
2SO4
)硝酸钡
溶液
加入硝酸钡溶液充分反应后过滤
()12.(11.淄博市)除去下列物质中混有的少量杂质,
所选用的试剂及操作方法不正确
...
的是
序
号
物质杂质(少量)试剂和操作方法
A O2 H
2O
蒸汽通过浓H2SO4
B 稀盐酸稀硫酸加入适量BaCl
2溶液,
过滤
C [来
Na2CO3粉
末
NaHCO3粉末加热
D KNO
3溶液Ba(NO3)2溶液加入适量的Na2SO4溶
液,过滤
() 13. (11.湛江市)下列选用的除杂试剂和实验操
作都正确的是(括号内为杂质)
()14.(11.雅安市)下表中,除去物质所含杂质的方法正确的是
()15.(11.襄阳市)下列除去杂质所选择牟试剂错误的是:
物质杂质所选试剂
选
项
A CO2水蒸气浓硫酸
盐酸CaCO3
B CaCl
2溶
液
C Cu CuO 稀盐酸
D NaCl溶
NaOH溶液BaCl2溶液
液
()16.(11达州市)下列各组括号内除杂技的方法或试剂错误的是
A.CO2中混有CO(点燃) B.Cu粉中混有CuO (稀硫酸)
C.CO中混有CO2 (氢氧化钠溶液) D.Cu粉中混有Fe
粉(用磁铁吸引)
()17.(11.德州市)除去下列物质中的少量杂质,所选用的试剂及反应类型均正确的是
()18.(11.无锡市)除去下表所列物质中含有的杂质,所选试剂及操作方法均正确的是
选物杂除去杂质操
项质质所选试剂作方法
A 二
氧化碳
一
氧化碳
氧气
点
燃
B 氯
化钾
碳
酸钾
稀盐酸
蒸
发
C 锌铁稀硫酸
过滤
D 氧
化钙
碳
酸钙
稀盐酸
蒸
发
()19.(11.烟台市)除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
物质杂质
除杂质选用的试剂和操作方法
A CO2CO 通入O
2,点燃
B 二氧化碳
氯化氢气
体
通过氢氧化钠溶液
C Cu(NO3)2溶
液
AgNO3溶液加入过量的铜粉,过滤
D 碳酸钙氯化钙
加入足量的水溶解,过滤、洗涤、干燥
()20.(11.宜宾市)除去下列物质中的杂质所选用试剂或操作方法不正确的一组是
物质所含杂
质
除去杂质的试剂或方法
A CaO CaCO3HCl
B CuO Cu灼烧
C NaOH溶液Na2CO3适量Ca(OH)
2溶
液、过滤
D O2 H2O 干燥
()22.(11.滨州市)除去下列物质中的少量杂质,所用试剂或方法不正确的是
()23.(11.鸡西市)除去下列物质中所含的少量杂质,所选试剂正确的是
选
项
物质所含杂质除杂质试剂
A 碳酸钠氯化钾适量的水
B 氧化钙碳酸钙稀盐酸
C 硫酸亚铁
溶液
硫酸铜溶液过量的铁粉
氯化钾溶液稀盐酸过量的碳酸
钠溶液。
