化学流程题知识点总结含答案
化学工业流程题必背知识点

化学工业流程题必背知识点一、原料预处理阶段。
题1:工业流程中对矿石进行粉碎的目的是什么?(人教版教材相关知识点:化学反应速率的影响因素)- 答案:增大反应物的接触面积,使反应更充分,加快反应速率。
- 解析:矿石粉碎后,固体颗粒变小,与其他反应物(如酸、碱等)接触的机会增多。
根据化学反应速率的理论,反应物接触面积越大,反应速率越快。
在工业生产中,加快反应速率可以提高生产效率。
题2:在处理含硫矿物时,有时会进行焙烧操作,这一步的主要作用是什么?(人教版教材相关知识点:氧化还原反应)- 答案:将矿物中的硫化物转化为氧化物,便于后续的处理(如酸浸等),同时可能会产生有用的气体(如SO₂可用于制硫酸等)。
- 解析:例如对于黄铜矿(CuFeS₂)的焙烧,反应方程式为4CuFeS₂ + 11O₂= 4Cu₂S+2Fe₂O₃+8SO₂。
通过焙烧,硫元素被氧化为SO₂,金属元素转化为更易处理的氧化物或硫化亚铜等形式。
这一过程是基于氧化还原反应原理,利用氧气将低价态的硫氧化到较高价态。
题3:如果原料中含有油污,通常会用什么试剂进行除油处理?(人教版教材相关知识点:油脂的性质)- 答案:热的纯碱溶液。
- 解析:油脂在碱性条件下能发生水解反应,生成可溶于水的高级脂肪酸盐和甘油。
热的纯碱溶液中,碳酸钠水解使溶液呈碱性:Na₂CO₃ + H₂O ⇌ NaHCO₃+ NaOH,能够有效地除去油污。
二、反应条件控制。
题4:在工业合成氨的流程中,为什么要控制反应温度在500℃左右?(人教版教材相关知识点:化学平衡移动原理)- 答案:从反应速率和化学平衡两个方面考虑。
温度越高,反应速率越快,但合成氨反应N₂(g)+3H₂(g)⇌2NH₃(g) ΔH < 0是放热反应,温度升高会使化学平衡逆向移动,导致氨的产率降低。
500℃左右时,催化剂(铁触媒)的活性最高,能在保证一定反应速率的同时,得到相对较高的氨产率。
- 解析:根据化学平衡移动原理,升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。
化学流程题常考知识点

化学流程题常考知识点一、知识概述《化学流程题常考知识点》①基本定义:化学流程题就是把化工生产过程中的主要操作步骤用框图形式表示出来,让我们根据这个流程去分析反应原理、物质变化、实验操作等一系列的化学问题。
就像给你画了一张工厂制作东西的流程图,然后让你搞明白这图里每个环节的化学门道。
②重要程度:在化学学科里超重要的。
这类型题能把我们学过的各种化学知识,比如元素化合物、化学反应原理、化学实验等都串起来。
是考查我们综合运用化学知识能力的利器,在各种化学考试里都是“座上宾”。
③前置知识:得先掌握化学基本概念,像元素化合价、酸碱盐的性质之类的。
化学方程式肯定要很熟,还有化学实验的基本操作,比如过滤、蒸发、蒸馏等。
就好比你想当厨师做菜(做化学流程题),也得先学会切菜(掌握基本概念)、认识食材(熟知元素化合物)、会用炉灶(化学方程式熟练)、知道一些烹饪技巧(化学实验操作)吧。
④应用价值:现实中化学工业生产到处都是流程,懂这东西有助于理解工厂里是怎么制作各种产品的。
比如制药、精炼金属啥的。
从学习角度说,能让我们把碎片化的化学知识串成一个整体,形成知识网络,而不是东一榔头西一棒槌地学。
二、知识体系①知识图谱:在化学学科里算是站在各个化学知识交汇的路口。
与元素化合物知识相连,因为流程里各种物质的转变涉及元素化合物性质;和化学反应原理挂钩,像反应的条件往往和平衡移动、化学反应速率有关系;还和化学实验这块有交集,毕竟流程中的操作多数都是实验操作。
②关联知识:和化学平衡、氧化还原反应、电解质溶液等知识关系密切。
比如说有的流程里可能利用化学平衡的原理去调节某个反应的进程,利用氧化还原反应去实现物质的转化,利用电解质溶液知识去分析离子的反应等。
③重难点分析:- 掌握难度:有不小难度,因为要兼顾好多知识。
你得一边分析物质的转化,一边思考反应条件,冷不丁还得考虑实验操作的合理性。
- 关键点:关键是要明确流程的目的是什么,也就是为啥要进行这个流程。
中考化学流程题知识点总结附解析
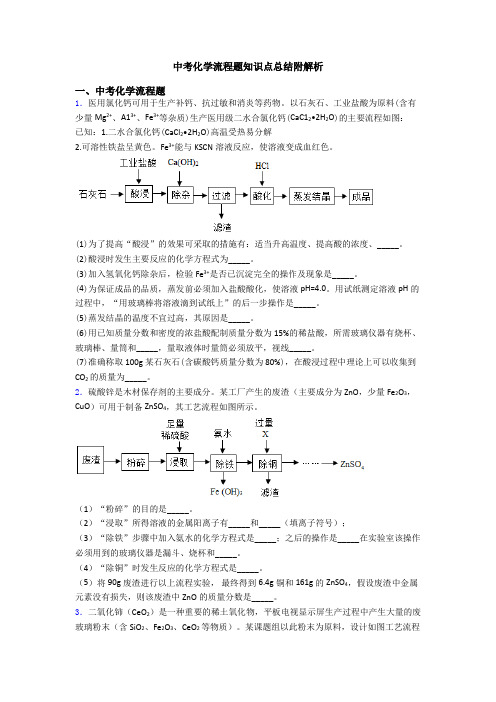
中考化学流程题知识点总结附解析一、中考化学流程题1.医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以石灰石、工业盐酸为原料(含有少量Mg2+、A13+、Fe3+等杂质)生产医用级二水合氯化钙(CaC12•2H2O)的主要流程如图:已知:1.二水合氯化钙(CaCl2•2H2O)高温受热易分解2.可溶性铁盐呈黄色。
Fe3+能与KSCN溶液反应,使溶液变成血红色。
(1)为了提高“酸浸”的效果可采取的措施有:适当升高温度、提高酸的浓度、_____。
(2)酸浸时发生主要反应的化学方程式为_____。
(3)加入氢氧化钙除杂后,检验Fe3+是否已沉淀完全的操作及现象是_____。
(4)为保证成品的品质,蒸发前必须加入盐酸酸化,使溶液pH=4.0。
用试纸测定溶液pH的过程中,“用玻璃棒将溶液滴到试纸上”的后一步操作是_____。
(5)蒸发结晶的温度不宜过高,其原因是_____。
(6)用已知质量分数和密度的浓盐酸配制质量分数为15%的稀盐酸,所需玻璃仪器有烧杯、玻璃棒、量筒和_____,量取液体时量筒必须放平,视线_____。
(7)准确称取100g某石灰石(含碳酸钙质量分数为80%),在酸浸过程中理论上可以收集到CO2的质量为_____。
2.硫酸锌是木材保存剂的主要成分。
某工厂产生的废渣(主要成分为ZnO,少量Fe2O3,CuO)可用于制备ZnSO4,其工艺流程如图所示。
(1)“粉碎”的目的是_____。
(2)“浸取”所得溶液的金属阳离子有_____和_____(填离子符号);(3)“除铁”步骤中加入氨水的化学方程式是_____;之后的操作是_____在实验室该操作必须用到的玻璃仪器是漏斗、烧杯和_____。
(4)“除铜”时发生反应的化学方程式是_____。
(5)将90g废渣进行以上流程实验,最终得到6.4g铜和161g的ZnSO4,假设废渣中金属元素没有损失,则该废渣中ZnO的质量分数是_____。
3.二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。
中考化学流程题知识点总结含答案(1)

中考化学流程题知识点总结含答案(1)一、中考化学流程题1.医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以石灰石、工业盐酸为原料(含有少量Mg2+、A13+、Fe3+等杂质)生产医用级二水合氯化钙(CaC12•2H2O)的主要流程如图:已知:1.二水合氯化钙(CaCl2•2H2O)高温受热易分解2.可溶性铁盐呈黄色。
Fe3+能与KSCN溶液反应,使溶液变成血红色。
(1)为了提高“酸浸”的效果可采取的措施有:适当升高温度、提高酸的浓度、_____。
(2)酸浸时发生主要反应的化学方程式为_____。
(3)加入氢氧化钙除杂后,检验Fe3+是否已沉淀完全的操作及现象是_____。
(4)为保证成品的品质,蒸发前必须加入盐酸酸化,使溶液pH=4.0。
用试纸测定溶液pH的过程中,“用玻璃棒将溶液滴到试纸上”的后一步操作是_____。
(5)蒸发结晶的温度不宜过高,其原因是_____。
(6)用已知质量分数和密度的浓盐酸配制质量分数为15%的稀盐酸,所需玻璃仪器有烧杯、玻璃棒、量筒和_____,量取液体时量筒必须放平,视线_____。
(7)准确称取100g某石灰石(含碳酸钙质量分数为80%),在酸浸过程中理论上可以收集到CO2的质量为_____。
2.某电镀厂为减少水污染及节约成本,从含有 CuSO4、 MgSO4、FeSO4的废液中回收重要原料MgSO4和有关金属,工艺流程如图。
请回答:(1)写出步骤①中发生反应的化学方程式:______________。
(2)固体B的成分是______________。
(填写化学式)(3)固体D中加入稀硫酸可以观察到的现象是______________。
(4)若固体B比加入的镁粉质量增加184g,固体D比固体B质量减少112g,则加入的镁粉至少需要______________g。
3.过氧化钙(CaO2)可以作为鱼池增氧剂,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
中考化学流程题知识点总结附解析(5)

中考化学流程题知识点总结附解析(5)一、中考化学流程题1.医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以石灰石、工业盐酸为原料(含有少量Mg2+、A13+、Fe3+等杂质)生产医用级二水合氯化钙(CaC12•2H2O)的主要流程如图:已知:1.二水合氯化钙(CaCl2•2H2O)高温受热易分解2.可溶性铁盐呈黄色。
Fe3+能与KSCN溶液反应,使溶液变成血红色。
(1)为了提高“酸浸”的效果可采取的措施有:适当升高温度、提高酸的浓度、_____。
(2)酸浸时发生主要反应的化学方程式为_____。
(3)加入氢氧化钙除杂后,检验Fe3+是否已沉淀完全的操作及现象是_____。
(4)为保证成品的品质,蒸发前必须加入盐酸酸化,使溶液pH=4.0。
用试纸测定溶液pH的过程中,“用玻璃棒将溶液滴到试纸上”的后一步操作是_____。
(5)蒸发结晶的温度不宜过高,其原因是_____。
(6)用已知质量分数和密度的浓盐酸配制质量分数为15%的稀盐酸,所需玻璃仪器有烧杯、玻璃棒、量筒和_____,量取液体时量筒必须放平,视线_____。
(7)准确称取100g某石灰石(含碳酸钙质量分数为80%),在酸浸过程中理论上可以收集到CO2的质量为_____。
2.某电镀厂为减少水污染及节约成本,从含有 CuSO4、 MgSO4、FeSO4的废液中回收重要原料MgSO4和有关金属,工艺流程如图。
请回答:(1)写出步骤①中发生反应的化学方程式:______________。
(2)固体B的成分是______________。
(填写化学式)(3)固体D中加入稀硫酸可以观察到的现象是______________。
(4)若固体B比加入的镁粉质量增加184g,固体D比固体B质量减少112g,则加入的镁粉至少需要______________g。
3.过硫酸氢钾复盐(K2SO4·KHSO4·2KHSO5)易分解,易溶于水,可用作漂白剂、NO x、SO2等废气脱除剂。
中考化学流程题知识点总结附解析(1)

中考化学流程题知识点总结附解析(1)一、中考化学流程题1.利用某工业废弃固体(成分为Cu2S和FeS2)制备硫酸铜溶液和硫酸亚铁晶体,流程如图所示。
(已知:①固体B含有氧化铜、氧化铁②铁能与硫酸铁反应,生成硫酸亚铁)(1)操作I是_____。
为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以采取的具体措施有_____(写一条)。
(2)写出FeS2在空气中灼烧的化学方程式_____。
(3)溶液C中的溶质有_____(用化学式表示)。
(4)试剂y的作用是_____。
2.为了除去粗盐中CaC12、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:(1)以上操作中所发生反应的基本反应类型是_____________。
(2)操作①、③、⑤要用到同一种玻璃仪器,它的名称是_____________,该仪器在操作⑤中的作用是_____________。
(3)请设计实验方案证明操作③所得溶液中含有NaOH。
(写出实验步骤和现象)_____________。
3.食盐是一种重要的化工原料。
粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质,将粗盐进行精制的流程如下图:(1)过量X(纯净物)溶液中的溶质是_________________。
(2)加入过量稀盐酸的目的可以除去滤液中过量的碳酸钠溶液,还有一个作用是_______(用化学方程式表示。
)(3)在操作III中玻璃棒的作用是什么___________?4.氯化亚铜(CuC1)是一种工业催化剂,不溶于水、乙醇(沸点是78.2℃)及稀硫酸熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色。
以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如图:(1)反应I加入过量A溶液中溶质的化学式是___反应I中加入①②③三种试剂的顺序还可以是___(填写一种即可)。
(2)反应Ⅱ过程中发生中和反应的化学方程式是___。
中考化学流程题知识点总结附解析(3)

中考化学流程题知识点总结附解析(3)一、中考化学流程题1.过硫酸氢钾复盐(K2SO4·KHSO4·2KHSO5)易分解,易溶于水,可用作漂白剂、NO x、SO2等废气脱除剂。
某研究小组制备过硫酸氢钾复盐的流程如图:(1)已知H2O2,受热易分解,请写出化学方程式_____。
(2)在“转化”操作前,需先用冰水冷却双氧水,可能的原因是_____“转”化”过程中,浓硫酸与H2O2,发生反应生成过硫酸(H2SO5),写出该变化的化学反应方程式_____。
(3)用无水乙醇取代蒸馏水洗涤沉淀,目的是_____和便于干燥,烘干时用红外灯低于40℃,可能的原因是_____。
(4)过硫酸氢钾复盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示。
则该过程适宜的条件是_____。
2.食盐是一种重要的化工原料。
粗盐中常含有少量的CaCl2、MgCl2、Na2SO4等杂质,将粗盐进行精制的流程如下图:(1)过量X(纯净物)溶液中的溶质是_________________。
(2)加入过量稀盐酸的目的可以除去滤液中过量的碳酸钠溶液,还有一个作用是_______(用化学方程式表示。
)(3)在操作III中玻璃棒的作用是什么___________?3.NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣[除含镍外,还含有Cu、Fe、Fe2O3、铬(Cr)等杂质]为原料浸出获得。
工艺流程如图:已知:①已知Ni和Cr是位于氢以前的金属;②H2O2溶液有比较强的氧化性;③NiSO4·6H2O难溶于乙醇,受热易分解;④25℃时,几种金属氢氧化物完全沉淀的pH 范围如下表所示。
Fe(OH)2Fe(OH)3Cr(OH)3Ni(OH)2完全沉淀pH≥9.6≥3. 2≥5. 6≥8.4请回答下列问题:(1)操作A是____,下列措施可行,且能提高废渣浸出速率的有________ (填编号)。
中考化学流程题知识归纳总结含答案

中考化学流程题知识归纳总结含答案一、中考化学流程题1.黄铜矿(主要成分 CuFeS2)经初步处理后,所得溶液中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与所得溶液反应,制取还原铁粉并回收铜.主要步骤如图所示:(1)Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4,其中 x、y、z 为化学计量数,z 的值为_____.(2)操作Ⅰ的名称是_____,此操作中起到引流作用的仪器是_____.(3)步骤Ⅰ中,生成铜的化学方程式:_____.(4)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是_____.(5)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是_____(填化学式).(6)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3FeO Fe,实际作还原剂的是 CO.写出“焙烧”过程中各步反应的化学方程式:①FeCO3加热FeO+CO2↑②_____.2.有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:(1)M溶液中的溶质是什么_____?(2)请设计实验证明滤液Ⅱ中除KCl外的其他溶质_____。
(写出实验步骤和现象)(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个可使KCl质量增加的化学方程式_____。
3.NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣[除含镍外,还含有Cu、Fe、Fe2O3、铬(Cr)等杂质]为原料浸出获得。
工艺流程如图:已知:①已知Ni和Cr是位于氢以前的金属;②H2O2溶液有比较强的氧化性;③NiSO4·6H2O难溶于乙醇,受热易分解;④25℃时,几种金属氢氧化物完全沉淀的pH 范围如下表所示。
Fe(OH)2Fe(OH)3Cr(OH)3Ni(OH)2完全沉淀pH≥9.6≥3. 2≥5. 6≥8.4请回答下列问题:(1)操作A是____,下列措施可行,且能提高废渣浸出速率的有________ (填编号)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学流程题知识点总结含答案一、中考化学流程题1.高氯酸钠晶体(NaClO4·H2O)可用于制备高氯酸。
粗盐除去泥沙等不溶性杂质后得到“精盐”(只含MgCl2、CaCl2两种杂质)。
以“精盐”为原料制备高氯酸钠晶体的流程如下:(资料)高氯酸钠在较高温度下易分解。
请回答下列问题:(1)滤液中溶质除NaCl外还含有___________。
(2)ClO2中氯元素的化合价是___________。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,该反应的化学方程式为___________。
(4)“气流干燥”时,温度应控制在75°C~95°C,其原因是___________。
2.稀土金属因其独特的性能而被誉为“新材料之母”。
稀士金属镧的氧化物([La2O3)广泛应用于军事、民用、医疗等领域,其颗粒大小决定了产品的质量。
利用独居石(含La2O3等金属氧化物及P2O5、SiO2等非金属氧化物)生产超细La2O3颗粒的一种工艺如下:(1)“酸溶”过程中,La2O3与稀硫酸反应的化学方程式是_____;(2)通过调节滤液1的pH,可将镧的盐溶液转化为镧的氢氧化物并以沉淀的形式析出,该反应的化学方程式是_____;(3)“调pH”时加入烧碱溶液使溶液的 pH_____(填“增大”、“减小”或“不变”);(4)将镧的氢氧化物固体溶于稀硝酸,可得到硝酸镧溶液,该反应的化学方程式是______。
(5)实验室使用加柠檬酸作燃料的方法,在马福炉中进行硝酸镧的煅烧,马福炉的温度设置只能为100℃的整数倍。
为获得适当大小的氧化镧颗粒,某小组研究了条件对产品粒径的影响,相关数据如下:实验编号123456789硝酸镧浓度(g/L)165330495165165165165165165煅烧温度/℃700700700600800900700700700煅烧时间/h1111110.523氧化镧粒径/nm426375不纯65803875133①实验1、5、6研究的结论是:其它实验条件相同时,______;②分析以上数据可知,若将实验条件变更为以下条件:硝酸镧浓度165g/L,煅烧温度700℃,煅烧1.5h,则氧化镧粒径最有可能的数值为_____(填序号);A 30nmB 50nm C.80nm D 110nm③要获得更小粒径的高纯氧化镧,在上述最佳条件的基础上,研究方向可以是____。
A 增加硝酸镧浓度B 降低硝酸镧浓度C 升高煅烧温度D 降低煅烧温度E 增加煅烧时间F 减少煅烧时间3.Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的氟化氢(HF)气体,写出AlF3发生反应的化学方程式:_________,该化学反应属于____________反应(填写基本反应类型)。
(2)滤渣B的主要成分是____________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。
除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如图所示。
随着温度升高最终Li2CO3的产率逐渐减小的原因是_____________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是____________。
进行过滤操作需要的玻璃仪器有玻璃棒、______________、_______________,玻璃棒的作用是______________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的化学方程式为_________________。
4.用蛇纹石(主要含3MgO﹒2SiO2﹒2H2O、FeO、Fe2O3、A12O3及少量Cr2O3)制取MgO的工艺流程如图:(1)已知该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:金属Fe3+Al3+Cr3+Fe2+Mg2+离子开始1.6 3.3 3.8 6.59.4沉淀pH沉淀3.2 5.2 6.89.712.4完全pH(3)SiO2不和酸发生反应,Cr2O3和Fe2O3性质相似。
回答下列问题:(1)“酸浸”时,当蛇纹石矿粉粒度一定、硫酸的浓度,活化剂用量及液固比一定时,提高浸取率还可采取的措施是_______(列举1条);“酸浸”时发生反应的化学方程式为_______(只写一个)。
(2)“净化”过程包括“氧化“和“沉出杂质”两步骤。
①实现固液分离的操作是_______,该操作中玻璃棒的作用_______。
②硫酸镁粗品中含有的阳离子是_______,加入双氧水酸性溶液“氧化”被氧化的离子是_______。
③“沉出杂质”加氨水时,应控制溶液pH 的范围是_______,原因是_______。
(3)用2.76t 该蛇纹石(3MgO∙2SiO 2∙2H 2O 含量为80%)原料按以上流程制取MgO ,制取过程中Mg 无损耗,可以制得MgO 的质量是_____?(写出计算过程)5.国产航母“山东舰”威武入列,标志我国金属材料制造技术取得重大突破。
(1)“山东舰”是由多块巨大的特种钢板焊接而成。
工人师傅常用氧炔焰焊接钢板,乙炔(C 2H 2)在氧气中完全燃烧的化学方程式是____________。
(2)钛合金可用于制作舰载机的起落架,构成金属钛的微粒是___________(填“分子”“原子”或“离子”),如图是以钛酸亚铁(FeTiO 3)为原料制取钛(Ti )的部分流程示意图:①FeTiO 3中钛元素的化合价为_________价。
②过程Ⅱ使用CO 和H 2合成甲醇(CH 3OH )时,应调节原料中CO 和H 2的分子个数比是____________。
过程Ⅲ中,在800℃的条件下冶炼钛的化学方程式是________________。
(3)金属防锈常用电镀的方法,电镀防锈的原理是_____________。
(4)某电镀厂的废液中含有硝酸银和硝酸铜,兴趣小组的同学在实验室探究回收该废液中的金属。
将一定量铁粉加入到盛有一定量废液样品的烧杯中,充分反应后过滤,得到滤渣A 。
向滤渣A 中加入少量稀盐酸,有气泡产生。
据此分析,滤渣A 的成分是_____________(写化学式)。
6.废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。
化学兴趣小组为回收其中的铜,设计并进行了如下实验。
已知:222442Cu H O H SO =CuSO 2H O +++ ;不考虑金、银发生类似反应。
(1)电路板粉碎成粉末的目的是___________;(2)滤液 A 中的溶质除硫酸外,还有___________、___________ (填化学式);(3)步骤Ⅱ中的实验现象是:固体部分溶解, ___________;(4)步骤Ⅲ中反应的主要化学方程式是___________;(5)上述步骤 ___________(选填步骤编号)所包含的反应体现铁的活动性比铜强;(6)步骤Ⅳ中反应的化学方程式是___________;判断步骤Ⅳ中加入的稀硫酸过量的方法是___________ 。
7.铁红(Fe2O3)是一种红棕色难溶于水的粉末,广泛应用于制造油漆、油墨、橡胶等。
利用硫铁矿烧渣(主要成分Fe2O3、Fe3O4等)制备铁红的一种工艺如下:(1)“焙烧”过程中,铁元素的化合价_______(填“升高”或“降低”或“不变”);气体a的主要成分能够燃烧,它的相对分子质量为_________。
(2)“酸溶”过程中加入酸的溶质是_______(填化学式),气体b的化学式为_______。
(3)“操作A”的名称是____________,需要用到的铁制仪器为________________。
(4)“沉铁”过程中除生成(NH4)2SO4外,还生成_______气体(填化学式)。
(5)补充完整“煅烧”过程中的化学方程式:4 FeCO3 + ____高温______ + 4 CO2。
(6)组成铁红的非金属元素和金属元素的质量之比为________________________。
8.地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.同学们在学习过程中得知:工业上把海水晒制后得到的晶体称为粗盐,剩余的液体称为苦卤,小亮等同学对海水晒盐后的苦卤产生了浓厚的兴趣.查阅资料得知:①苦卤中含有氯化镁、氯化钠、溴化钾、氯化钾等;②可以综合利用海水资源制备金属镁,如图是化工厂利用苦卤生产镁的流程,工业上为了使海水中的MgCl2完全反应,要加入过量的石灰乳.(1)操作a的名称是______,在实验室中进行此项操作,其中玻璃棒的作用是____.(2)操作a后得到的溶液A的pH_____7(填“<、=、>”);(3)步骤②中发生反应的化学反应方程式:__,石灰乳参加化学反应的化学反应方程式___.(4)海水中提取MgCl2时,经历了“MgCl2—Mg(OH)2—MgCl2”的转化过程,这样做的目的是____。
9.硫酸锌是木材保存剂的主要成分。
某工厂产生的废渣(主要成分为ZnO,少量Fe2O3,CuO)可用于制备ZnSO4,其工艺流程如图所示。
(1)“粉碎”的目的是_____。
(2)“浸取”所得溶液的金属阳离子有_____和_____(填离子符号);(3)“除铁”步骤中加入氨水的化学方程式是_____;之后的操作是_____在实验室该操作必须用到的玻璃仪器是漏斗、烧杯和_____。
(4)“除铜”时发生反应的化学方程式是_____。
(5)将90g废渣进行以上流程实验,最终得到6.4g铜和161g的ZnSO4,假设废渣中金属元素没有损失,则该废渣中ZnO的质量分数是_____。
10.粗盐水含有少量的MgCl2、CaCl2、MgSO4等杂质。
下图所示为粗盐水获取较纯净精盐的一种方法。
(1)为除去 MgCl2, CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是_______________A.NaOH、BaCl2、Na2CO3B.Ba(NO3)2、Na2CO3、NaOHC.Na2CO3、BaCl2、NaOHD.BaCl2、NaOH、Na2CO3(2)操作Ⅰ加入各物质均过量的目的是什么?___________(3)如何验证操作Ⅱ所得溶液中含有氢氧化钠?___________11.氢氧化镁是一种重要的化工原料。
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图。
