九年级化学工业流程题经典题目汇编(含答案)
中考化学工业流程题分类(含答案)

中考化学工业流程题练习1、从题干中获取有用信息,了解生产的产品2、分析流程中的每一步骤,从几个方面了解流程:A.反响物是什么 B.发生了什么反响 C.该反响造成了什么后果,对制造产品有什么作用关键——实验原理、装置原理、操作原理三结合〔抓住一个关键点:一切反响或操作都是为获得产品而效劳。
〕 解此类题的考前须知 1、从绿色化学方面作答:对综合生产效益有何影响?如原料本钱,原料来源是否广泛、是否可再生,能源本钱,对设备的要求,环境保护。
2、常见文字表达套路〔1〕从溶液中得到晶体:蒸发浓缩-冷却结晶-过滤-〔洗涤〕-烘干〔2〕在写某一步是为了除杂时,要注明“是为了除去某某杂质〞,只写“除杂〞等一类万金油式的答复是不给分的。
一、海水资源的多重利用1.制盐工业:通过海水晾晒可得粗盐,粗盐除NaCl 外,还含有MgCl 2、CaCl 2、Na 2SO 4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:过滤BaCl NaOH Na 蒸发、结晶、烘干粗盐溶解22CO 3HCl沉淀滤液精盐过量④过量过量①②③⑤⑥⑦〔1〕在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
〔2〕第②步操作的目的是除去粗盐中的 〔填化学式,下同〕,第⑥步操作的目的是除去滤液中 。
〔3〕第⑤步“过滤〞操作中得到沉淀的成分有:泥沙、BaSO 4、Mg(OH)2、 〔填化学式〕。
〔4〕在第③步操作中,选择的除杂的试剂不能用KOH 代替NaOH ,理由是 。
〔5〕在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由是_____________________________________________________________________;〔6〕在利用粗盐制备精盐过程的第⑥步操作中,参加适量盐酸的目的是___________。
2.金属镁的冶炼海水中含有丰富的氯化镁。
以下图是从海水中提取镁的简单流程。
中考化学流程题题汇编含答案
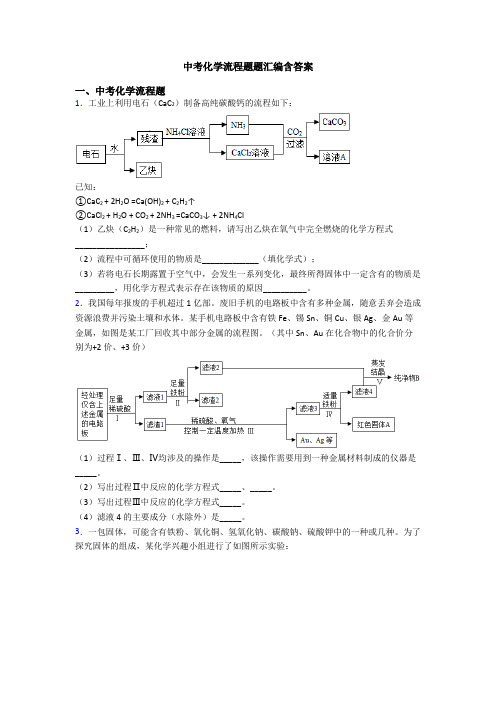
中考化学流程题题汇编含答案一、中考化学流程题1.工业上利用电石(CaC2)制备高纯碳酸钙的流程如下:已知:①CaC2 + 2H2O =Ca(OH)2 + C2H2↑②CaCl2 + H2O + CO2 + 2NH3 =CaCO3↓ + 2NH4Cl(1)乙炔(C2H2)是一种常见的燃料,请写出乙炔在氧气中完全燃烧的化学方程式________________;(2)流程中可循环使用的物质是_____________(填化学式);(3)若将电石长期露置于空气中,会发生一系列变化,最终所得固体中一定含有的物质是_________,用化学方程式表示存在该物质的原因__________。
2.我国每年报废的手机超过1亿部。
废旧手机的电路板中含有多种金属,随意丢弃会造成资源浪费并污染土壤和水体。
某手机电路板中含有铁Fe、锡Sn、铜Cu、银Ag、金Au等金属,如图是某工厂回收其中部分金属的流程图。
(其中Sn、Au在化合物中的化合价分别为+2价、+3价)(1)过程Ⅰ、Ⅲ、Ⅳ均涉及的操作是_____,该操作需要用到一种金属材料制成的仪器是_____。
(2)写出过程Ⅱ中反应的化学方程式_____、_____。
(3)写出过程Ⅲ中反应的化学方程式_____。
(4)滤液4的主要成分(水除外)是_____。
3.一包固体,可能含有铁粉、氧化铜、氢氧化钠、碳酸钠、硫酸钾中的一种或几种。
为了探究固体的组成,某化学兴趣小组进行了如图所示实验:(1)该实验中生成红色固体乙的化学方程式为_______。
(2)该实验过程中加入过量试剂D后,观察到_______现象时,可得出结论:原溶液中一定没有氢氧化钠,一定含有_______。
(3)通过上述实验无法判断的物质是____,为确定该物质可另补充实验操作是____。
4.华为公司作为我国高科技的代表,一直致力于核心技术的研发。
2019年,华为公司推出了5G商用芯片。
制造芯片需要用到高纯硅,工业上利用二氧化硅制备高纯硅的一种工艺流程如下图所示。
工业流程题九年级化学上册

工业流程题九年级化学上册
工业流程题是九年级化学上册中的一个重要题型,主要考察学生对于化学知识的理解和应用能力。
以下是一个工业流程题的示例:
题目:从海水中提取镁的步骤如下:
1. 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳。
2. 将石灰乳注入到海水沉淀池中经过沉降、过滤、洗涤得到光亮氢氧化镁。
3. 在氢气中加热氢氧化镁得到氯化镁。
4. 将氯化镁溶液注入到反应池中经过一系列反应得到氢氧化镁。
5. 将氢氧化镁加热得到氧化镁。
6. 将氧化镁电解得到金属镁。
根据上述提取镁的步骤,回答下列问题:
1. 上述步骤中,为了使石灰乳更易溶于水,在制石灰乳时,采用的主要方法是 _______ 。
2. 写出第3步反应的化学方程式 _______ 。
3. 写出第4步反应的化学方程式 _______ 。
4. 写出第5步反应的化学方程式 _______ 。
5. 提取镁的过程中充分利用了什么资源? _______ 。
答案:1. 加热。
2. $Mg(OH)\mspace{2mu}_{2} + 2HCl = MgCl_{2} + 2H_{2}O$。
3. $MgCl_{2} + Ca(OH)\mspace{2mu}_{2} = Mg(OH)\mspace{2mu}_{2} + CaCl_{2}$。
4. $Mg(OH)\mspace{2mu}_{2} = MgO + H_{2}O$。
5. 海洋资源。
初三化学工业流程专项训练(有答案)
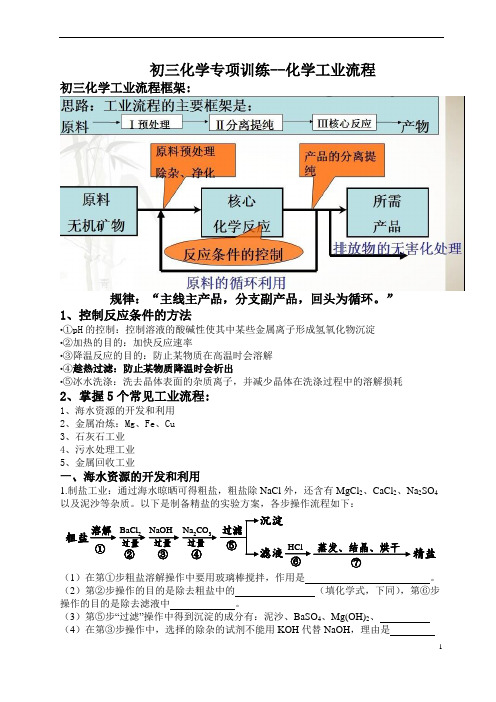
初三化学专项训练--化学工业流程初三化学工业流程框架:规律:“主线主产品,分支副产品,回头为循环。
”1、控制反应条件的方法•①pH的控制:控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀•②加热的目的:加快反应速率•③降温反应的目的:防止某物质在高温时会溶解•④趁热过滤:防止某物质降温时会析出•⑤冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗2、掌握5个常见工业流程:1、海水资源的开发和利用2、金属冶炼:Mg、Fe、Cu3、石灰石工业4、污水处理工业5、金属回收工业一、海水资源的开发和利用1.制盐工业:通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:Na蒸发、结晶、烘干粗盐溶解BaCl NaOH2CO3HCl精盐过量④过量过量①②③⑥⑦(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是。
(2)第②步操作的目的是除去粗盐中的(填化学式,下同),第⑥步操作的目的是除去滤液中。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是。
(5)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_________ 。
二、金属冶炼:Mg、Fe、Cu例2.金属镁的冶炼海水中含有丰富的氯化镁。
下图是从海水中提取镁的简单流程。
(1)上述提取Mg的过程中,试剂A最好选用(从我市有丰富的石灰石资源考虑)。
沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为。
(2)电解无水MgCl2可制取Mg,试写出相关的化学方程式。
电解无水MgCl2的过程中能转化为能。
三、石灰石工业例3、用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。
已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+ H2O + CO2===Ca(HCO3)2;b.碳酸氢钙微溶于水,微热易分解:Ca(HCO3)2===== CaCO3↓+H2O+ CO2↑;微热c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
九年级化学工业流程题经典好题汇编(含答案)

九年级化学工业流程题经典好题汇编(含答案)一、 选择题1. (·黄冈)Si 是重要的半导体材料,半导体工业中有一句行话是“从沙滩到用户”,指的是利用沙子(主要成分为SiO 2)制取高纯度的Si 。
已知硅与碳有相似的化学性质,SiHCl 3(三氯氢硅)能与水反应,其工艺流程和主要化学反应如下:第1题① 2C +SiO 2=====高温Si(不纯)+2CO ↑② 3HCl +Si(不纯)=====250~300 ℃SiHCl 3+H 2③ SiHCl 3+H 2=====1 084 ℃3HCl +Si(高纯)下列说法不正确的是( )A. ①的目的是将二氧化硅转化为单质硅B. 物质A 可循环利用C. 整个制备过程必须达到无水无氧D. 反应③中SiHCl 3是还原剂2. (·泰州)“细菌冶金”的原理是利用氧化铁硫杆菌促使黄铁矿(主要成分为FeS 2)氧化成硫酸铁和硫酸,并能为CO 2和H 2O 合成有机物提供能量。
流程如下图,下列说法错误的是( ) 第2题A. 反应①的化学方程式:4FeS 2+15O 2+2X===2Fe 2(SO 4)3+2H 2SO 4,X 为H 2O 2B. 整个流程提高了能量的利用率C. 图中有机物一定不含氧元素D. 氧化铁硫杆菌在反应①中起催化作用二、 填空题3. (·北京)超细碳酸钙可用于生产钙片、牙膏等产品。
利用碳化法生产超细碳酸钙的主要流程示意图如下:第3题(1) 石灰石主要成分的化学式为________________________________________________________________________。
(2) 乳化池中,生石灰与水发生反应,其化学方程式为__________________________。
(3) 过筛的目的是拦截________(填“大于”或“小于”)筛孔直径的颗粒。
(4) 碳化塔中反应的化学方程式为________________________________________________________________________。
(完整版)初三化学工艺流程题题
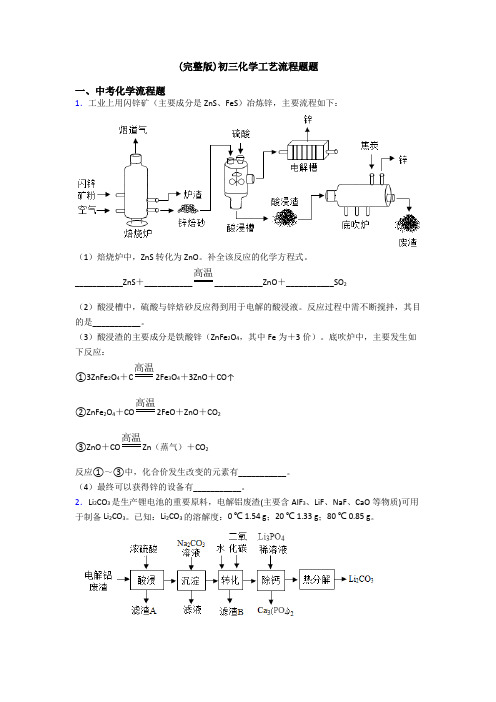
(完整版)初三化学工艺流程题题一、中考化学流程题1.工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:(1)焙烧炉中,ZnS转化为ZnO。
补全该反应的化学方程式。
___________ZnS+___________高温___________ZnO+___________SO2(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的酸浸液。
反应过程中需不断搅拌,其目的是___________。
(3)酸浸渣的主要成分是铁酸锌(ZnFe2O4,其中Fe为+3价)。
底吹炉中,主要发生如下反应:①3ZnFe2O4+C 高温2Fe3O4+3ZnO+CO↑②ZnFe2O4+CO 高温2FeO+ZnO+CO2③ZnO+CO 高温Zn(蒸气)+CO2反应①~③中,化合价发生改变的元素有___________。
(4)最终可以获得锌的设备有___________。
2.Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的氟化氢(HF )气体,写出AlF 3发生反应的化学方程式:_________,该化学反应属于____________反应(填写基本反应类型)。
(2)滤渣B 的主要成分是____________。
(3)“转化”后所得LiHCO 3溶液中含有的Ca 2+需要加入Li 3PO 4除去。
除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li 2CO 3产率的影响如图所示。
随着温度升高最终Li 2CO 3的产率逐渐减小的原因是_____________________。
(4)热分解后,获得Li 2CO 3需趁热过滤的原因是____________。
进行过滤操作需要的玻璃仪器有玻璃棒、______________、_______________,玻璃棒的作用是______________。
九年级化学工业流程题经典题目汇编(含答案)

九年级化学工业流程题经典题目汇编(含答案)一、 选择题1. (·泰安)从海水中制备纯碱和金属镁的流程如下图所示:第1题下列说法错误的是( )A. 流程Ⅰ依次向粗盐水中加入过量Ca(OH)2溶液、Na 2CO 3溶液和适量稀盐酸去除杂质B. 流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳C. 上述流程涉及三种基本反应类型D. 流程 Ⅳ、Ⅴ是通过化学方法富集氯化镁2. 下图是一种吸收废气中SO 2并得到H 2SO 4的方法。
下列说法不正确的是( )第2题A. 电解过程中化学能转化为电能B. 吸收时的反应为Na 2SO 3+SO 2+H 2O===2NaHSO 3C. 阴极区产生的气体X 是O 2D. 该方法可减少酸雨的形成3. (·呼和浩特)黄铁矿的主要成分为二硫化亚铁(FeS 2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如下:第3题下列说法错误的是( )A. 反应②不是置换反应,反应③④为化合反应B. 反应①中各元素的化合价均发生了改变C. 该工业生产过程产生的废气中的SO 2可以用熟石灰溶液吸收D. 向制得的100 g 98%的浓硫酸中加入100 g 蒸馏水,配制49%的稀硫酸4. (·黄冈)金属钨(W)可做白炽灯泡的灯丝。
用黑钨矿[主要含有FeWO 4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:第4题其主要反应原理如下:① 4FeWO 4+4Na 2CO 3+O 2=====高温4Na 2WO 4+2Fe 2O 3+4CO 2② Na 2WO 4+2HCl(热浓)===H 2WO 4+2NaCl③ H 2WO 4=====△H 2O +WO 3④ 3H 2+WO 3=====1 000 ℃W +3H 2O下列说法不正确的是( )A. 反应③属于分解反应B. 反应①②③④的产物都有氧化物C. 反应①④中有元素的化合价发生改变D. 为加快反应的速率,可将黑钨矿石碾成粉末二、 填空题5. (·滨州)建造“辽宁”舰需要大量的金属钛,钛因其密度小,熔点高,常温下耐酸碱,耐腐蚀等优良性能,被誉为“未来金属”。
完整版)中考化学工业流程题(含答案)

完整版)中考化学工业流程题(含答案)中考工业流程题练一、海水资源的多重利用1.制盐工业:海水晾晒后可以得到粗盐,其中除了NaCl 外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:粗盐溶解BaCl2NaOH①过量过量Na2CO3过量②③④过滤⑤沉淀滤液HCl1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是促使粗盐充分溶解。
2)第②步操作的目的是除去粗盐中的杂质,化学式为MgCl2、CaCl2.3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3.4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是NaOH可以使Mg(OH)2和CaCO3溶解,而KOH不能。
5)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序不能颠倒,因为如果先加碳酸钠溶液,会生成碳酸钡沉淀,导致反应失败。
6)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去滤液中的杂质。
2.金属镁的冶炼:海水中含有丰富的氯化镁。
下图是从海水中提取镁的简单流程。
上述提取Mg的过程中,试剂A最好选用Ca(OH)2(从我市有丰富的石灰石资源考虑)。
沉淀B与试剂C发生的是中和反应,沉淀B的化学式为Mg(OH)2,由无水MgCl2制取Mg的化学方程式为Mg(OH)2+2HCl→MgCl2+2H2O+CO2.电解无水MgCl2的过程中能转化为Mg。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液没有什么不同。
3.氨碱工业:海水可以用来制备氨碱。
下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为:XXX→NaCl+CO2↑+H2O,XXX→2NaCl+CO2↑+H2O。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。
如果反过来,二氧化碳的吸收率会降低。
这是因为氨气可以中和掉一部分的H2CO3,使得二氧化碳更容易被吸收。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学工业流程题经典题目汇编(含答案)一、 选择题1. (·泰安)从海水中制备纯碱和金属镁的流程如下图所示:第1题下列说法错误的是( )A. 流程Ⅰ依次向粗盐水中加入过量Ca(OH)2溶液、Na 2CO 3溶液和适量稀盐酸去除杂质B. 流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳C. 上述流程涉及三种基本反应类型D. 流程 Ⅳ、Ⅴ是通过化学方法富集氯化镁2. 下图是一种吸收废气中SO 2并得到H 2SO 4的方法。
下列说法不正确的是( )第2题A. 电解过程中化学能转化为电能B. 吸收时的反应为Na 2SO 3+SO 2+H 2O===2NaHSO 3C. 阴极区产生的气体X 是O 2D. 该方法可减少酸雨的形成3. (·呼和浩特)黄铁矿的主要成分为二硫化亚铁(FeS 2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如下:第3题下列说法错误的是( )A. 反应②不是置换反应,反应③④为化合反应B. 反应①中各元素的化合价均发生了改变C. 该工业生产过程产生的废气中的SO 2可以用熟石灰溶液吸收D. 向制得的100 g 98%的浓硫酸中加入100 g 蒸馏水,配制49%的稀硫酸4. (·黄冈)金属钨(W)可做白炽灯泡的灯丝。
用黑钨矿[主要含有FeWO 4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:第4题其主要反应原理如下:① 4FeWO 4+4Na 2CO 3+O 2=====高温4Na 2WO 4+2Fe 2O 3+4CO 2② Na 2WO 4+2HCl(热浓)===H 2WO 4+2NaCl③ H 2WO 4=====△H 2O +WO 3④ 3H 2+WO 3=====1 000 ℃W +3H 2O下列说法不正确的是( )A. 反应③属于分解反应B. 反应①②③④的产物都有氧化物C. 反应①④中有元素的化合价发生改变D. 为加快反应的速率,可将黑钨矿石碾成粉末二、 填空题5. (·滨州)建造“辽宁”舰需要大量的金属钛,钛因其密度小,熔点高,常温下耐酸碱,耐腐蚀等优良性能,被誉为“未来金属”。
工业上以钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO 3)为原料生产钛,其主要工艺流程如下图所示: 第5题请写出上述工艺流程中镁在高温下与TiCl 4反应生成Ti 和氯化镁的化学方程式:____________________,其基本反应类型是________。
图中X 是一种极易与人体血液中血红蛋白结合的有毒气体,该气体的化学式为________。
6. (·梧州)工业上为提高煤的综合利用,可采用下列流程:第6题(1) 在加压条件下,把二氧化碳通入溶有氨气的饱和食盐水中,最终可制得一种含氯元素的氮肥________(填化学式)和一种水溶液显碱性的盐________(填化学式)。
(2) 写出流程中CO 与H 2转化为C 8H 16的化学方程式:______________________________。
7. (·北京)为保护绿水青山,可将工业残留的钡渣[主要成分为碳酸钡(BaCO 3)]进行无害化处理,制取化工原料:硫酸钡(BaSO 4)。
主要流程如下:第7题已知BaSO 4难溶于水,氯化钡(BaCl 2)可溶于水。
(1) 粉碎钡渣的目的是__。
(2) 反应釜1中的气体X 为________。
(3) 反应釜2中发生复分解反应的化学方程式为____________________。
8. (·苏州)从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:第8题(1) 反应池Ⅰ中用硝酸不用稀硫酸的主要原因是____________________________________________________。
(2) 反应池Ⅱ中加入氨水的目的是____________________________。
(3) 反应池Ⅲ生成碳酸钙的化学方程式是____________________。
(4) 过滤Ⅱ中所得滤液在农业生产中的一种用途是__________。
9. (·镇江)某兴趣小组利用实验室制CO2的废液得到CaCO3和NaCl晶体,过程如下:第9题(1) 试剂X可用________(填序号)。
a. NaOH溶液b. Na2CO3溶液c. K2CO3溶液(2) 操作Ⅰ需要用到的玻璃仪器有________、________和烧杯。
(3) 操作Ⅱ的名称为________。
10. (·宿迁)海洋是人类巨大的资源宝库,下图为从海水中提取金属镁的简易流程图。
(已知:贝壳的主要成分是CaCO3)第10题(1) 海洋中含量最多的物质是________。
(2) 实验室中进行操作1时,玻璃棒的作用是________。
(3) 生石灰转化为石灰乳的过程是________(填“吸热”或“放热”)反应。
(4) 上述流程中未涉及的基本反应类型是________反应。
11. (·杭州)某化工厂利用含有1%~2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。
其部分流程如下:第11题滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理,检验Ba2+的试剂可用____________,洗涤滤渣的主要目的是____________________________。
12. (·娄底)年5月23日至25日,第九届中国卫星导航年会在哈尔滨拉开帷幕,中海达、华大北斗等一批国内企业先后发布了自主研发的北斗芯片产品。
芯片的主要成分是硅,如图是工业上以石英砂(SiO2)为主要原料制取纯硅的方法,请回答以下问题。
第12题(1) 地壳中硅元素的含量仅次于________元素。
(2) 写出反应①的化学方程式:____________________。
(3) 反应②的基本反应类型是____________。
(4) 尾气氯化氢必须收集处理,不能排放到空气中,请简要说明原因:____________________。
13. (·山西)科学精神与社会责任,是化学学科素养更高层面的价值追求。
在一次实践活动中,小红和同学们一起参观了某钢铁公司。
大家对矿石选取、冶铁和炼钢的工艺流程(如图)、生铁和钢的区别等有了全新的认识。
第13题(1) 用赤铁矿石冶铁的反应原理是______________________(用化学方程式表示)。
(2) 分析工艺流程,三脱装置中发生反应的化学方程式是____________________(写一个)。
(3) 向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中________(填一种仪器的名称)的作用。
(4) 在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是________。
14. (·广西北部湾)碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:第14题(1) 为节约成本,过程中的生成物可直接应用于流程的是________,加入过量的盐酸的目的是________________。
(2) 向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中能生成碳酸钡的化学方程式是________________________。
(3) 溶液A中溶质的成分,可能的组合有____________________。
(4) 操作3包括的两个操作是____________。
15. (·乌鲁木齐)CaCl2应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2的流程如下:第15题(1) 氧化铁和盐酸反应的化学方程式为____________________。
(2) 过滤操作中用到的玻璃仪器有烧杯、玻璃棒和________。
(3) 滤液1中的溶质有HCl、FeCl3、MgSO4和________。
(4) 写出滤液1中加入BaCl2发生反应的化学方程式:________________________。
(5) 滤液2中加入Ca(OH)2 可以除去HCl、MgCl2和________。
(6) 滤液3呈碱性,为使溶液pH降低,可加入适量的________。
16. (·广州)氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下:第16题(1) 推测草酸的化学式是________。
(2) “沉锌”过程中发生复分解反应,反应的化学方程式是____________________。
(3) “操作A”的名称是________,实验室常用的研磨仪器是________。
(4) “高温灼烧”时草酸锌分解,反应的化学方程式是________________________。
17. (·重庆A卷)某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。
操作流程如图所示。
第17题(1) 固体A与某酸反应的化学方程式为____________________。
操作②时,当________________即可停止加热。
(2) 固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为________。
(3) 溶液a除了可能含有NaOH外,还一定含有的溶质是________(填化学式)。
18. (·临沂)某工厂附近海水中含有较多Na2CO3等物质。
该工厂采用海水脱硫技术吸收燃煤烟气中的SO2,其主要设备及流程如下:第18题(1) 海水脱硫设备中,排出的海水呈碱性的是________(填字母)。
A. 海水泵B. 吸收塔C. 曝气池①D. 曝气池②(2) 向曝气池①内通入空气后,主要有两个化合反应发生,写出其中一个反应的化学方程式:____________________。
(3) 曝气池②排放的海水中不含H2SO4的原因是____________________(用化学方程式表示)。
19. (·江西)分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭土[主要成分为Al2(Si2O5)(OH)4]、烧碱等为主要原料生产分子筛的工艺流程如下:第19题(1) 步骤①所得烧渣中主要含有两种固体氧化物,分别为SiO2和________(填化学式)。
(2) 步骤②加入NaOH溶液前需将烧渣粉碎,其目的是____________________。
(3) 步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为____________________。
