《硫和氮的氧化物》课件
人教版高中化学高一化学必修一PPT课件硫和氮的氧化物

NO能使人中毒,其原理与CO相似,是通过 呼吸道被人体吸入后与血红蛋白结合生成 一氧化氮血红蛋白,使其失去携带O2的能力, 导致中毒。
2、NO2
(1)物理性质:
一种红棕色、有刺激性气味的有毒气体 密度比空气的大 易液化 易溶于水
(2)化学性质:
3NO2+H2O=2HNO3+NO
实验:请你设计实验,要求尽可能多地使 NO2被水吸收。
*据市场调查,市售一次性筷子 在制作时为了增白、防腐,也是 用硫磺熏蒸,因此多数一次性筷 子含二氧化硫量超标,提醒消费 者使用前先闻一下是否有酸味。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
思考与交流:
SO2能使溴水、KMnO4溶液褪
色与SO2使品红褪色,实质相同吗?
我们知道SO2 和Cl2都具有漂白性。 为了使漂白性更强,有人提出将两 者混合使用,你认为这种做法能达 到预期目的吗?
实验步骤
1 将一支充满 NO2的试管 倒立在盛有 水的水槽中 制取少量的 氧气
现象
解释
红棕色气体逐渐消失, 3NO2+H2O=2HNO3 水位上升,最后充满试 +NO 管的2/3,无色气体充 满试管上部的1/3 2H2O2=2H2O+2O2↑
2
3
将氧气慢慢 无色气体变为红棕色气 2NO+O2=2 NO2 的通入步骤 体,又变为无色气体, 3NO2+H2O=2HNO3 1的试管中 气体体积减少,液面不 +NO 断上升
1.硫 (1)物理性质 黄色晶体,质脆。不溶于水,微溶于 酒精,易溶于二硫化碳。 (2)化学性质
S + O2 == SO2
S + Fe == FeS
△
点燃
二 氧 化 硫 的 化 学 性 质
最新-高中化学 《硫和氮的氧化物》课件 新人教版必修1 精品

79
二氧化硫
Ⅱ
良
乐山大佛开凿于唐玄宗开元初年(公元713年),为 世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛” 是其真实写照,请同学们仔细观察,历经千年时间的
流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?
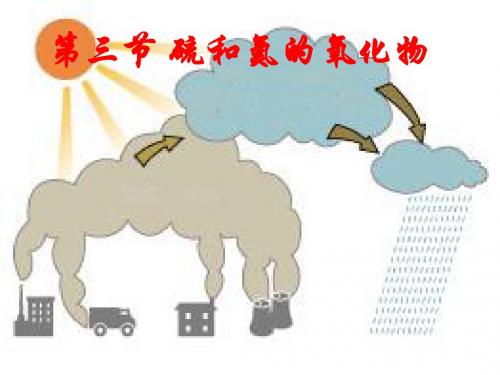
酸雨的危害: 酸雨——“天堂的眼泪”
使湖泊中 鱼虾死亡
破坏露天 文物古迹
破坏土壤成分 使农作物减产 甚至死亡
二 氧
思考与交流
化
硫 SO2能使溴水、KMnO4溶液褪色与SO2使品红
的 褪色,实质相同吗?
化
学 小结:
性
质
不同。前者缘于SO2的还原性,发生的
| 是氧化还原反应。后者缘于其漂白性,发生的
氧 是非氧化还原反应.
化
还
原
性
⑴制造硫酸:
二
催化剂
氧
2SO2 + O2
2SO3
△
化 硫
SO3 + H2O = H2SO4
的
⑵可以漂白纸浆、毛、丝、草编制品等
用
⑶杀灭霉菌和细菌
途
⑷作食物和干果的防腐剂
二、三氧化硫的性质
1、物理性质:
熔点为16.8℃,沸点为44.8℃,常温下不为气体
2、化学性质:酸性氧化物的通性
(1)与水的反应 SO3+H2O=H2SO4(放出大 (2)与碱性氧化物反量应热)SO3+CaO=CaSO4
|
酸
2NaOH+SO2=Na2SO3 +H2O(亚硫酸钠)
性
氧 化
Ca(OH)2+SO2=CaSO3 ↓ +H2O (变浑浊)
物
的 通
【思考3】 SO2与CO2怎样区别? 1
第三讲 硫和氮的氧化物

第三讲硫和氮的氧化物教学难点:可逆反应,二氧化氮与水的反应,二氧化硫的性质。
【知识链接】目前我国空气质量报告主要依据哪些污染物?__、__、_____。
1、二氧化硫的来源:实验室:_S+_O2—;_Cu+_H2SO4(浓)—______;_Na2SO4+_H2SO4(浓)—______工业上:____________工业尾气,_FeS2+_O2—_________。
2、氮氧化物的来源:_NH3+_O2—______;汽车尾气。
一、二氧化硫1、硫,俗称,色粉末2、二氧化硫的物理性质二氧化硫是色、有气味的气体,密度比空气,易,溶于水。
3、二氧化硫的化学性质______________________________________________________________________________。
(1)SO2与水的反应方程式为______________________。
可逆反应:在下,既能向方向进行,同时又能向方向进行的反应。
(2)SO2与NaOH溶液的反应方程式为______________________。
另举两例反应酸性氧化物这一通性的化学反应:________________________________,________________________。
(3)SO2与O2的反应——二氧化硫表现____________性,反应方程式为_____________________。
【注意】工业上制硫酸的反应____________________________,_________________________,_________________。
【思考】硫酸酸雨如何形成?写出反应的方程式________________________________________________________________________(4)SO2或亚硫酸有漂白性:二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色物质,加热又恢复为原来的颜色。
人教版高中化学必修一 高一硫和氮的氧化物 PPT课件
3、与碱性氧化物反应 SO2+CaO=CaSO3
可逆反应:
在相同条件下,既能向正反应进行, 同时又能向逆反应方向进行的化学反应。
SO2 + H2O 正反应
逆反应
H2SO3
H2 在氧气中燃烧生成水,水通电生成 氢气和氧气,是可逆反应吗?
重点城市空气质量日报——日期:2007-12-17
城市 北京 日期 2007-12-17 污染指数 239 首要污染物 可吸入颗粒物 空气质量级别 Ⅳ1 空气质量状况 中度污染
上海
南京 苏州
2007-12-17
2007-12-17 2007-12-17
69
72 62
二氧化硫
二氧化硫 可吸入颗粒物
Ⅱ
Ⅱ Ⅱ
良
良 良
南通
连云港 扬州
2007-12-17
2007-12-17 2007-12-17
44
80 107
---二氧化硫 可吸入颗粒物
Ⅰ
Ⅱ Ⅲ1
优
良 轻微污染
镇江
杭州
2007-12-17
2007-12-17
62
104
二氧化氮
可吸入颗粒物
质
阅读教材
一无二有两易
已知二氧化碳和二氧化硫都是酸性氧化物,依据 酸性氧化物的通性,思考二氧化硫可发生哪些反 应,写出方程式。
第三节 硫和氮的氧化物
学习目标
1、了解硫元素在自然界的存在形式。掌握 SO2、的化学性质。
2、了解SO2对环境的影响,增强环保意识。 3、学会从化合价的角度建构非金属及其化合 物知识。
化学课件《硫和氮的氧化物》优秀ppt21 人教课标版

催化剂
4CO+ 2NO2 === 4CO2 + N2 3、HNO3型酸雨
思考: NO2和水反应的现象?反应生成物是什么? 现象:NO2红棕色消失,液面上升, 但试管中仍然有无色气体 化学方程式:3NO2 + H2O = 2HNO3 + NO 用于工业制硝酸
[思考讨论]
1、造成酸雨的主要气体是什么?如何理解它的 化学性质?
2、如何检验某气体混合物既含二氧化碳又含二 氧化硫气体?请设计实验方案。
3、氯气和二氧化硫气体混合后漂白性更强吗? 为什么?
4、二氧化硫气体实验室中可以怎样制备?
二氧化硫
物理性质 化学性质
无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水
1、与水反应生成酸 SO2 + H2O
第三节
硫和氮的氧化物
第2课时 氮的氧化物
肥西农兴中学 谢守爱
光 化 学 烟 雾
1992年,NO因其神奇的生物活性被美国《科学》 杂志评为该年度的“明星分子”。NO作用的广泛性和作 为信使因子的独特性,使之成为九十年代生物学领域研 究的热点之一。1998年诺贝尔生理学、医学奖授予美国 纽约州立大学的科学家罗伯特·弗奇戈特(Furchgott, R.F.)、德克萨斯大学医学院的弗里德·默拉德 (Murad,F.)和加尼福尼亚大学洛杉矶分校的路易 斯·伊格纳罗(Ignarro,L.J.),以表彰他们发现NO 在心血管系统中的重要作用。三位科学家第一次发现了 气体的信号传递作用,它代表了生物学系统中信号传递 的一种新规律。一氧化氮(NO)是一种广泛存在于机体各 类细胞中独特的生物信使因子和效应因子,参与机体心 血管系统、神经系统、免疫系统等多方面的生理和病理 活动。过多的NO会对机体产生毒性并引起多种疾病。
高中化学必修1 第四章 第三节 硫和氮的氧化物

目录页
Contents Page
@皮皮课件
3
第一章 二氧化硫和三氧化硫
1.1 空气质量报告
• 在空气质量报告的各项指标中,有二氧化硫和二氧化氮的指数。二 氧化硫和二氧化氮是什么?它们从哪儿来?空气是多种物质的混合 体系,为什么要选择这两种污染物?这是一个值得我们探讨的问题。
@皮皮课件
4
第一章 二氧化硫和三氧化硫
点燃
•
SO2
硫(俗称硫磺)是一种黄色晶体,质脆,易研成粉 末。硫不溶于水,微溶于酒精,易溶于二硫化碳。
@皮皮课件
6
第一章 二氧化硫和三氧化硫
1.2 二氧化硫的漂白性实验 • 实验: ① 把盖有胶塞、盛有二氧化硫气体的试管倒立在水 中,在水下面打开胶塞,观察试管内水面的上升。 ② 待水面高度不再变化的时候,在水下用胶塞塞进 试管口,取出试管,用pH试纸测定溶液的酸碱度。 ③ 在试管中保留1/3溶液,滴入1~2滴品红溶液,振 荡,观察颜色变化,加热试管。 ④ 加热试管,再观察。 ⑤ 实验过程中,你是否闻到什么气味? 操作图示
第二章 氧化氮和一氧化氮
2.1 氮气
氮气占空气体积的五分之四左右。
在通常情况下,氮气与氧气不发生反应,但在放电的条件 下,它们却可以直接化合,生成无色的一氧化氮(NO)。 此外在高温条件下,氮气也能与氧气反应生成一氧化氮。
N2 + O2
放电或高温
═══
2NO(无色)
@皮皮课件
16
第二章 氧化氮和一氧化氮
@皮皮课件
9
第一章 二氧化硫和三氧化硫
1.3 小贴士
二氧化硫的漂白作用是由于它能与某些有 色物质生成不稳定的无色物质。这种无色 物质容易分解而使有色物质恢复原来的颜 色。 二氧化硫漂白过的草帽日久又变 成黄色。 二氧化硫和某些含硫化合物的漂 白作用也被一些不法厂商非法用 来加工食品,以使食品增白。
化学课件《硫和氮的氧化物》优秀ppt27 人教课标版3

89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
五、二氧化硫的污染 ⑴ 二氧化硫的来源:
大多的二氧化硫都是因为对含硫矿石的冶炼、对化石燃 料的燃烧、或含硫酸、磷肥等生产的工业废气和机动车辆 的排气 ⑵ 酸雨的形成: ⑶ 酸雨的pH为 <5.6 ,正常雨水的pH为 5.6 ⑷ 酸雨的危害与酸雨的防治
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
SO2+X2+2H2O=4H++SO42—+2X—
二、二氧化硫的性质 2、化学性质
(3) 还原性
b.与化合物反应 SO2 + 2Fe3++ 2H2O = 2Fe2++ SO42—+4H+ 能把+4价的S( SO32— 、 HSO3 — 、 H2SO3 )
氧化的常见氧化剂:KMnO4、Fe3+、HNO3 、
Cl2水等
(4)氧化性
SO2+2H2S=3S+2H2O n(氧化产物):n(还原产物)=2:1
硫和氮的氧化物(第一课时)

硫和氮的氧化物(第一课时)学习目标:1、了解SO2的物理性质和用途,掌握二氧化硫的化学性质,认识SO2的漂白原理。
2、认识可逆反应、了解硫的存在和性质、SO3的性质。
3、培养学生分析、推理能力,通过探究,培养学生对科学研究的态度。
重点难点:1、SO2的物理性质和用途。
2、二氧化硫的化学性质。
3、认识SO2的漂白原理。
学习过程:1、单质硫的物理性质及化学性质有哪些。
2、SO2有哪些物理性质及化学性质。
3、说明SO2的漂白特点及检验方法。
4、归纳常见物质的漂白性5、SO3的化学性质有哪些。
6、什么叫可逆反应,举例说明可逆反应的特点。
当堂检测:1.检验SO2气体中是否混有CO2气体,可采用的方法是()A.通过品红溶液B.通过澄清石灰水C.先通过氢氧化钠溶液,再通过澄清石灰水D.先通过酸性高锰酸钾溶液,再通过澄清石灰水2.能证明SO2具有漂白性的是()A.SO2气体通入紫色的酸性高锰酸钾溶液中,发现溶液紫色褪去B.SO2气体通入品红溶液中,红色褪去C.显红色的酚酞通入SO2后,红色褪去D.SO2气体通入溴水中,橙色褪去4.两份质量同为m g 的硫,分别跟足量的H2、O2充分反应,再将两反应的生成物混合,则反应生成硫的质量为()。
A. 0.5mgB. 1.0mgC. 1.5mgD. 2.0mg5.SO2和H2S两种气体共5mol,混合反应后,测知氧化产物比还原产物多32g,则SO2与H2S的物质的量之比可能为()。
A.1:2B.2:1C.1:4D.3:26、怎样除去除去CO2中的SO2气体。
7、将SO2和Cl2混合漂白效果更好。
判断是否正确并说明理由。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《硫和氮的氧化物》课件
4、 SO2的漂白性
SO2溶于水产生的H2SO3能与某些有色物质
结合成不稳定的无色物质而具有漂白性---
加热可恢复颜色并释放出二氧化硫.
——化合漂白
选择性:不能使紫色石蕊试液褪色 (石蕊变红)
SO3 + 2NaOH = Na2SO4 +H2O
《硫和氮的氧化物》课件
制造硫酸
漂白纸浆、 毛、丝、
草帽
SO2的用途
杀菌、消毒、 干果防腐剂
《硫和氮的氧化物》课件
2.化学性质:
(1)氧化性: Fe + S FeS 2Cu + S Cu2S
可以作为对比氧化性的依据
点燃
(2)还原性:S + O2 === SO2
在氧气中燃烧发出明亮的蓝紫色火焰, 空气中燃烧发出淡蓝色火焰,生成有刺 激性气味的SO2气体。
《硫和氮的氧化物》课件
二、硫的氧化物
+6
SO3 H2SO4 SO42-
只有还原性 既有氧化性也有还原性 只有氧化性
从氧化还原的角度对《硫上和氮的述氧化价物》态课件硫元素性质做预测
一、单质硫
[阅读教材P90] 硫的性质
1.物理性质:黄色晶体,俗称硫黄,质脆,易 研成粉末。不溶于水,微溶于酒精,易溶于 CS2。
可以用CS2来清洗沾满硫的试管。
变化?说明了什么? ▪ ------试管内水位上升;说明SO2易溶水 ▪ 2、用pH试纸检验试管内水溶液酸碱性。 ▪ -------试纸变红色,溶液呈酸性
《硫和氮的氧化物》课件
(二) SO2的化学性质:
1:具有酸性氧化物的通性(类比CO2) (1) 与H2O反应: SO2+H2O H2SO3(亚硫酸)
《硫和氮的氧化物》课件
钙基固硫
+
燃煤烟气中含有SO2为了减少它 的污染排放我们通常在燃煤中 添加一定量的生石灰
SO2 +CaO==CaSO3 (亚硫酸钙)
《硫和氮的氧化物》课件
延伸1
[思考]下列反应是否为可逆反应? (1) CO2+H2O = H2CO3,H2CO3=H2O+CO2↑
是可逆反应 (2) 2H2+O2 点==燃 2H2O,2H2O 通==电 2H2↑+O2↑
研究物质的一般方法是什么? 物理性质:色、态、味、密度、溶解性…… 化学性质: (1)从物质分类角度出发。
(2)从氧化还原性的角度出发。
《硫和氮的氧化物》课件
SO2
▪ (一)、物理性质
SO2
H2O
▪无色、有刺激性气味的有毒气体,密度比空气
大,易液化(沸点为-100C),易溶于水(常温常压
下,1体积水能溶解40体积的二氧化硫,即1:40).
不是可逆反应
《硫和氮的氧化物》课件
从氧化还原角度预测SO2性质
即具有氧化性也具有还原性
《硫和氮的氧化物》课件
2、较强的还原性
催化剂
2SO2 + O2 △ 2SO3
SO2 + Cl2 + 2 H2O = H2SO4 + 2HCl
SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
《硫和氮的氧化物》课件
从物质分类角度预测SO2性质尽可能 多写出对应的化学方程式,可以类比?
与水反应生成对应酸 酸性氧化物 与碱反应生成对应价态盐和水
与碱性氧化物反应生成对应价态盐
实验验证
《硫和氮的氧化物》课件
二氧化硫的性质
▪ 【P84实验4-7:观察并思考】 ▪ 1、 实验中原盛有SO2 气体的试管水位有什么
利用了什么原理? ———强制弱、难挥制易挥 体现了亚硫酸的什么性质? ———弱酸性、不稳定性
《硫和氮的氧化物》课件
SO3 :
无色固体, 熔点(16.8℃)和沸点(44.8℃) 比较低, 是酸性氧化物。
SO3 + H2O = H2SO4
工业生产 H2SO4
与碱性氧化物或碱反应生成硫酸盐
SO3 + CaO = CaSO4
结论:+4价S的化合物(SO2、 H2SO3 、SO32-)都具有较强的还原 性和弱氧化性。
延伸:亚硫酸钠固体储存的时候需要注意什么? 如何检验它已经变质?
《硫和氮的氧化物》课件
(用硫熏蒸的银耳)
在田间大棚里加工白银耳
中央电视台《生活》栏目报到
《硫和氮的氧化物》课件
《硫和氮的氧化物》课件
实验现象:
化学变化 物理吸附
范围
可漂白大多数有 色物质,能使紫 色石蕊褪色
可漂白某些有 色物质,不能 使紫色石蕊试 液褪色
可吸附某些 有色物质的 分子
因强氧化性而具有漂白性的物质有:
HClO Na O H O O 2 2 2 2 《硫和氮的氧化物》课件 3 ClO2 等
4、 SO2的实验室制法
原理:H2SO4 (浓) + Na2SO3 = SO2 ↑ + H2O+ Na2SO4
《硫和氮的氧化物》课件
▪ 让SO2溶解在品红溶液中,品红溶液的红 色褪去;加热后,溶液又恢复红色
▪这是检验SO2重要方法
《硫和氮的氧化物》课件
几种物质的漂白性比较
物质 H2O2、HClO
SO2
木炭
原理
将色素氧化为稳 定的无色物质
与色素结合成 不稳定的无色 物质
将有色物质 的分子吸附 在其表面
实质 化学变化
第三节 硫和氮的氧化物
(第一课时)
《硫和氮的氧化物》课件
1.硫的存在
化 合
游离态 态
硫铁矿(FeS2) 黄铜矿(CuFeS2)
石膏
芒硝
(《C硫和a氮S的O氧4化•物2》H课2件O) (Na2SO4•10H2O)
硫的常见化合价
你能说出哪些对应这些化合价的物质?
-2
0
H2S
S
Na2S
+4
SO2 H2SO3 SO32-
*亚硫酸是一种弱酸,不稳定 (酸性>醋酸>碳酸) 可逆反应: 在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应
(2) 与碱反应 SO2+2NaOH=Na2SO3+H2O (吸收尾气) SO2+2Ca(OH)2=CaSO3 ↓+2H2O(类比CO2)
(3) 与碱性氧化物反应(燃煤污染的治理,钙基固硫)
2KMnO4+5SO2+2H2O=K2SO4 +2MnSO4+2H2SO4
所以:SO2能使氯水、溴水和酸性KMnO4溶液褪色。
《硫和氮的氧化物》课件
3、较弱的氧化性
SO2 + 2 H S = 3 S 2 《硫和氮的氧化物》课件 ↓ + 2 H2O
这样的氧化(还原)性是SO2 特有的? 还是+4价S的化合物都具有的?
