北京大学2017年研究生入学考试试题--物理化学9
2017年普通高等学校招生全国统一考试理综(物理部分)试题(北京卷,参考解析)

绝密★启封并使用完毕前2017年普通高等学校招生全国统一考试理科综合能力测试(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
13.以下关于热运动的说法正确的是A.水流速度越大,水分子的热运动越剧烈B.水凝结成冰后,水分子的热运动停止C.水的温度越高,水分子的热运动越剧烈D.水的温度升高,每一个水分子的运动速率都会增大【参考答案】C14.如图所示,一束可见光穿过平行玻璃砖后,变为a、b两束单色光。
如果光束b是蓝光,则光束a可能是A.红光B.黄光C.绿光D.紫光【参考答案】D【参考解析】由题图可知,a光进入玻璃砖时的折射角较大,因此玻璃砖对a光的折射率较大,因此a光的频率应高于b光,故选项D正确。
15.某弹簧振子沿x轴的简谐振动图像如图所示,下列描述正确的是A.t=1s时,振子的速度为零,加速度为负的最大值B.t=2s时,振子的速度为负,加速度为正的最大值C.t=3s时,振子的速度为负的最大值,加速度为零D.t=4s时,振子的速度为正,加速度为负的最大值【参考答案】AR=Ω的负载16.如图所示,理想变压器的原线圈接在u=2220sin100πt(V)的交流电源上,副线圈接有55电阻,原、副线圈匝数之比为2:1,电流表、电压表均为理想电表。
下列说法正确的是A.原线圈的输入功率为B.电流表的读数为1AC.电压表的读数为D.副线圈输出交流电的周期为50s【参考答案】B【参考解析】电表的读数均为有效值,因此在原线圈两端电压有效值为220V,由理想变压器原副线圈两端电压与线圈匝数成正比,因此副线圈两端电压有效值为110V,故选项C错误;流过电阻R的电流为2A,可知负载消耗的功率为220W,根据能量守恒可知,原线圈的输入功率为220W,故选项A错误;由P=UI可知,电流表的读数为1A,故选项B正确,由交变电流瞬时值表达式可知:ω=100π,因此周期为:T=0.02s,故选项D错误。
2017年北京大学风景园林硕士考研真题、复试真题

城市规划
一.名词解释:
无形的城市化,城市职能,城市金字塔,BRT,希波丹姆模式
二.填空题:
1.城市绿地类型分两类______和______
2.城市土地地理因素包括(5 个),
3.《雅典宪章》的功能分区是受什么思想的影响,
4.城市规划的期限一般是多少年,
5.环状放射性道路是欧洲一般以______组织城市发展的结构
序号
准考证号
1 100016001950076 2 100016001950080 3 100016001950037 4 100016001950088 5 100016001950073
6 100016001950103
7 100016001950093 8 100016001950078 9 100016001950007 10 100016001950124 11 100016001950021
景观设计:专业学科与教育 俞孔坚 中国建筑工业出版社
设计结合自然(译) 麦克哈格 中国建筑工业出版
城市生态学 宋永昌 华东师范大学出版
929 专业综合 1(建筑设计与城市设计基础)
育明教育中国考研考博专业课辅导第一品牌
3
建筑设计初步 王崇杰编 中国建筑工业出版 中国建筑史 潘谷西 中国建筑工业出版 外国近现代建筑史 罗小未 中国建筑工业出版 建筑设计基础 罗文媛编 清华大学出版社 930 专业综合 2(城市规划基础) 城市地理学 周一星 商务印书馆 考研复试:
育明教育中国考研考博专业课辅导第一品牌
2
二、分数线和招生人数解析
育明教育解析:北大建筑与景观设计学院风景园林从 2014 年取消学硕,只招收专业, 2017 年北大又恢复了对于学硕的招收;地理学(景观设计学)招收 5 人,不接受推免, 由于是时隔 3 年重新招生很多考生是抱有畏惧心理的,首先不了解大的出题侧重点出 题方向,报考的人数也不会很多。竞争性也不会太大。但是分数相比专硕肯定是会有 相应的提高,预测会有 5—15 分的差距。下面给大家看下历年专硕的分数,以供大家 参考。如果大家预估自己成绩能到达 350 分就要赶紧投入到复试准备当中了。
北京大学物理化学(含结构化学)历年考研试题共9套!

北京大学1992年研究生入学考试试题考试科目:物理化学(含结构化学) 考试时间:2月16日上午招生专业:研究方向:指导教师:试题:单独考试者不答带“*"号的题答案一律写在答案纸上,在试题纸上答题无效基本常数:Planck常数h=6。
626×10-34JSBoltzmann常数k=1。
381×10-23JK—1Avagadro常数NA=6。
022×10—23mol-1Faraday常数F=9.648×104Cmol—1物理化学部分(共七题,60分)一.(10分)甲苯在正常沸点383K的摩尔气化焓, 。
设甲苯蒸气为理想气体。
(1)求正常沸点下,1mol液体甲苯可逆气化吸的热量Q及对外作的功W。
(2)求正常沸点下,甲苯的,,,。
(3)设甲苯的为常数,请估算甲苯在300K的蒸气压.(4) 将1mol,383K,101.325kPa的液体甲苯,在等温下向真空蒸发,完全变为同温同压下的气体。
请求甲苯的熵变,环境的熵变,并判据该过程是否可逆。
用Gibbs自由能减少原理能否判断该过程的方向性?请说明理由。
二.(8分)(A)对于纯物质均相流体(1)请证明(2)在273.15K-277.15K之间,将液体水绝热可逆压缩,水的温度是升高还是降低?请阐述理由。
(B)物质B与水在任何浓度下都可形成液体混合物。
在298K下,实验测得与χB=0。
100液体混合物达平衡气相中水的分压为2。
92kPa,同温下纯水的蒸气压为17.0kPa。
(1)写出上述液体混合物与气相平衡的所有平衡条件。
(2) 写出液体混合物中水的化学势等温式,并具体指明水的标准状态。
(3)求上述液体混合物中水的活度系数。
要指明计算的依据.三.(8分)FeO和MnO的正常熔点分别为1643K及2058K.在1703K,含有30%和60%MnO(质量%,下同)的两种固溶体及含有15%MnO的熔液平衡共存.在1473K时,有两个固溶体平衡共存,分别含26%及64%的MnO。
北京化工大学硕士研究生入学考试物理化学样题

≤0
αB
自发 平衡
K
∑ C.
µ
α B
dnαB
≤
0
B
自发 平衡
K
∑ D. µBα dnαB ≥ 0 B
自发 平衡
12.
反应
3 2
H
2
(
g
)
+
1 2
N
2
(
g
)
=
NH 3 (g) ,当
H2 因反应消耗了
0.3mol
时,反应进度
ξ
应为:
A.0.1
B.0.3
C.0.5
D. 0.2
13. 理想气体化学反应平衡时 (∆ν ≠ 0),加入惰性气体,平衡不发生移动的条件是:
5.p\=100kPa≈101.325kPa。
一、选择题(50 分) 1. 1mol 理想气体经恒温膨胀、恒容加热和恒压冷却三步完成一个循环回到始态,此过程
气体吸热 20.0kJ。则该过程的 W :
A.= 20.0kJ ;
B.< 20.0kJ ;
C. >20.0kJ ; D.等于其它值。
2. 若要通过节流膨胀达到制冷的目的,则焦耳—汤姆生系数为:
B.4.883×103kJ·mol-1;
C.0.587×103kJ·mol-1 ;
D.其它值
8. 由 2 mol A 和 2 mol B 形成理想液态混合物,已知某温度下 PA* = 90 kPa, PB* = 30 kPa。
则平衡气相摩尔分数之比 yA:yB 为
A. 3:1
B. 4:1
C. 6:1
已知:E\{Ag2SO4/Ag,SO42-}=0.627V, E\{Ag+/Ag}=0.799V。如上电池的 KSP 为:
(完整word版)(整理)北京大学有机化学研究生入学考试试题.
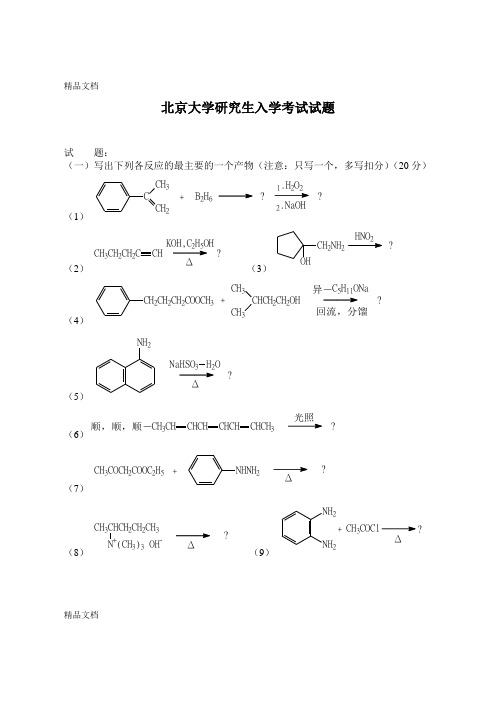
精品文档精品文档北京大学研究生入学考试试题试题:(一)写出下列各反应的最主要的一个产物(注意:只写一个,多写扣分)(20分)(1)CCH3CH2+.H O2.NaOH??B2H6(2)CH3CH2CH2C CHKOH,C H OH?Δ(3)CH2NH2OHHNO?(4)CH2CH2CH2COOCH3CHCH2CH2OHCH3CH3C5H11ONa+?回流,分馏异-(5)NH2NaHSO3H2OΔ?(6)?顺,顺,顺-CH3CH CHCH CHCH CHCH3(7)CH3COCH2COOC2H5+NHNH2Δ?(8)CH3CHCH2CH2CH3N+(CH3)3 OH-Δ?(9)NH2NH2+CH3Δ?精品文档精品文档(10)(浓)CF 3++?H 2SO 4HNO 3(浓)(三)用分子含不多于五个碳原子的开链化合物或不含取代基的芳环化合物作为起始物,和必要的无机试剂,合成以下的化合物。
(25分)(1)HOOCCH 2CHCH 2CH 2COOH COOH(2)CH 3OOCH 3(3)ClBr(5)NNO 2(4)(CH 3)2NNN北京大学研究生入学考试试题(一)完成下列反应(30分,注意:只写一个最主要的产物,多写扣分) (1)HCCCHCH 2+HCl?(2)MeCO 3H??LiAlH 4(3)Me+CH 2CHCCH 3O?Δ(4)HONMe 2+N +N Cl -HOAc NaOAc?精品文档精品文档(5)CCH 3N CH 3PCl 5?(6)CH C OOHOO??Cu(OAc)2HOAc Δ.KOH Δ2.HCl(7)NH O HOAc???HNO 3H 2SO 4PCl(8)HCH 3HOCO 2Me ?Δ(9)C CH COCH 3CH 3CH 3Al(OCHMe 2)3Me 2CHOH?Δ+(10)CH 2CHCH 2N +Me 3 Br -+Br 2?(二)自指定原料合成指定的化合物:(30分,注意:用反应式表示,并注明反应条件) a) 自甲苯和必要的试剂合成4-硝基-2-甲基苯甲腈。
2017年北京有色金属研究总院硕士研究生入学考试专业科目物理化学试题

2017年攻读硕士学位研究生入学考试北京市联合命题
物理化学试题
(请将答案写在答题纸上,写在试题上的答案无效)
一、选择一个正确的答案:(本题共计45分,每小题3分)
1、当理想气体反抗一定的压力作绝热膨胀时,则:___
(A) 焓总是不变; (B) 内能总是增加;
(C) 焓总是增加; (D) 内能总是减少。
2、理想气体从状态Ⅰ等温自由膨胀到状态Ⅱ,可用系统中哪个状态函数的变化来判断该过程的自发性?___
(A) △G;(B) △A;
(C) △S; (D) △H。
3、冬季建筑施工中,为了保证施工质量,常在浇注混凝土时加入盐类,其主要作用是:___
(A) 增加混凝土的强度; (B) 防止建筑物被腐蚀;
(C) 降低混凝土的固化温度; (D) 吸收混凝土中的水分。
4、某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:
H2O(g)+C(s) H2(g) + CO(g)
CO2(g)+H2(g) H2O(g) + CO(g)
CO2(g) + C(s) 2CO(g)
则该系统的独立组分数C为:___
(A) 3; (B) 2; (C) 1; (D) 4。
5、在描述恒沸混合物时,下列各点中哪一点是不正确的?___
(A) 与化合物一样具有确定的组成;
(B) 不具有确定的组成;
(C) 平衡的气相和液相组成相同;
(D) 其沸点随外压的改变而改变。
考试科目:物理化学第1页共5页。
北京化工大学2017年攻读硕士学位研究生入学考试--物理化学试题

北京化工大学2017年攻读硕士学位研究生入学考试物理化学试题注意事项:1.答案必须写在答题纸上,写在试卷上均不给分。
3.答题必须用蓝、黑水笔或圆珠笔,用红笔或铅笔不给分。
4.101.325kPa≈100kPa=p5.作图用铅笔,且作图题答在指定题号的答题纸上。
一、选择题:(10分)1.气体能被液化的条件是:A 、 T=T C , p<p CB 、T>TC ,p ≥p C C 、 T<T C , p<p *D 、1r T ≤,*p p ≥2. 在αβ、两相中均含有A 、B 两种物质,当达到相平衡时下列化学势关系中正确的是()。
A 、**AB μμ= B 、A A αβμμ=C 、 A B αβμμ=D 、 以上都不对3.右图表示理想气体经历的可逆循环示意图,其中AB 是等温膨胀,BC 是等容降温,CD 是等温压缩,DA 是绝热压缩。
试问:下面以不同坐标表示的可逆循环示意图,哪一个图与 p -V 图所表示的循环相同。
4.将固体3NaHCO 放入一抽空的容器中,发生如下化学反应:323222NaHCO ()Na CO ()CO ()H O()s s g g =++达到平衡时,该系统的组分数C 与自由度F 分别为()。
A 、 4,3B 、 2,1C 、3,2D 、 1,05.某化学反应,当温度每升高1K 时,该反应的速率常数a k 增加1%,则该反应的活化能a E 约为()A 、 2RTB 、 1002RTC 、 102RTD 、 0.012RT6.298K 时,0.002mol ⋅kg -1的2CuCl 溶液的平均活度系数1()γ±与同浓度的4CuSO 溶液的平均活度系数2()γ±之间的关系为()。
A 、 1()γ±>2()γ±B 、 1()γ±<2()γ±C 、 1()γ±=2()γ±D 、 无法比较7.下列问题中哪个不能通过电导实验测定得到解决()。
北京市联合命题2017年硕士学位研究生入学考试试题及答案(无机化学)

2017 年攻读硕士学位研究生入学考试北京市联合命题无机化学试题(请将答案写在答题纸上,写在试题上的答案无效)一 选择题 (共30分,每小题2分)1. 实际气体与理想气体接近的条件是 。
[A] 高温高压; [B] 低温高压;[C] 高温低压; [D] 低温低压;2. 下列分子或离子中键长由大到小的顺序正确的是 。
[A] +-2-2222O > O > O > O ; [B] +-2-2222O > O > O > O ;[C] 2--+2222O > O > O > O ; [D] -+2-2222O > O > O > O ;3. 下列元素中,元素原子的核外电子排布3d 全满4s 半充满的是 。
[A] Cr ; [B] Mn ; [C] Fe ; [D] Cu ;4. 主要以原子轨道重叠形成的是 。
[A] 共价键; [B] 离子键; [C] 分子间力; [D]金属键;5. 可逆反应A(g) + B(g)C(g)在密闭容器中进行,如温度不变,将容器体积扩大到原来的3倍,则平衡常数c K 将为原来的 。
[A] 3倍; [B] 9倍; [C] 2倍; [D] 1倍;6. 可以用一种试剂鉴别Ba(OH)2、NaNO 3、NaOH 、HNO 3、BaCl 2五种无色溶液,这种试剂是 。
[A] 3AgNO ; [B] 24Na SO ; [C] 4NH Cl ; [D] 423(NH )CO ;7. 在HNO 3介质中,欲使Mn 2+氧化为-4MnO ,不能选用的氧化剂是 。
[A] 4228(NH )S O ; [B] 227K Cr O ;[C] 2PbO ; [D] 3NaBiO ;8. 废弃的含CN ‒ 溶液不能倒入 。
[A] 含Fe 3+的废液中; [B] 含Cu 2+的酸性溶液中;[C] 含Fe 2+的废液中; [D] 含Cu 2+的碱性溶液中;9. 下列物质中,酸性最强的是 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京大学2017年研究生入学考试试题
考试科目:物理化学(含结构化学)
常数 h=6.6262×10-34J ·S k=1.3807×10-23J ·K -1
F=96485C ·mol -1 c=2.99792×108m ·s -1
一.(14分)
(1) 写出联系实物微粒波性和粒性的关系式; (2) 写出Li 2+的Schrödinger 方程; (3) 写出Pt 原子能量最低的光谱支项; (4) 计算H 原子3d xy 轨道的角动量和磁矩;
(5) 写出+33)en (Co 的点群和全部独立的对称元素;
(6) 写出肽键中的离域π键;
(7) 计算-46)CN (Fe 的配位场稳定化能(以Δ0表示);
(8) 解释分子轨道; (9) 解释绝热电离能。
二.(5分)
计算H 原子1s 电子离核的平均距离。
⎥⎥⎥⎦
⎤⎢⎢⎢⎣⎡=⎪⎪⎭⎫ ⎝⎛π=ψ⎰+--1n ax n r a 1
23
0s 1a !n dx e x ,e a 110 三.(7分)
臭氧分子的键角约为116.8º,若用杂化轨道Ψ=c 1ψ2s +c 2ψ2p 来描述中心氧原子的成键σ轨道,请推算: (1) Ψ的具体形式; (2) ψ2s 和ψ2p 在Ψ中的成分(所占百分数); (3) 被孤电子对占据的杂化轨道的具体形式。
四.(7分)
在某条件下制得A x B y 型离子晶体,该晶体属立方晶系,晶胞参数为1424pm ,晶胞
中A 离子的分数坐标为41,41,41;41,41,43;43,41,41;43,41,43;4
1
,
43,41;41,43,43;43,43,41;43,43,43;21,0,0;0,0,21
;0,21,0;21,21,21。
B 离子的分数坐标为41,41,41;21,21,0;21,0,2
1;0,21,2
1。
(1) 写出该晶体的化学式;
(2) 写出该晶体的特征对称元素; (3) 画出晶胞沿4重轴的投影图;
(4) 指明该晶体的空间点阵型式和结构基元;
(5) 若将该晶体的空间结构看作B 离子作最密堆积,A 离子填入由B 离子形成
的多面体空隙,则A 离子占据何种多面体空隙?占据空隙的分数为多少? (6) 画出离子在(110)面上的排布图;
(7) 用CuK α射线(λ=154.2pm )摄取该晶体的粉末图,下列衍射中哪些不出
现?111,200,220,300,311,222,400,331,420,422 (8) 计算d 311和θ311。
五.(12分)
汞在正常熔点234.28K 时1m l s mol kJ 367.2)K 28.234
(H -θ⋅=∆,设液体汞和过冷液体汞的11m ,P K mol J 28.28C --θ⋅⋅=,
并认为它是常数。
将1mol ,223.15K ,101.325kPa 的过冷液体汞,经绝热等压过程变为234.28K 的液相汞与固体汞的平衡体系,请求算: (1) 1mol 汞体系由始态到终态的焓变; (2) 液体汞变为固体汞的量; (3) 体系汞的熵变及环境的熵变; (4) 体系汞的Gibbs 自由能变(已知)mol K J 210.69)K 15.223,l ,Hg (S 11m --θ⋅⋅=; (5) 上述过程是否为不可逆过程?应用何种判据得到你的结论? 六.(8分)
NaCl ~H 2O 体系定压相 图如右: (1) 分别写出相区A 、
B 、
C 、
D 、
E 中所存在的稳定相; (2) 组成为a 的溶液
降温过程的步冷曲线; (3) 北极爱斯基摩人
根据季节的变换,从海水中取出淡水,根据相图分析
其科学依据; H 2O wt % NaCl ·2H 2O NaCl (4) 如能从海水中取出淡水,试计算一顿海水能取出淡水的最大量是多少?已
知海水的组成为含NaCl2.5%(wt %)三相点时溶液组成含NaCl23.4%(wt %)。
七.(10分)
(1) 反应∑ν=B 0B ,请写出标准平衡常数的统计力学计算公式(注明各符号所代表的物理量); (2) 反应H 2+I 2=2HI 。
已知各分子性质如下:
M/gmol -1 θr /k θv /k D 0/10-19J H 2(g ) 2.016 87.5 5986 7.171 I 2(g ) 253.81 0.0538 306.8 2.470 HI (g ) 127.92 9.43 3209 4.896 其中M 为摩尔质量、θr 为转动特征温度、θv 为振动特征温度、D 0为离解能。
请计算该反应在298K 时的标准平衡常数)T (K P θ。
(3) 实验测得(2)中反应之8.877)K 15.298(K P =θ,若你所求数据与实验数据差别较大,请分析产生差别的原因(不必定量计算)。
八.(6分)
有人认为,在绝热可逆过程中,任何物质B 的均相PVT 封闭体系的焓随温度增高必然增加。
此结论普遍成立吗?请通过论证并举例说明。
已知P T )T V
(T V )P H (∂∂-=∂∂。
九.(10分)
乙醛光解反应历程如下:
CHO CH CHO CH 3h 3+−→−ν
I a 吸收光强
CO CH CH CHO CH CH 3433+→+ k 2 CO CH CO CH 33+→ k 3 6233H C CH CH →+ k 4 (1) 请推倒CO 生成反应速率方程及量子产率; (2) 推导总反应表观活化能与各基元反应活化能之关系。
十.(9分)
用温度跃迁方法研究下列平衡反应:
I -
+I 2
I 3-k b
298时,不同[I -]和[I 2]时测得驰豫时间τ的数据如下: [I -]/10-3mol ·dm -3 [I 2]/10-3mol ·dm -3 τ/ns
0.57 0.36 70.7 3.45 0.14 32.4
求正、逆反应速率常数k f 、k b 及平衡常数K 。
十一. (9分)
T =298K ,P θ时,电解一含Zn 2+溶液,希望当Zn 2+浓度降至1.00×10-4mol ·kg -1
时,仍不会有H 2(g )析出,试问溶液的pH 应控制在何值?已知H 2(g )在Zn (s )上析出的超电势ηH2|Zn =υ可逆-υ不可逆=0.72V ,且设此值与浓度无关。
(V 7628.0Zn
,Zn 2-=Φθ+)。
