化工原理 第五章 气体吸收
化工原理之气体吸收

化工原理之气体吸收气体吸收是化工过程中常用的一种物理操作,它指的是将气体从气相吸收到液相中。
气体吸收广泛应用于环境工程、化工工艺、能源工程等领域,例如废气处理、石油炼制、烟气脱硫等。
一、气体吸收的基本原理气体吸收的基本原理是气体和液体之间的质量传递过程。
气体吸收的过程中,气体溶质分子通过气相和液相之间的传质界面传递到溶液中,从而实现气体从气相到液相的转移。
气体吸收的速度由以下几个因素决定:1.液相溶剂的性质:液相溶剂的挥发性、表面张力、黏度和溶解度等性质都会影响气体吸收的速度。
通常情况下,挥发性较强的溶剂对气体的吸收速率较快。
2.溶剂和气体溶质之间的亲和力:溶剂和气体溶质之间的亲和力越强,气体吸收速度越快。
3.传质界面的面积和传质界面的厚度:传质界面的面积越大,气体吸收速度越快;传质界面的厚度越薄,气体吸收速度越快。
4.溶解度:气体的溶解度越高,气体吸收速度越快。
5.气体浓度梯度:气体浓度梯度越大,气体吸收速度越快。
二、气体吸收的设备常见的气体吸收设备包括吸收塔、吸收柱和吸附塔等。
1.吸收塔:吸收塔是最常用的气体吸收设备之一,它主要由一个塔体和填料层组成。
气体通过底部进入吸收塔,液体从塔顶滴入塔体中。
在填料层的作用下,气体和液体之间的接触面积增加,从而促进气体的传质。
通过提供充分的接触时间和表面积,吸收塔可以实现高效的气体吸收。
2.吸收柱:吸收柱通常用于含有反应过程的气体吸收。
与吸收塔类似,吸收柱也包含一个塔体和填料层。
区别在于,吸收柱还包括一个液相反应器,用于在吸收气体的同时进行反应。
3.吸附塔:吸附塔是另一种常用的气体吸收设备,主要用于吸附分离等工艺中。
吸附过程通过吸附剂将目标气体吸附在其表面上实现。
吸附塔通常由多个吸附层和吸附剂床组成,气体从底部进入吸附塔,经过吸附剂床后,被吸附物质从气相转移到固相中,从而实现气体吸附。
三、气体吸收的应用气体吸收在化工工艺中有着广泛的应用。
1.废气处理:气体吸收是一种有效的废气处理方法,可用于去除废气中的有害污染物,如二氧化硫、氮氧化物等。
化工原理-5章气体吸收

液两相的浓度呈连续变化。如填
溶剂
料塔。
溶剂
规整填料
散装填料
塑料丝网波纹填料 塑料鲍尔环填料
级式接触:气、液两相逐级接 触传质,两相的组成呈阶跃变 化。 如板式塔。
气体
气体
a 微分接触
b 级式接触
图9-2 填料塔和板式塔
5.1.3 吸收操作的分类
物理吸收:吸收过程溶质与溶剂不发生显著的化学反应。如用水 吸收二氧化碳、用水吸收乙醇或丙醇蒸汽、用洗油吸收芳烃等。
硫回收
低温 甲 醇洗
甲醇 醋酸
CO分离
醋酐
低温甲醇洗装置
原气料体器气热I/交合换成 新醇鲜储甲槽 锅冷炉却给器水
原料气 冷却器
补充泵
洗氨器 原料气 体/热合交成换气器
原料气 /交废换气器热
地下 废液罐
地下 吸收器 废液泵
II
C02 甲 醇 级 间冷却器
H进2料S-冷吸却收器器
合成气 原料气
原 凝物料 气 冷
yA 1 yA
KmolA/ KmolB
在计算比质量分数或比摩尔分数的数值时, 通常以在操作中不转移到另一相的组分作为 B组分。在吸收中,B组分是指吸收剂或惰 性气,A组分是指吸收质.
2.质量浓度与物质的量浓度
质量浓度是指单位体积混合物内所含物质的质量。对于A组分,有
A
mA V
kg / m3
对于气体混合物,在压强不太高、温度不太低的情况下,可视为理
EM s 83.318
第八章 吸收
三、吸收平衡线
表明吸收过程中气、液相平衡关系的图线称吸收平衡线。在吸收操作 中,通常用图来表示。
吸收平衡线
YA
1
mX A (1 m) X
化工原理教学资料-第五章气体吸收

T
T
p
p
pA1 1
JA
2 pA2
pB1
pB2
JB
等摩尔反向扩散:任一截面处两个组分的扩散速率 大小相等,方向相反。
总压一定
JA
DAB RT
dpA dz
JB
DB A RT
dpB dz
ppApB
dpA dz
=
dpB dz
JA=-JB
DAB=DBA=D
2. 等摩尔反向扩散定常态传质速率方程
一、溶解度曲线 饱和浓度:平衡时溶质在液相中的浓度。
平衡分压:平衡时气相中溶质的分压。
相律分析:组分数C=3,相数=2, 自由度F=C-+2=3-2+2=3
分别为:温度、总压、气相或液相组成
当压力不太高、温度一定时
气 相
60℃
中
氨
50℃
的
分
压
40℃
30℃
P
* A
f1xA
y
* A
f2xA
P
* A
dz
DAB——组分A在B组分中的扩散系数,m2.s-1。 负号:表明扩散方向与浓度梯度方向相反,扩散沿
着浓度降低的方向进行
理想气体:
cA
pA RT
d c A = 1 dpA d z RT d z
JA
DAB RT
dpA dz
分子扩散两种形式:等摩尔反向扩散,单向扩散。 一、等摩尔反向扩散及定常态传质速率方程 1.等摩尔反向扩散
化工原理教学资料-第五章气体吸收
5.1 概述
5.1.1 化工生产中的传质过程 5.1.2 相组成表示法 5.1.3 气体吸收过程
5.1.1 化工生产中的传质过程
化工原理答案-第五章--吸收

第五章 吸收 相组成的换算【5-1】 空气和2的混合气体中,2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少?解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解3, 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982skg m ρ=代替。
溶液中3的量为 /311017n kmol -=⨯溶液的体积 /.33101109982 V m -=⨯溶液中3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ 3与水的摩尔比的计算//1170010610018X ==. 或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,3的体积分数为10%,吸收率为90%,求离开吸收器时3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为122111Y Y Y Y Y η-===-被吸收的溶质量原料气中溶质量解 原料气中3的摩尔分数0.1y = 摩尔比 (11)10101111101y Yy ===-- 吸收器出口混合气中3的摩尔比为 () (2)11109011100111Y Y η=-=-⨯=()摩尔分数 (22)200111=0010981100111Y yY ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3NH ,查得20℃时溶液上方3NH 的平衡分压为798。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
化工原理 第五章 气体吸收

第五章气体吸收第一节概述§5.1.1概述一、传质过程从本章起,讨论化工生产中的传质过程及其典型设备。
传质过程是指物质通过相界面从一相迁移至另一相的过程,以下图示意:>,则A物质就会从相迁移至相。
迁移的结果使得相的A、B据热力学知识,两物质得以一定程度或完全分离,而相形成了A、B两物质的混合物。
因此相内进行的是A、B的分离过程,相内进行的是A、C的混合过程。
研究传质过程就是研究物质通过相界面的迁移过程的基本规律以及主要受这些基本规律支配的若干单元操作。
混合物系的分离对我们来说并不陌生,在上册中我们已经学习掌握了非均相物系的分离方法,相应单元操作如沉降、过滤等,从这一章起要来讨论均相物系的分离。
用下表来比较说明非均相、均相物系的分离情况:本学期的任务就是要掌握气体、液体蒸馏、液液萃取和固体干燥这四个单元操作的基本原理及其典型设备的设计。
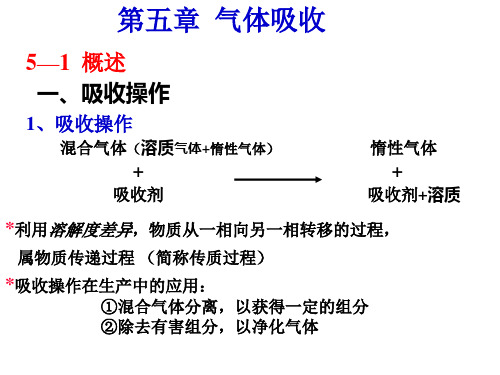
二、气体吸收吸收操作是分离气体混合物的方法之一。
吸收操作的分离依据是混合物各组分在某种溶剂(吸收剂)中溶解度的差异,从而达到的目的。
例如:将含的空气通入水中,因、空气在水中溶解度差异很大,NH3很容易溶解于水中,形成氨水溶液,而空气几乎不溶于水中。
所以用水吸收混合气体中的能使、空气加以分离,并回收。
一般地,混合气体中能溶解的组份称为溶质或吸收质,用A表示();混合气体中不能溶解的组份称为惰性成分或载体,用B表示(空气);吸收操作中所用的溶剂称为吸收剂或溶剂,用S表示(水);吸收操作中所得的溶液称为吸收液,用S+A表示;吸收操作中排除的气体称为吸收尾气,用(A)+B表示;吸收的目的有三个:1.分离混合气体以获得一定的组分。
(例子:硫酸吸收焦炉气中的,洗油吸收焦炉气中的苯、甲苯蒸汽。
)2.除去有害组分以净化气体。
(例子:用水或钾碱液吸收合成氨原料气中的二氧化碳。
)3.制备某种气体的溶液。
(例子:用水吸收氯化氢、三氧化硫、二氧化氮制得酸。
)实际过程往往同时兼有净化和回收双重目的。
化工原理 第五章 气体吸收

Y
*
mX 1 (1 m) X
当溶液浓度很低时,上式右端分母约等于1,于是上式可简化为:
Y*=mX
20
三、 相平衡关系在吸收中的应用
(一)判断过程进行的方向
* pA pA * pA pA * pA pA
A由气相向液相传质,吸收过程 平衡状态
A由液相向气相传质,解吸过程
*或x* >x或 c * y
dc A —组分A在扩散方向z上的浓度梯度(kmol/m3)/m; dz
DAB——组分A在B组分中的扩散系数,m2/s。
负号:表示扩散方向与浓度梯度方向相反,扩散沿 着浓度降低的方向进行
28
理想气体:
pA cA RT
dc A 1 dp A = dz RT dz
DAB dpA JA RT dz
25
吸收过程: (1)A由气相主体到相界面,气相内传递; (2)A在相界面上溶解,溶解过程; (3)A自相界面到液相主体,液相内传递。
单相内传递方式:分子扩散;对流扩散 。
26
一、 分子扩散与菲克定律
分子扩散:在静止或滞流流体内部,若某一组分存 在浓度差,则因分子无规则的热运动使
该组分由浓度较高处传递至浓度较低处,
物系一定, E T 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体
3)E的来源:实验测得;查手册
对于理想溶液,亨利常数即为纯溶质的饱和蒸汽压。亨利常数E值较大表示溶解度 较小。一般E值随温度的升高而增大,常压下压力对E值影响不大。
16
(二)亨利定律其它形式
cA 1)p H
体主体浓度线相交于一点E,则厚度zG为E到相界
面的垂直距离。
(二)气相传质速率方程
化工原理第五章吸收题说课讲解

化⼯原理第五章吸收题说课讲解化⼯原理第五章吸收题六吸收浓度换算2.1甲醇15%(质量)的⽔溶液, 其密度为970Kg/m3, 试计算该溶液中甲醇的:(1)摩尔分率; (2)摩尔⽐; (3)质量⽐; (4)质量浓度; (5)摩尔浓度。
分⼦扩散2.2 估算1atm及293K下氯化氢⽓体(HCl)在(1)空⽓,(2)⽔(极稀盐酸)中的扩散系数。
2.3⼀⼩管充以丙酮,液⾯距管⼝1.1cm,20℃空⽓以⼀定速度吹过管⼝,经5 ⼩时后液⾯下降到离管⼝2.05cm,⼤⽓压为750[mmHg],丙酮的蒸汽压为180[mmHg] , 丙酮液密度为7900[kg/m3],计算丙酮蒸汽在空⽓中的扩散系数。
2.4 浅盘内盛⽔。
⽔深5mm,在1atm⼜298K下靠分⼦扩散逐渐蒸发到⼤⽓中。
假定传质阻⼒相当于3mm厚的静⽌⽓层,⽓层外的⽔蒸压可忽略,求蒸发完所需的时间。
2.5 ⼀填料塔在常压和295K下操作,⽤⽔除去含氨混合⽓体中的氨。
在塔内某处,氨在⽓相中的组成y a=5%(摩尔百分率)。
液相氨的平衡分压P=660Pa,物质通量N A= 10 - 4[kmol/m2·S],⽓相扩散系数D G=0.24[cm2/s],求⽓膜的当量厚度。
相平衡与亨利定律2.6 温度为10℃的常压空⽓与⽔接触,氧在空⽓中的体积百分率为21%,求达到平衡时氧在⽔中的最⼤浓度, (以[g/m3]、摩尔分率表⽰)及溶解度系数。
以[g/m3·atm]及[kmol/m3·Pa]表⽰。
2.7 当系统服从亨利定律时,对同⼀温度和液相浓度,如果总压增⼤⼀倍则与之平衡的⽓相浓度(或分压) (A)Y增⼤⼀倍; (B)P增⼤⼀倍;(C)Y减⼩⼀倍; (D)P减⼩⼀倍。
2.8 25℃及1atm下,含CO220%,空⽓80%(体积%)的⽓体1m3,与1m3的清⽔在容积2m3的密闭容器中接触进⾏传质,试问⽓液达到平衡后,(1)CO2在⽔中的最终浓度及剩余⽓体的总压为多少?(2)刚开始接触时的总传质推动⼒ΔP,Δx各为多少?⽓液达到平衡时的总传质推动⼒⼜为多少?仅供学习与交流,如有侵权请联系⽹站删除谢谢1362.9 在填料塔中⽤清⽔吸收⽓体中所含的丙酮蒸⽓,操作温度20℃,压⼒1atm。
化工原理28气体吸收
煤气中的芳烃,可采用洗油吸收方法回收芳烃获得粗苯.
二、吸收操作分类
*物理吸收与化学吸收 *等温吸收与非等温吸收 *单组分吸收与多组分吸收 *定态吸收与非定态吸收(过程参数是否随时间而变) 本章讨论所作的基本假定: 单组分、低浓度、连续定态逆流、等温物理吸收
三、吸收操作的经济性
吸收操作费用主要包括: ①气、液两相流经吸收设备的能量消耗; ②溶剂的挥发损失和变质损失;
=
0
dz dz dz
—d —PA = - —d P—B
dz
dz
—d C—A= - —d —CB
dz
dz
DAB = DBA = D
若选择固定的,垂直扩散方向的截面为基准,观察 扩散传质的速率。对于定态分子扩散则有
NA= JA
同理有
NB= JB
由以上讨论可知,等摩尔逆向扩散过程传质速率的大小主
要是分子扩散的贡献。
有总体流动时的传质速率: 对于B组分有: NB = JB+NBM =0
即: JB= - NBM
且
NAM
PA
——— = ———
NBM
PB
JB= -NBM = - JA
对于A组分,其传递速率 :
即:
NA = JA + NAM = JA + NBM PA / PB NA =(1+ PA / PB)JA
NA=
dCA JA= - DAB———
dZ 式中:
JA— 组分A沿Z方向的扩散通量kmol/m2 ·s; CA— 组分A在混合物中摩尔浓度kmol/ m3 ; DAB—组分A在A、B混合中的扩散系数,m2/s 。
同理,对B组分的扩散可表示为
dCB JB= - DBA———
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
23
(三)确定过程的推动力
(1)吸收过程推动力的表达式
* * pA pA , y - y*, x* -x或 c A c A
(2)在x~Βιβλιοθήκη 图上yA ·P
y*
P192, 例5-2
x
* x24
第三节 吸收过程的传质速率 一、 分子扩散与菲克定律 二、 等摩尔逆向扩散 三、 组分A通过静止组分B的扩散 四、 分子扩散系数 五、 单相内对流传质 六、 两相间的双模理论 七、 总传质速率方程
dc A —组分A在扩散方向z上的浓度梯度(kmol/m3)/m; dz
DAB——组分A在B组分中的扩散系数,m2/s。
负号:表示扩散方向与浓度梯度方向相反,扩散沿 着浓度降低的方向进行
28
理想气体:
pA cA RT
dc A 1 dp A = dz RT dz
DAB dpA JA RT dz
1)因分子本身扩散引起的宏观流动。 2)A、B在整体移动中方向相同,流动速度正比于摩尔 分率。
35
N MA N M
N MB N M
cA c
cB c
NA JA NM
cA c
NB JB NM
0 JB NM
cB c
cB c
Dc dc A NA c c A dz
存在浓度梯度,流体质点便会靠
质点的无规则运动,相互碰撞和
混合,组分从高浓度向低浓度方 向传递,这种现象称为涡流扩散。
dc A De dz
42
J A ,e
J A ,e ——涡流扩散速率,kmol/(m2· s);
De
——涡流扩散系数,m2/s。
注意:涡流扩散系数与分子扩散系数不同,不是物性 常数,其值与流体流动状态及所处的位置有 关。
散增大的倍数。
p pBm 1
c cSm
1
漂流因子的影响因素:
浓度高,漂流因数大,总体流动的影响大。
低浓度时,漂流因数近似等于1,总体流动的影响小。 3)单向扩散体现在吸收过程中。
39
四、分子扩散系数
扩散系数的意义:单位浓度梯度下的扩散通量,反映
某组分在一定介质中的扩散能力,是物质特性常
数之一;D,m2/s。 D的影响因素:A、B、T、P、浓度 D的来源:查手册;半经验公式;测定
物系一定, E T 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体
3)E的来源:实验测得;查手册
对于理想溶液,亨利常数即为纯溶质的饱和蒸汽压。亨利常数E值较大表示溶解度 较小。一般E值随温度的升高而增大,常压下压力对E值影响不大。
16
(二)亨利定律其它形式
cA 1)p H
D BA dp B JB RT dz
总压一定
p p A pB
dp A dp B = dz dz
JA=-JB DAB=DBA=D
31
传质速率定义:任一固定的空间位置上, 单位时间 内通过单位面积的物质量,记作N,
kmol/(m2· 。 s)
仿照传热速率的表达方式:
传质推动力 传质速率 传质系数 传质推动力 传质阻力
* A
H——溶解度系数, kmol/(m3· kPa)
cA——摩尔浓度,kmol/m3;
H与E的关系:
cA c c p x H c H
* A
c E H
17
c
ML
M S (1 x) M A x
S
MS
E
S
HM S
c E H
——溶液的密度, kg/m3 ; s——溶剂的密度, kg/m3 ;
第五章 气体吸收
第一节 概述
第二节 气液相平衡
第三节 吸收过程的传质速率 第四节 吸收塔的计算 第五节 填料塔
1
第一节 概述
一、吸收操作的应用 二、吸收过程与设备 三、吸收过程分类
四、吸收剂的选择
2
一、吸收操作的应用
(1)分离混合气体以获得一定的组分。
(2)除去有害组分以净化或精制气体。
(3)制备某种气体的溶液。
8
第二节 气液相平衡
一、 平衡溶解度 二、 亨利定律 三、 气液相平衡关系在吸收中的应用
9
一、平衡溶解度
平衡状态:一定压力和温度,一定量的吸收 剂与混合气体充分接触,气相 中的溶质
向溶剂中转移,长期充分接 触后,液相
中溶质组分的浓度不再增加,此时,气
液两相达到平衡。
饱和浓度:平衡时溶质在液相中的浓度。 平衡分压:平衡时气相中溶质的分压。
分子扩散两种形式:等摩尔逆向扩散 组分A通过静止组分B的扩散。
29
二、等摩尔逆向扩散
T P pA1 pB1 1
JA
JB
T P pA2 2 pB2
互通容器,总压P和温度T均相同 pA1> pA2; pB1 < pB2
30
等摩尔逆向扩散:任一截面处两个组分的扩散速率
大小相等,方向相反。
DAB dp A JA RT dz
体主体浓度线相交于一点E,则厚度zG为E到相界
面的垂直距离。
(二)气相传质速率方程
46
Dp NA (pAG pAi ) RTzG pBm
N A kG ( pAG pA i )
Dp kG RTzG pBm
k G——以分压差表示推动力的气膜传质分系数, kmol/(m2· kPa)。 s·
25
吸收过程: (1)A由气相主体到相界面,气相内传递; (2)A在相界面上溶解,溶解过程; (3)A自相界面到液相主体,液相内传递。
单相内传递方式:分子扩散;对流扩散 。
26
一、 分子扩散与菲克定律
分子扩散:在静止或滞流流体内部,若某一组分存 在浓度差,则因分子无规则的热运动使
该组分由浓度较高处传递至浓度较低处,
——微分式
36
在气相扩散
pA cA RT
c
p RT
dpA Dp NA RT ( p pA ) dz
NA
p Dp ln B2 RTz pB1
——积分式 ——积分式
NA
Dp ( pA1 pA2 ) RTzpBm
pB 2 pB 1 pB m pB 2 ln pB 1
32
气相:
D dpA NA= J A RT dZ
D NA ( pA1 pA2 ) RTZ
液相:
NA= J A DAB
dcA dZ
D N A (cA1 cA2 ) Z
等摩尔逆向扩散传质速率方程
讨论 1) N A p A1 p A2
33
2)组分的浓度与扩散距离z成直线关系。
(1)物理吸收和化学吸收 (2)单组分吸收和多组分吸收 (3)等温吸收和非等温吸收 (4)低浓度吸收和高浓度吸收
四、吸收剂的选择
(1)溶解度大;
7
(2)选择性高;
(3)再生容易;
(4)挥发性小; (5)粘度低; (6)化学稳定性高; (7)腐蚀性低; (8)无毒、无害、价廉等。 选择原则:经济、合理。
Y
*
mX 1 (1 m) X
当溶液浓度很低时,上式右端分母约等于1,于是上式可简化为:
Y*=mX
20
三、 相平衡关系在吸收中的应用
(一)判断过程进行的方向
* pA pA * pA pA * pA pA
A由气相向液相传质,吸收过程 平衡状态
A由液相向气相传质,解吸过程
*或x* >x或 c * y
14
二、亨利定律
(一)亨利定律 总压不高时,在一定温度下,稀溶液上方
气相中溶质的平衡分压与溶质在液相中的摩尔
分率成正比,其比例系数为亨利系数。
* p A Ex
15
* p A ——溶质在气相中的平衡分压,kPa;
x——溶质在液相中的摩尔分率;
E——亨利常数,kPa。
讨论: 1)E的影响因素:溶质、溶剂、T
ML——溶液的平均分子量, kg/mol Ms——溶剂的平均分子量, kg/mol
H的讨论:1)H大,溶解度大,易溶气体 2)P对H影响小, T H
18
y * mx 2)
式中: y*——平衡时溶质在气相中的摩尔分率;
x——溶质在液相中的摩尔分率; m——相平衡常数,无因次。
m与E的关系 :
变化较陡。
2)湍流主体:涡流扩散远远大于分子扩散,
溶质浓度均一化,pA随z的变化近似为水 平线。 3)过渡区:分子扩散+涡流扩散,pA随z的 变化逐渐平缓。
45
有效膜模型 单相对流传质的传质阻力全部集中在一层虚 拟的膜层内,膜层内的传质形式仅为分子扩散 。 有效膜厚zG由层流内层浓度梯度线延长线与流
12
不同气体在同一吸收剂中的溶解度
在同一温度下,
对于不同种类的气
体组分,欲得到相
同浓度的溶液,易 溶气体仅需控制较 低的分压,而难溶
气体则需较高分压。
13
讨论:
(1)总压、y一定,温度下降,在同一溶剂中,
溶质的溶解度x随之增加,有利于吸收 。
(2)温度、y一定,总压增加,在同一溶剂中, 溶质的溶解度x随之增加,有利于吸收 。 (3)相同的总压及摩尔分率, cO2 < cCO2 < cSO2 < cNH3 氧气等为难溶气体,氨气等为易溶气体 (4) 加压和降温对吸收操作有利;反之,升温 和减压有利于解吸。
A
吸收过程: y
cA
21
y
y y* y* y
· · ·
A
P
B
C
