含氮化合物练习题教学提纲
高考化学一轮复习专题4-4 氮及其化合物(教案)

精品基础教育教学资料,仅供参考,需要可下载使用!第四讲 氮及其化合物考纲要求:1.了解氮元素单质及其重要化合物的主要性质和应用。
2.了解氮元素单质及其重要化合物对环境质量的影响。
[循着图示·想一想][特色特性·记一记]1.特殊的颜色:NO 2——红棕色气体2.特殊的检验:①NO :无色气体――→O 2红棕色 ②NH +4:NH +4――→强碱△无色气体―――――→湿润红色石蕊试纸变蓝 3.特殊的性质:硝酸具有不稳定性和强氧化性 4.必记六反应: (1)N 2+3H 2高温、高压催化剂2NH 3 (2)3NO 2+H 2O===2HNO 3+NO(3)4NH 3+5O 2=====催化剂△4NO +6H 2O(4)2NH 4Cl +Ca(OH)2=====△ CaCl 2+2NH 3↑+2H 2O (5)Cu +4HNO 3(浓)===Cu(NO 3)2+2NO 2↑+2H 2O (6)3Cu +8HNO 3===3Cu(NO 3)2+2NO↑+4H 2O考点一 性质稳定的非金属单质——氮气[教材知识层面]1.氮的原子结构氮元素位于元素周期表中第二周期第ⅤA 族,原子结构示意图为,最外层有5个电子,在化学反应中能获得3个电子而表现出-3价,其单质N 2因N≡N 键键能大,难以断裂,故N 2化学性质稳定。
2.氮气的性质(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质:①氮气与氧气反应的化学方程式为N 2+O 2放电,2NO 。
导致汽车尾气中产生氮的氧化物和雷电固氮。
②氮气与氢气反应的化学方程式为N 2+3H 2高温、高压催化剂2NH 3。
(工业合成氨反应原理)③氮气与金属镁反应的化学方程式为3Mg +N 2△,Mg 3N 2。
3.氮的固定(1)概念:将游离态的氮转变为氮的化合物叫做氮的固定。
(2)类型:氮的固定⎩⎪⎪⎨⎪⎪⎧人工固氮如工业合成氨:N 2+3H 2催化剂高温、高压2NH 3自然固氮如雷雨天产生NO :N 2+O 2放电2NO生物固氮如豆科植物的根瘤菌能够将空气中的氮转化为含氮化合物而促进自身生长化学模拟生物固氮:利用化学方法模拟固氮 酶的作用,在温和条件下将氮转变为氨4.氮气的应用①焊接金属时作保护气; ②液氮可作冷冻剂;③重要的化工原料,用来制取化肥、炸药等。
专题四 有关氮和氮的化合物-苏教版高中化学必修一习题课件

答案 A NO2、NO装满试管,则体积相同,根据阿伏加德罗定律:n(NO2)=n(NO),根据氮 原子守恒所得硝酸的物质的量相同,溶液的体积相同,所以两个试管中溶液物质的量 浓度之比为1∶1。 NO和O2通入水中,总关系式为4NO+3O2+2H2O = 4HNO3 (4∶3)。 NO2和O2通入水中,总关系式为4NO2+O2+2H2O = 4HNO3 (4∶1)。
苏教版《化学必修一》
有关氮和氮的化合物习题课
福建省长乐高级中学 2020年2 月21日
氮和氮的化合物
学习目标
1、氮气及其氧化物的性质和应用。 2、硝酸的性质及应用。 3、氨和铵盐的性质与应用。
氮和氮的化合物
一、氮气及其氧化物的性质和应用
1.下列有关氮气用途的说法不正确的是( D ) A.作焊接金属的保护气 B.制硝酸和化肥的原料 C.食品袋中充氮气来防腐 D.与氧气反应制NO从而制硝酸
氮和氮的化合物
二、硝酸的性质及应用
1.硝酸被称为“国防工业之酸的性质不相对应的一组是( D )
A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性 B.不能用稀硝酸与锌反应制氢气——强氧化性 C.要用棕色瓶盛装浓硝酸——不稳定性 D.能使滴有酚酞的氢氧化钠溶液的红色褪去——强氧化性
(1)实验过程中,观察到的主要现象是
① 铜片表面产生气泡,铜片慢慢溶解并逐渐消失 ;
② 小烧杯中溶液的颜色逐渐变成蓝色
;
③ 大烧杯中有红棕色气体生成,后来慢慢变成无色 ;
④ 大烧杯内液面上升,水槽中液面下降
。
氮和氮的化合物
二、硝酸的性质及应用
3.(全面描述金属与硝酸反应的现象)在如图所示的实验装置
氮及其化合物 知识点及练习题及答案

氮及其化合物知识点及练习题及答案一、选择题NH+,你认为下列试纸和试剂可用到的是1.为了检验某固体物质中是否含有4①蒸馏水②NaOH 溶液③红色石蕊试纸④蓝色石蕊试纸⑤稀硫酸A.①②④B.②③C.①②③D.①③⑤【答案】C【详解】NH+时,为便于反应,通常将固体先溶于水,然后加入强碱溶液、加检验固体物质中的4热,逸出的NH3用湿润的红色石蕊试纸检验,所以应选择①②③,故选C。
2.自然界的氮循环如下图所示,下列说法不正确的是()A.①中N2与O2反应生成NOB.②中合成氨属于人工固氮C.③中氮元素只被氧化D.氧元素参与了氮循环【答案】C【详解】A. N2和O2在放电作用下化合,生成NO,NO被氧化生成NO2,NO2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C错误;D. 如N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO3)和一氧化氮,3NO2+H2O=2HNO3+NO,氧元素参加,故D正确;题目要求选不正确的,故选C。
【点睛】本题主要考查了氮以及化合物的性质,理解还原反应、人工固氮等知识点是解答的关键,选项D是解答的易错点。
3.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+ ③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
高中化学氮及其化合物知识点及练习题及答案

高中化学氮及其化合物知识点及练习题及答案一、选择题1.下列每步转化不能通过一步反应就实现的是A.NH3→NO→NO2→HNO3B.Al→Al2O3→Al(OH)3→NaAlO2C.S→SO2→H2SO4→MgSO4D.Fe→FeCl2→Fe(OH)2→Fe(OH)3【答案】B【详解】A.氨气发生催化氧化生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,A正确;B.铝与氧气反应生成氧化铝,氧化铝不溶于水,不能直接转化为氢氧化铝,B错误;C.S燃烧生成SO2,SO2被氯水氧化可以转化为硫酸,硫酸与镁等反应可以生成硫酸镁,C 正确;D.铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化转化为氢氧化铁,D正确;答案选B。
2.自然界的氮循环如下图所示,下列说法不正确的是()A.①中N2与O2反应生成NOB.②中合成氨属于人工固氮C.③中氮元素只被氧化D.氧元素参与了氮循环【答案】C【详解】A. N2和O2在放电作用下化合,生成NO,NO被氧化生成NO2,NO2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C错误;D. 如N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO3)和一氧化氮,3NO2+H2O=2HNO3+NO,氧元素参加,故D正确;题目要求选不正确的,故选C。
【点睛】本题主要考查了氮以及化合物的性质,理解还原反应、人工固氮等知识点是解答的关键,选项D是解答的易错点。
3.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是①中的物质②中的物质预测①中现象A淀粉碘化钾溶液浓硝酸无明显现象B酚酞溶液浓盐酸无明显现象C氯化铝溶液浓氨水有白色沉淀D湿润红纸条饱和氯水红纸条褪色A.A B.B C.C D.D【答案】A【详解】A.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故A错误;B.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故B 正确;C.浓氨水具有挥发性,挥发出的氨气溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;D.饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO,HClO具有漂白性,使湿润红纸条褪色,故D正确;故答案为A。
高三化学一轮复习——氮及其化合物学案及训练

高三化学一轮复习——氮及其化合物学案及训练 目标要求 1.结合真实情景中的应用实例或通过实验探究,了解氮及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合实例认识氮及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
1.氮的固定2.氮气(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质写出有关化学方程式:①3Mg +N 2=====点燃Mg 3N 2;②N 2+3H 2高温、高压催化剂2NH 3;③N 2+O 2========放电或高温2NO 。
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的是N 2O 3、N 2O 5。
(2)NO 和NO 2的比较性质NO NO 2 色、态、味 无色、无味气体 红棕色、有刺激性气味气体深度思考 (1)结合N 2、NO 、NO 2的化学性质,用方程式解释“雷雨发庄稼”的科学道理。
答案 ①N 2+O 2=====放电2NO②2NO +O 2===2NO 2③3NO 2+H 2O===2HNO 3+NO(2)NO 2和溴蒸气均为红棕色气体,你用哪些实验方法鉴别二者,写出所用试剂和区别的现象。
方案一:试剂 ,现象 。
方案二:试剂 ,现象 。
方案三:试剂 ,现象 。
答案 方案一:AgNO 3溶液 NO 2中AgNO 3溶液无明显变化,溴蒸气中产生浅黄色沉淀 方案二:CCl 4(或汽油) NO 2中CCl 4(或汽油)仍为无色,溴蒸气中CCl 4(或汽油)的颜色加深 方案三:蒸馏水 NO 2中蒸馏水不变色,溴蒸气中水的颜色加深(其他合理的答案均正确) 解析 NO 2和Br 2在性质上有不少相似性,例如:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
含氮化合物习题解答
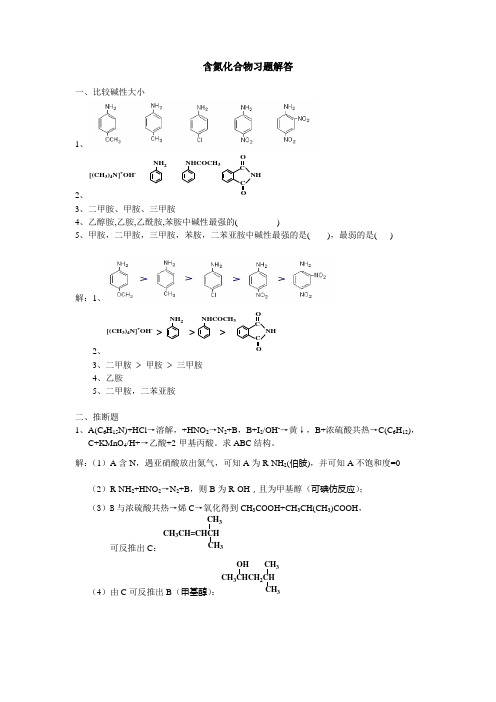
含氮化合物习题解答一、比较碱性大小1、2、ONHNH2NHCOCH3CCO [(CH3)4N]+OH-3、二甲胺、甲胺、三甲胺4、乙醇胺,乙胺,乙酰胺,苯胺中碱性最强的( )5、甲胺,二甲胺,三甲胺,苯胺,二苯亚胺中碱性最强的是( ),最弱的是( ) 解:1、2、ONHNH2NHCOCH3CCO [(CH3)4N]+OH-> > >3、二甲胺>甲胺>三甲胺4、乙胺5、二甲胺,二苯亚胺二、推断题1、A(C6H15N)+HCl→溶解,+HNO2→N2+B,B+I2/OH-→黄↓,B+浓硫酸共热→C(C6H12),C+KMnO4/H+→乙酸+2-甲基丙酸。
求ABC结构。
解:(1)A含N,遇亚硝酸放出氮气,可知A为R-NH2(伯胺),并可知A不饱和度=0 (2)R-NH2+HNO2→N2+B,则B为R-OH,且为甲基醇(可碘仿反应);(3)B与浓硫酸共热→烯C→氧化得到CH3COOH+CH3CH(CH3)COOH,可反推出C:CH3CH=CHCHCH33(4)由C可反推出B(甲基醇):CH33 CH32CHOH(5)由B反推出A:CH33 CH32CHNH22、旋光性A(C 4H 9O 2N)+HCl →溶解,+HNO 2→N 2,A 可水解→甲醇+旋光性B ,B 可溶于酸和碱,B+HNO 2→乳酸。
求AB 结构。
解:(1)A 含O 和N ,可溶于盐酸,则A 为胺(非酰胺,酰胺近似中性),A 遇亚硝酸放出氮气,则A 为伯胺,计算知A 的Ω=1;(2)A 可以水解得到甲醇和可溶于酸碱的B ,推知A 应该是含氨基的酯,水解得到甲醇和氨基酸B (可溶于酸碱);(3)B (氨基酸)+HNO 2→乳酸(CH 3CH(OH)COOH ),可推知B :NH 2CH 3CHCOOH*(4)由A 水解得到甲醇和B 可反推出A :*NH 2CH 3CHCOOCH 33、碱性A(C 7H 9N),其盐酸盐+HNO 2→B(C 7H 7N 2Cl),B 加热→N 2+对甲苯酚,B+苯酚/OH -→有色化合物C(C 13H 20ON 2)。
氮及其化合物复习课-教学设计

教学设计氮及其化合物复习课姓名单位TEL:000000002016年12月27日第三章非金属及其化合物氮及其化合物(复习课)单位姓名一、指导思想与理论依据学生是学习的主体,教师是化学学习的组织者、引导者和合作者。
开放性课堂教学的目的是:在化学课堂营造一个积极主动的课堂情景,激发学生的潜力。
从而提高化学课堂的时效性,让学生学得轻松愉快、灵活有效。
以学生为主体,在教学过程中积极引导启发学生,同时也要大胆放手,让学生能够自由的思维。
本课通过创设问题情境,围绕问题展开教学,激发了学生的学习积极性,在获取信息的同时提高了学生的思维品质和解决问题的能力,从而提高了化学教学的时效性。
二、教学内容分析“氮及其化合物”是中学化学的重要组成部分,也是高考命题的重点和热点。
本节课主要在学生独立思考和相互合作的基础上,重点账务氮及其化合物的知识,使学生学会利用化学解决问题的能力。
本节课从近期的热点问题“雾霾”入手,通过提出问题并解决问题的过程,不但复习了新学习的基本知识,也让学生掌握了通过已学知识解决未知问题的能力。
三、学情分析学生基础较好,通过前面的学习已经基本掌握了氮及其化合物的知识。
这节课我通过创设情境,以调查雾霾中主要污染物氮氧化物的来源为主线,通过探究氮氧化物的来源和处理,达到复习的目的,同时树立环保的理念,理论联系实际,培养学生化学素养,提高学习化学的兴趣。
四、教学目标:知识与技能:1.掌握一氧化氮、二氧化氮、硝酸及氨气的相关性质。
2.了解氮及其化合物的相互转化关系。
过程与方法:1.引导学生主动参与问题的探究、培养学生解决问题的能力。
2.在构建氮及其化合物等相关知识网络的过程中,学会归纳提炼化学知识的方法。
情感态度与价值观:通过讨论、交流、分享对问题的看法和解决方案,培养学生关注社会热点问题,树立良好的价值观,培养学生的环保意识。
五、教学重点:氮及其化合物知识体系的建立。
六、教学难点:将氮的基本知识整合,学以致用,解决实际问题。
高中化学 重难点讲义+巩固练习题- 第13讲.氮及其化合物(普)(2)

高考要求内容要求层次具体要求ⅠⅡⅢ氮及其化合物√掌握氮单质的主要性质及应用;√掌握氮的化合物的主要性质及应用;√了解非金属单质及其化合物对环境质量的影响。
满分晋级新课标剖析第13讲氮及其化合物元素化合物5级氮及其化合物元素化合物11级氮及其化合物元素化合物16级非金属元素——硫、氮13.1 单质氮、氨与铵盐一、 氮气——N 2 1. 氮气的物理性质氮气是一种无色无味、难溶于水的气体,比较容易液化,形成的液氮可以做制冷剂。
2. 氮气的化学性质(1)与H 2反应(工业合成氨的重要反应,又称为人工固氮)223N 3H 2NH 催化剂高温、高压+【注意】合成氨是所有人工合成含氮的化合物的第一步。
(2)与O 2反应22N O 2NO 放电/高温+【注意】①夏天雷雨天气时会产生一定量的NO ,这属于自然固氮,汽车尾气中氮的氧化物就是氮气与氧气在高温条件下产生的。
②生成的NO 不稳定,很容易被氧化成NO 2。
(3)与活泼金属反应232N 3MgMg N 点燃+3. 氮气的应用氮气是工业上合成氨、制氮肥、制硝酸的原料,氮 气可用作焊接金属、充填白炽灯、保存粮食、水果 的保护气,液氮用作制冷剂。
二、 氨气——NH 31. 氨气的物理性质NH 3是一种有刺激性气味、密度比空气小的无色气体,易液化(可作制冷剂),极易溶于水(溶解体积比1:700)。
【注】 ①收集氨气用向下排空气法,不能用排水法。
②HCl 、NH 3等极易溶于水的气体易形成喷泉实验,此外下列较易溶于水的气体及其组合也可形成喷泉:Cl 2/CO 2/SO 2/H 2S ——NaOH ;喷泉后所得溶液的浓度为恒值,计算方法:c =1/22.4mol·L -1(气体为标况下气体)。
③溶解或吸收氨气等溶解度很大的气体时,要用类似以下装置的原理防止倒吸。
知识点睛2. NH 3的化学性质 (1) 与H 2O 反应3232NH H O NH H O +324NH H ONH OH +-+【总结】①上面的反应能体现出氨水呈弱碱性的原因。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
含氮化合物练习题班级 学号 姓名一、 命名下列化合物(每小题1分,共10分)NO 2CH 3CH 3NO 21.2.CH 3NH CH 32-间硝基苯基-3-硝基丁烷 1,2-二甲氨基乙烷3.4.CH 3CH 3N +CH 3CH 3CH3Cl -N CH 3C H 3COOEt 氯化二甲基乙基-1-甲基-2-烯丁基铵 间甲乙胺基苯甲酸乙酯NCH 3C H 3N(CH 3)25.6.N NCH 3Br3,3’-二甲基-4’-二甲氨基氧化偶氮苯 3-甲基-2’-溴偶氮苯7.8.NH NHBrN +NCH 3BF 4-4-溴氢化偶氮苯 四氟硼酸间甲基苯基重氮盐9.10.CH 3CH 3CH 3N CH 3NO氧化甲乙胺 N -亚硝基甲乙胺二、 完成下列反应方程式,注明产物的立体构型和主要产物(每小题1分,共25分)1.CH 3NO 2NaOH2.HNO2CH 3NO 23.Fe + HClCH 3NO 24.H /PdCH 3NO 25.23NO26.NO 27.4NO 28.LiAlH 4NO 29.NaOHNO 2NO 2Br10.HNO NH 2Br11.NH BrCH 3HNO 212.N CH 3C H 3HNO 213.NC H 3CH 3CH 3HNO214.CH3CH2N(CH3)2H2O215.NHCOCH3Br216.NHCOCH3ClO2CH3NH217.Heat CH3CH3N+CH3CH3CH3FOH-18.NHCOCH3ClO2SCH3NH219.N 1.CH3I2.Ag2O/H2O 3.Heat20.NH2NaNO2/HCl0-5C21.N+NCH3H3PO2HSO4-22.CuCl/HCl N+NClHSO4-23.CuCN/KCN N+NBrHSO4-24.NaNO2/Cu N+N BF4-25.NH4Cl N+NBrHSO4-NH CH3+三、选择题(每小题1分,共30分)1.酸性最强的是AA.硝基甲烷B.硝基乙烷C.硝基异丙烷D.硝基苯2.与亚硝酸反应产物的碱溶液呈红色的是B A.氨基甲烷B.硝基乙烷C.硝基异丙烷D.硝基苯3.可用于鉴别硝基化合物的是DA.Fe+HClB.Sn+HClC.As2O3+NaOHD.NaNO2/HCl+NaOH4.可使硝基苯还原成苯胺的是AA.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl5.可使硝基苯还原成氧化偶氮苯的是B A.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl6.可使硝基苯还原成氢化偶氮苯的是C A.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl7.可使硝基苯还原成偶氮苯的是CA.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl8.水溶液中碱性最强的是B A.甲胺B.二甲胺C.三甲胺D.苯胺9.碱性最强的是ANH23NH2ClNH2ClNH2CH3A. B. C. D.10.与TsCl反应的产物加碱澄清,加酸又浑浊的的是A A.甲胺B.二甲胺C.三甲胺D.氢氧化四甲铵11.与亚硝酸反应生成黃色油状物的是BA.甲胺B.二甲胺C.三甲胺D.氢氧化四甲铵12.与亚硝酸反应生成绿色沉淀的是CA.苯胺B.N-甲基苯胺C.N,N-二甲基苯胺D.三甲铵13.苯胺类物质常用于保护氨基的反应是B A.磺酰化B.乙酰化C.重氮化D.酸化14.常用于鉴别苯胺的试剂是BA.氯水B.溴水C.碘/四氯化碳D.硝酸15.磺胺类药物的基本结构是AA.对氨基苯碘酰胺B.对羟基苯碘酰胺C.间氨基苯碘酰胺D.间羟基苯碘酰胺16.季铵碱的Hoffmann热消除反应的机理是DA.E1B.E2C.E1CBD.介于E1CB与E2之间17.季铵碱的热消除反应常用于AA.测定胺的结构B.测定胺分子中的氮原子数C.测定胺分子中的环数D.制备烯烃18.不能将芳香族重氮盐的重氮基用氢取代的是D A.次磷酸B.乙醇C.HCHO/NaOHD.甲醇19.能将重氮基还原成肼的是AA.Sn+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl20.重氮盐与酚的偶联介质是DA.强酸性B.强碱性C.弱酸性D.弱碱性21.重氮盐与苯胺的偶联介质是C A.强酸性B.强碱性C.弱酸性D.弱碱性22.重氮基被碘取代的催化剂是D A.CuB.CuIC.CuClD.不用催化剂23.重氮基被溴取代的催化剂是B A.CuB.CuBrC.CuClD.不用催化剂24.重氮基被硝基取代的催化剂是A A.CuB.CuBrC.CuClD.不用催化剂25.重氮基被氟取代的催化剂是DA.CuB.CuBrC.CuClD.不用催化剂四、试用化学方法鉴别下列化合物(10分)1.1-己醇、2-戊酮、3-戊酮、己烷、环已醇2.乙醇,3-戊醇,乙醛、己烷、3-戊酮五、合成(每小题5分,共10分)1.由苯合成间溴氯苯2.由苯合成对苯二胺3.由苯合成均三溴苯4.由苯合成3,5-二溴甲苯5.由苯合成间硝基甲苯同46.由苯合成4-甲基-2,6-二溴苯酚同4六、推断题(每小题2、5、3分,共10分)1.A(C6H15N)+HCl→溶解,+HNO2→N2+B,B+I2/OH-→黄↓,B+浓硫酸共热→C(C6H12),C+KMnO4/H+→乙酸+2-甲基丙酸。
求ABC结构。
2.旋光性A(C4H9O2N)+HCl→溶解,+HNO2→N2,A可水解→甲醇+旋光性B,B可溶于酸和碱,B+HNO2→乳酸。
求AB结构。
3.碱性A(C7H9N),其盐酸盐+HNO2→B(C7H7N2Cl),B加热→N2+对甲苯酚,B+苯酚/OH-→有色化合物C(C13H12ON2)。
求ABC结构。
4.A含CHON,与NaOH共热→刺激性气体,反应液酸化得B(B不含N),B+LiAlH4→C,C+浓H2SO4共热→M=56的烯D,D臭氧化得醛+酮。
求A-D结构。
5.旋光性A的分子式为C5H10O3N2,HNO2处理后水解可得到α-羟基乙酸和β-氨基丙酸,试写出A的结构式。
6.A(C5H13N)有旋光性,与亚硝酸作用得B(C5H12O),B可拆分,氧化得C(C5H10O),C与次卤酸钠反应得到异丁酸。
试推A,B,C的结构。
7.A,B,C(C7H7NO2),都含苯环。
A能溶于酸和碱;B能溶于强碱而不溶于酸;C不溶于酸和碱。
试推A、B、C结构。
8.旋光性A(C5H9NO4)既可形成内酯,也可水解;A水解→B(C2H4O3)+旋光C;B[O]→草酸,C+HNO2→N2+D,D[O]→丙酮酸。
求A-D的结构。
9.旋光性的A(C4H7NO4)可溶于酸和碱,+HNO2→N2+旋光性B,B[O]→C,C有互变异构体D;B脱水→E,E有顺反异构体F。
求A-F的结构。
10.分子式C7H7NO2的化合物A,与Sn+HCl反应生成分子式为C7H9N 的化合物B;B和NaNO2+HCl在0℃下反应生成分子式为C7H7ClN2的一种盐C;在稀酸中C与CuCN反应生成分子式为C8H7N的化合物D;D在稀酸中水解得到分子式为C8H8O2的有机酸E;E用KMnO4氧化得到另一种酸F;F受热时生成分子式为C8H4O3的酸酐G。
试写出A-G的构造式。
11.化合物(A)能溶于水,不溶于乙醚、苯等有机溶剂。
经元素分析表明(A)含有C、H、O、N。
(A)经加热后失去一分子水得到(B),(B)与溴的氢氧化钠溶液作用得到比(B)少一个C和O的化合物(C)。
(C)与亚硝酸作用得到的产物与次磷酸反应能生成苯。
试写出(A)、(B)、(C)的构造式及有关反应式。
12.A(C6H13N)经第一次霍夫曼彻底甲基化反应得B(C8H17N),经第二次霍夫曼彻底甲基化反应得C(C6H10)。
C经臭氧化还原水解生成两分子甲醛,C在苯中与顺丁烯二酸酐反应生成白色沉淀。
试推测ABC的结构13.A(C6H13N)经第一次霍夫曼彻底甲基化反应得B(C8H17N),经第二次霍夫曼彻底甲基化反应得唯一的直链化合物C(C6H10)。
C经臭氧化还原水解生成两分子甲醛。
试推测ABC的结构14.毒芹碱A(C8H17N)经两次霍夫曼彻底甲基化反应得两种互为同分异构体的直链物质B和C(C8H14)。
B经臭氧化还原水解生成一分子甲醛、D(C3H4O2)和E(C4H8O);C经臭氧化还原水解生成一分子甲醛、F(C4H6O2)和G(C3H6O)。
试推测A至G的结构15.化合物A(C7H15N)与2mol碘甲烷作用形成季铵盐,后用氢氧化银处理得季铵碱,加热得B。
B分别与1mol碘甲烷和氢氧化银作用,加热得C(C7H12)。
C用高锰酸钾氧化得D,已知D为二甲基丙二酸。
试推测A至C的结构。
