转染效率评价标准
转染

Stealth™RNAi or siRNA TransfectionStealth™RNAi or siRNA TransfectionStealth™RNAi or siRNA TransfectionStealth™RNAi or siRNA Transfection 以24孔板为例,其余规格的转染见表1 1 中板,细胞密度为30-50%适宜。
注意:根据转染后细胞检测时间长短决定细胞中板密度,如果转染后需要长时间后检测,则细胞中板密度适当降低,已避免细胞过度生长导致存活降低。
2 第二天(24-36小时后)每个孔转染方式如下:A 将20pmol siRNA溶于50ul Opti-mem无血清培养基中。
B 将1ul lipo2000溶于50ul Opti-mem无血清培养基中,混匀室温放置5min。
C 将A B两管混合,放置20min。
3 转染期间,将24孔板培养基换成无血清培养基,每孔400ul。
将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。
Plasmid DNA TransfectionPlasmid DNA TransfectionPlasmid DNA TransfectionPlasmid DNA Transfection DNA(ug):lipo 2000(ul)=1:2-3 转染时细胞密度越高,转染效率,表达效率也越高,并且可以降低细胞毒性。
1 中板。
贴壁细胞:0.5-2X105 cells/well,第二天待细胞密度达到90%以上时转染悬浮细胞:4-8X105 cells/well,中板后随即转染。
2 转染。
A 将0.8ug DNA溶于50ul Opti-mem无血清培养基中。
B 将2ul lipo2000溶于50ul Opti-mem 无血清培养基中,混匀室温放置5min。
C 将A B两管混合,放置20min。
转染期间,将24孔板培养基换成无血清培养基,每孔400ul。
化学合成siRNA转染人羊膜的WISH细胞的效率检测

中国组织工程研究与临床康复第12卷第16期 2008–04–15出版Journal of Clinical Rehabilitative Tissue Engineering Research April 15, 2008 Vol.12, No.16 ISSN 1673-8225 CN 21-1539/R CODEN: ZLKHAH3115 1College of Animal Medicine, Northwest Agricultural & Forestry University, Yangling 712100, Shaanxi Province, China; 2Institute of Obstetrics & Gynecology, Third Affiliated Hospital of Guangzhou Medical College, Guangzhou 510150, Guangdong Province, ChinaHao Rong-zeng★, Studying for master's degree, College of Animal Medicine, Northwest Agricultural & Forestry University, Yangling 712100, Shaanxi Province, China; Institute of Obstetrics & Gynecology, Third Affiliated Hospital of Guangzhou Medical College, Guangzhou 510150, Guangdong Province, China rongzenghao@ Correspondence to: Ma Bao-hua, Associate professor, College of Animal Medicine, Northwest Agricultural & Forestry University, Yangling 712100, Shaanxi Province, ChinaSupported by: the National Natural Science Foundation of China, No. 30471828*; the Scientific Research Priming Foundation for Returned Persons of Ministry of Education, No. Jiaowaisiliu[2005] 383*Received:2008-01-02 Accepted:2008-02-13化学合成siRNA转染人羊膜的WISH细胞的效率检测**★郝荣增1,2,刘慧姝2,马保华1Chemosynthesis siRNA transfection efficiency in human amnionic WISH cellsHao Rong-zeng1,2, Liu Hui-shu2, Ma Bao-hua1AbstractAIM: Researching the pertinent literature in China Journal Full-text Database (CJFD) published between 2005 and 2008 indicatedthat the inhibitory effect of small interference RNA (siRNA) was determined by the transfection efficiency in RNA interference. Atpresent, there are few reports about detection of the transfection efficiency for human WISH cells with chemosynthesis siRNA. Inthis study, we use the flow cytometer detected the transfection efficiency and the effect on apoptosis of WISH cells after chemosynthesis siRNA transfected human WISH cells.METHODS: The experiment was performed at the Experimental Medical Research Center of Guangzhou Medical College fromMarch to December 2007. ①WISH cells were bought from Shanghai Life Science Academy of Chinese Academy Of Sciences. ②WISH cell line was transfected with CY3-Negative siRNA (0, 5, 10, 20, 30 nmol/L). Twenty-four hours later, transfectionefficiencies of different protocols were evaluated by fluorescent microscopy and flow cytometer. Apoptosis of WISH cells wasdetected with Annexin V-EGFP kit after 24-hours 20 nmol/L CY3-Negative-siRNA transfection.RESULTS: Red fluorescence was discovered under the fluorescence microscope with 5, 10, 20, 30 nmol/L CY3-Negative siRNAtransfected WISH cells, and no signals were discovered in control group. The transfection efficiency of 20, 30 nmol/L CY3-NegativesiRNA was remarkably higher than 5, 10 nmol/L CY3-Negative siRNA transfection groups (P < 0.05). There was no significant differencein transfection efficiency between 20 nmol/L and 30 nmol/L siRNA groups (P > 0.05). The apoptosis of WISH cells was detected after24-hours transfection with 20 nmol/L Negative siRNA. The apoptotic rates were 1.96% and 2.36% in the transfection and control groups,respectively. There was no significant difference in apoptosis of WISH cells between transfection group and control group.CONCLUSION:①The chemosynthesis siRNA can transfect human amnion-derive WISH cells successfully, and there is no effecton the apoptosis of WISH cells after transfection. ②Better transfection efficiency can be obtained in 20 nmol/L siRNA transfectedhuman WISH cells.Hao RZ, Liu HS, Ma BH.Chemosynthesis siRNA transfection efficiency in human amnionic WISH cells. Zhongguo ZuzhiGongcheng Yanjiu yu Linchuang Kangfu 2008;12(16):3115-3118(China)[/zglckf/ejournal/upfiles/08-16/16k-3115(ps).pdf]摘要目的:检索中国期刊全文数据库2005/2008相关文献显示,RNA干扰研究中,转染效率的高低直接决定siRNA 的表达效果,目前关于应用小分子干扰RNA对人羊膜WISH细胞转染效率的检测研究少见。
细胞转染成功与否的八大要素

细胞转染成功与否的八大要素摘要: 转染是否成功的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。
但无论在何种情况下,转染的成功均取决于知己知彼,方能百战不殆。
做细胞转染也一样道理。
细胞转染实验的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。
但无论在何种情况下,以下八个要素都不容忽视。
要素一:细胞分裂细胞相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。
因此对大多数转染操作而言,细胞都在转染当天或前一天种板。
同样重要的是细胞在种板进行转染时不应处于过度生长的状态;此外,还常用促有丝分裂刺激物(如,病毒转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。
贴壁细胞相比较悬浮细胞——在转染效率方面贴壁细胞和悬浮细胞之间的差异显著。
相对于贴壁细胞(如HEK,CHO),悬浮细胞(如HL 60,Jurkat)非常难以转染,可能是因为细胞间膜结构的差异,但目前还没有分子水平上合理机制的解释。
分板方案——在对培养细胞进行分板传代培养之前,必须把贴壁细胞用胰蛋白酶消化使之脱离培养基质。
这个常规操作可导致正常细胞功能受到严重损害。
因此分批方案的不同(如,胰蛋白酶消化时间的长短,胰蛋白酶的灭活等)需要优化。
传代次数——传代次数是指对一个细胞系进行分批传代的频度(通常在一个实验室范围内)。
某些细胞系相比较其他细胞系而言较不稳定,可能会随着培养时间的延长而改变,视不同的细胞系和培养条件而定。
因此名称相同的同一细胞系在生理学和形态学(以及转染能力)性质也可能会有很大的差异。
一般而言,细胞在冻存复苏后的一两代之内或直到它们完全复苏之前都很难转染。
细胞数量(融合率)——只要培养基质(组织培养皿)尚有空间,细胞就会按指数规律分裂。
对于正常细胞而言,细胞生长的速度受细胞密度大小的抑制(接触抑制),但癌细胞则不受此限制而会继续生长并可互相叠加。
细胞转染效率低的原因及解决方案

细胞转染效率低的原因及解决方案
细胞转染是细胞生物学和分子生物学的一种常用的技术手段。
而转染效率低下却是实验人员经常遇到的问题,尤其是原代细胞转染,转染难度更大。
现分享几个细胞转染实验常见的几个陷阱,望实验人员能够注意。
1.准备不足
做细胞转染的时候,在开展正式实验前要多做预试验,优化转染条件。
优化转染条件包括:转染试剂的用量、DNA密度、细胞密度、试剂和DNA混合孵育时间等等。
2.细胞污染
细胞污染也是造成细胞死亡,转染效率低下的一大原因。
首先,转染细胞用的质粒必须保证无菌。
而现在市场上的一般的质粒提取试剂盒都做不到绝对无菌。
分享一个小秘诀:将提完质粒后或者提的最后一步,用75%乙醇沉淀,这样就除菌了。
3.质粒质量问题
转染用的质粒首先要保证数量,一般为2μg以上。
质粒纯度不够或者含有细菌LPS或其他对细胞有毒害作用的物质,也会影响转染效率。
这个时候,就应该对质粒进行纯化和浓缩。
4.细胞状态不好
细胞状态不好,会导致转染效率低下。
一般进行转染的细胞应该处于对数生长期。
如果是贴壁细胞的话,贴壁率应该在70-80%;如
果是悬浮细胞的话,应该是6×105个/孔(24孔板),一般是转染前一天换液,转染前用无血清培养基或PBS洗细胞一次。
5.转染试剂问题
脂质体试剂毒性较大,易造成细胞死亡和转染效率底下。
可选择非脂质体转染试剂,如Entranster试剂。
转染效率的测定方法

转染效率的测定方法
一、实时定量PCR检测
实时荧光定量PCR (Quantitative Real-time PCR)是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法。
通过内参或者外参法对待测样品中的特定DNA序列进行定量分析的方法。
Real-time PCR是在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测。
由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。
但是,荧光定量PCR所检测的是转染后细胞中待测基因的mRNA的表达水平,对于目的基因的蛋白表达水平不能够检测;
二、Wester Blot检测
Western Blot又称蛋白质免疫印迹(免疫印迹实验),其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或者生物组织样品进行着色,并通过分析着色的位置和着色的深度获得特定蛋白在所分析的细胞或者组织中表达情况的信息。
Western Blot所检测的是组织或者细胞中蛋白质的表达水平。
三、流式细胞术
流式细胞术(Flow Cytometry,FCM)是一种在功能水平上对细胞或者其他生物粒子进行定量检测和分析的检测手段,它可以高速分析上万个细胞,并能同时从一个细胞中检测得到多个参数,与传统检测方法相比具有更加快速、准确以及定量等特点。
使用流式细胞术检测转染效率可以更加精que的确定转染的效率,对转染效率进行量化。
四、荧光显微镜观察
当我们转染的质粒DNA含有荧光蛋白基因是,可以通过荧光显微镜观察的方法来确定转染的效率,在荧光显微镜下,可以观察到荧光的强弱以及荧光的效率。
细胞转染成功与否的八大要素

细胞转染成功与否的八大要素摘要: 转染是否成功的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。
但无论在何种情况下,转染的成功均取决于知己知彼,方能百战不殆。
做细胞转染也一样道理。
细胞转染实验的影响因素很多,如需要转染的细胞类型(对于困难的细胞系尤其如此),需要被转染的分子(DNA、RNA、寡核苷酸、蛋白质),转染试剂等。
但无论在何种情况下,以下八个要素都不容忽视。
要素一:细胞分裂细胞相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。
因此对大多数转染操作而言,细胞都在转染当天或前一天种板。
同样重要的是细胞在种板进行转染时不应处于过度生长的状态;此外,还常用促有丝分裂刺激物(如,病毒转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。
贴壁细胞相比较悬浮细胞——在转染效率方面贴壁细胞和悬浮细胞之间的差异显著。
相对于贴壁细胞(如HEK,CHO),悬浮细胞(如HL 60,Jurkat)非常难以转染,可能是因为细胞间膜结构的差异,但目前还没有分子水平上合理机制的解释。
分板方案——在对培养细胞进行分板传代培养之前,必须把贴壁细胞用胰蛋白酶消化使之脱离培养基质。
这个常规操作可导致正常细胞功能受到严重损害。
因此分批方案的不同(如,胰蛋白酶消化时间的长短,胰蛋白酶的灭活等)需要优化。
传代次数——传代次数是指对一个细胞系进行分批传代的频度(通常在一个实验室范围内)。
某些细胞系相比较其他细胞系而言较不稳定,可能会随着培养时间的延长而改变,视不同的细胞系和培养条件而定。
因此名称相同的同一细胞系在生理学和形态学(以及转染能力)性质也可能会有很大的差异。
一般而言,细胞在冻存复苏后的一两代之内或直到它们完全复苏之前都很难转染。
细胞数量(融合率)——只要培养基质(组织培养皿)尚有空间,细胞就会按指数规律分裂。
对于正常细胞而言,细胞生长的速度受细胞密度大小的抑制(接触抑制),但癌细胞则不受此限制而会继续生长并可互相叠加。
转染资料整理终结版

转染转染——让克隆的核酸进入真核细胞中,已经成为研究和控制真核细胞基因表达的重要手段。
比如表达纯化特定的蛋白;鉴定一个基因的生物学特性;突变分析;研究基因表达对细胞生长的影响,研究基因表达的调控机制等等,等等。
如今广义的转染不单包括了DNA、RNA,还有蛋白质等生物大分子。
生物通在前面已经为大家集中介绍了8个不同的品牌的转染试剂——不是选美,没有包医百病的万灵丹,只是希望有助于你了解每种产品的特性。
这里我们最后“唐僧”一下,转染中一些值得注意的事项。
很多因素会影响转染效率,细胞株本身啦,细胞培养环境啦,转染的DNA、RNA 或者蛋白的质量和特性啦,转染方法啦,等等。
每个转染高手也必然有自己的独门心经,只可惜大家都为实验或者生活而疲于奔命,没有几个人愿意静下心情来仔细总结经验汇集成文字——那些曾经用无数失败的痛苦烦恼换回来的宝贵经验,那些曾经以为会永远铭刻于脑海的教训,随时间的流逝而终于渐渐褪色,到模糊。
即使偶尔有珠玉掩埋于浩瀚的口水中,也难以汇串成珠。
试剂盒的盛行,让实验更快,更简单,也更机械化,相信更多人更愿意先抓起Protocol 123地往下做,直到碰壁再苦思原因。
其实等碰得遍体鳞伤回头一看就会醒悟,很多坑,只要事前注意了就不会陷进去的。
幸好还有一些资料可寻,生物通姑且在这里抛砖引玉,罗列一些吧。
这一part很闷的。
DNA转染后,转入基因的表达可以在1-4天内检测到——仅有一部分转入细胞的DNA被转运到细胞核内进行转录并最终输出mRNA到细胞质进行蛋白合成。
几天内,大部分外源DNA会被核酸酶降解或随细胞分裂而稀释;一周后就检测不到其存在了。
因此转染也可以分为瞬时转染和稳定转染。
瞬时转染(transient transfection)指的是转染的核酸不整合到染色体上,结果是短暂的高水平表达,可在24—96小时内检测表达效果,表达水平与位置无关,不会受到周围染色体元件的影响。
瞬时表达分析所需的人力和时间比稳定表达少,但因为DNA摄入效率和表达水平在不同实验中差异较大,不长久也不稳定。
1. 吉玛293T转染oligo效率评价步骤
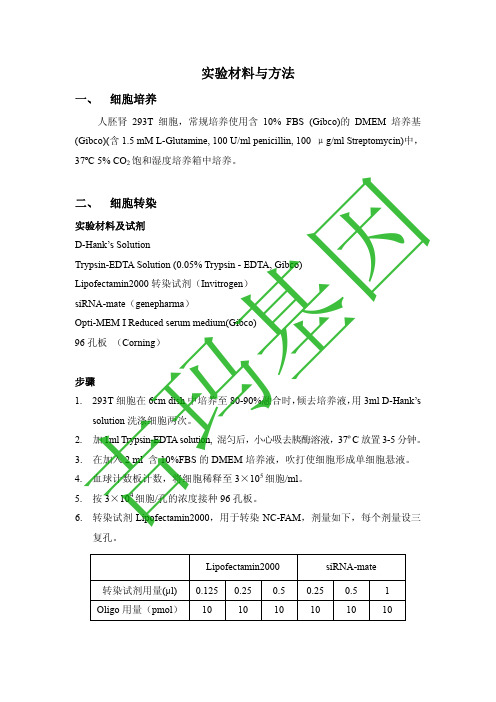
实验材料与方法一、 细胞培养人胚肾293T 细胞,常规培养使用含10% FBS (Gibco)的DMEM 培养基(Gibco)(含1.5 mM L-Glutamine, 100 U/ml penicillin, 100 μg/ml Streptomycin)中,37ºC 5% CO 2饱和湿度培养箱中培养。
二、 细胞转染实验材料及试剂D-Hank’s SolutionTrypsin-EDTA Solution (0.05% Trypsin - EDTA, Gibco)Lipofectamin2000转染试剂(Invitrogen )siRNA-mate (genepharma )Opti-MEM I Reduced serum medium(Gibco)96孔板 (Corning )步骤1. 293T 细胞在6cm dish 中培养至80-90%融合时,倾去培养液,用3ml D-Hank’s solution 洗涤细胞两次。
2. 加1ml Trypsin-EDTA solution, 混匀后,小心吸去胰酶溶液,37ºC 放置3-5分钟。
3. 在加入2 ml 含10%FBS 的DMEM 培养液,吹打使细胞形成单细胞悬液。
4. 血球计数板计数,将细胞稀释至3×105细胞/ml 。
5. 按3×104细胞/孔的浓度接种96孔板。
6. 转染试剂Lipofectamin2000,用于转染NC-FAM ,剂量如下,每个剂量设三复孔。
Lipofectamin2000 siRNA-mate 转染试剂用量(μl)0.1250.25 0.5 0.25 0.5 1 Oligo 用量(pmol )10 10 10 10 10 10 吉玛基因7. 每1 OD 260 oligo 用125 μl DEPC-H 2O 溶解,终浓度约为20 μM 。
8. 在1.5 ml EP 管中加入75 μl (25μl/well*3well )Opti-MEM I ,再加入根据上述表格算出的不同剂量的NC-FAM ,混匀;取另一1.5mlEP 管,加入75 μl (25μl/well*3well )Opti-MEM I ,加入根据上述表格算出的相应剂量的Lipofectamin2000或siRNA-mate ,混匀,室温放置5分钟后将两组管混合,室温放置20分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
转染效率评价标准
转染效率评价标准
转染效率评价标准
转染效率评价标准是评价基因转染效果的重要指标之一。
其评价标准主要包括转染率、转染效率和细胞毒性等方面。
其中,转染率指的是转染剂与细胞发生物理和化学相互作用后,转移到细胞内的基因的比例。
转染效率则是指成功转染的细胞中,基因表达的比例。
细胞毒性则是转染剂对细胞的有害影响。
评价转染效率需要结合不同的实验系统和转染剂进行分析。
通常使用荧光染料或荧光标记的基因来检测转染效率。
在实验设计中,应该考虑到特定细胞系、转染剂浓度、转染时间等因素对转染效率的影响。
同时,应该注意避免转染剂对细胞的毒性影响,以及基因表达的异质性和表达时间的不确定性等问题。
总之,准确评价转染效率需要结合不同的实验条件和指标来综合分析。
在实验设计和实验操作中,应该注意标准化和统一化,以便进行可靠的比较和分析。
- 1 -。
