最新无机物化学命名
无机有机化合物英语命名

6
HClO4 HClO3 HClO2 HClO
perchloric acid chloric acid chlorous acid hypochlorous acid
H2SO4 sulfuric acid H2SO3 sulfurous acid HNO3 nitric acid HNO2 nitrous acid
Tetracarbonylnickel(0) potassium tetrafluoroborate(III) Lithium tetrahydroaluminate(III) potassium hexacyanoferrate(II) Tetraamminecopper(II) sulfate Diamminesilver(I) chloride
19
2 烯烃和炔烃
CH2=CH2 CH2=C=CH2 CH3CH=CHCH3 H2C=CH-CH=CH2 HC CH HC C C CH Ethene 1,2-Propadiene 2-Butene 1,3-Butadiene Ethyne 1,3-Butadiyne
多官能团,加a
20
烯炔的命名
cyano nitrato nitro carbonato acetato Oxalato
CO carbonyl CH3NH2 methylamine Ethylenediamine 9
Ag(NH3)2+ Cu(NH3)42+ [Fe(CN)6]4[BF4][AlF6]3[AuCl4]-
Diamminesilver(I) Tetraamminecopper(II)
[Co(H2O)2(NH3)2(CO2)]NO3 Diammine diaquacarbonatocobalt(III)nitrate
无机物命名

Table 1
Element oxygen chlorine carbon iodine bromine hydrogen nitrogen phosphorus fluorine sulfur Stem ox chlor carb iod brom hydr nitr phosph fluor sulf or sulfur
Binary compounds contain only two different elements. Their names consist of two parts, the name of the more electropositive element followed by the name of the electronegative element, which is nodified to end in –ide.
1.1 Common or Trivial Names
Chemical nomenclature is the system of names that chemists use to identify compounds. Before chemistry was systematized, a substance was given a name that generally associated it with one of its outstanding physical or chemical properties.
1.2 Binary Compounds
无机物的命名

3
P-block Element
IIIA B Boron Al Aluminium Ga Gallium In Indium Tl Thallium IV A C Carbon Si Silicon Ge Germanium Sn Tin Pb Lead VA N Nitrogen P Phosphorus As Arsenic Sb Antimony Bi Bismuth
2) Multivalence ions
Cation’s name = Element(N) + ion
对于有变价的金属元素,除了可用前缀来表 示以外,更多采用罗马数字来表示金属的氧 化态,或用后缀-ous表示低价,-ic表示高价。 For example:
Fe2+ Fe3+ Cr2+ Cr3+ Iron(II) ion or Ferrous ion Iron(III) ion or Ferric ion Chromium(II) ion Chromium(III) ion
Acid radicals for meta-salts(亚酸根-ite) ClO2- Chlorite ion IO2- Iodite ion PO33- Phosphite ion SO32- Sulfite ion Acid radicals for hypo-salts (次酸根 -ite ) ClO- Hypochlorite ion NO2- Nitrite ion
4
Common Transition Elememt
Fe : iron Mn : manganese Cu: copper Zn: zinc Hg: mercury Ag: silver Au: gold
无机物的英文命名

1. 金属氧化物,碱和盐的命名:原则:先说正离子名(对于有变价的金属后面要有价态标志,如I、II、III等),后说负离子名即可。
负离子的命名:(按照负离子的组成分为三类)1) All monoatomic anions have names ending with “ide” for example, F-(fluoride), Cl-(chloride), Br- (bromide), S2- (sulfide) and P3- (phosphide).2) Two polyatomic anions which also have names ending with “ide” are OH-(hydroxide) and CN- (cyanide).3) Many polyatomic anions contain oxygen in addition to another element. The number of oxygen atoms in such oxyanions is denoted by the use of suffixes “ite” and “ate”, meaning fewer and more oxyen atoms, respectively. In cases where it is necessary to denote more than two oxyanions of the same element, the prefixes “hypo” and “per”, meaning still fewer and still more oxygen atoms, respectively, may be used.许多的多原子阴离子(polyatomic anion)除了氧原子之外还有另外一种元素。
这类含氧阴离子(oxyanion)中所含氧的数目由后缀“ite” 和“ate”来表示,分别意味着较多的氧原子和较少的氧原子。
无机化合物的命名规则与化学式写法

无机化合物的命名规则与化学式写法无机化合物是指除了碳元素以外的所有元素的化合物。
无机化合物的命名规则和化学式写法是化学学习的基础,正确的命名和化学式可以准确地表示化合物的组成和结构。
本文将介绍无机化合物命名的基本规则和常见的化学式写法。
1. 金属阳离子的命名金属阳离子的命名通常是根据元素的名称或符号进行命名。
以钠阳离子为例,其名称为“钠离子”,化学符号为“Na+”。
2. 非金属阴离子的命名非金属阴离子的命名一般采用元素名称末尾加上“-ide”。
例如氧化氮的化学式为“NO”,它的阴离子命名为“氧化物离子”。
3. 阴离子的多价有些非金属离子具有多种价态,此时需要在离子名称前加上相应的希腊前缀。
例如二氧化硫的离子式为“SO2-”,它的名称为“亚硫酸根离子”。
4. 阴离子的缩写为了简化无机化合物的命名,常采用阴离子的缩写。
例如氯离子的缩写为“Cl-”。
5. 无机盐的命名无机盐的命名一般以阳离子和阴离子的名称组成。
例如氯化钠的化学式为“NaCl”,它的名称为“氯化钠”。
6. 配合物的命名配合物是由中心金属离子和周围配体组成的化合物。
配合物的命名通常采用中心金属离子的名称或符号,后跟配体的名称。
例如四乙二胺合铁(III)离子的化学式为“[Fe(en)4]3+”,它的名称为“四乙二胺合铁(III)离子”。
7. 有机基团的命名有机基团是在无机化合物中与金属离子或配位离子相结合的有机分子。
有机基团的命名通常以基团名称或缩写加上金属离子的名称或符号。
例如乙酰丙酮基铜(II)的化学式为“Cu(acac)2”,它的名称为“乙酰丙酮基铜(II)”。
8. 化学式的写法化学式用化学元素的符号表示化合物的构成。
对于离子化合物,化学式中应明确表示正负离子的数量以及它们的配比,用括号表示。
例如硫化铜的化学式为“CuS”。
以上是无机化合物的基本命名规则和化学式写法。
在学习无机化学时,正确掌握命名规则和化学式的书写方法非常重要,可以准确理解和表达无机化合物的结构和性质。
无机物命名

无机化合物(无机化合物)英文:inorganic compound.无机化合物,与机体无关的化合物(少数与机体有关的化合物也是无机化合物引,如水),与有机化合物对应,通常指不含碳元素的化合物,但包括碳的氧化物、碳酸盐、氰化物等,简称无机物。
简介绝大多数的无机物可以归入氧化物、酸、碱和盐4大类。
生物体中的无机物主要有水及一些无机离子,如Na+、K+、Ca2+、Mg2+、Cl-、SO42-、等。
参见“生物元素”条.人体组织中几乎含有自然界存在的各种元素,其中除碳、氢、氧和氮主要以有机化合物形式存在外,其余的统称为无机物(矿物质或灰分).所以,无机物主要是由:水和无机盐组成的,其中水又可以分类为:结合水和自由水,结合水是细胞结构的重要组成成分,自由水是良好的溶剂,运输物质,参与化学反应。
无机盐可分为:离子和化合物,离子是维护细胞正常的生命活动,化合物是细胞内化合物的重要组成物分。
分类氧化物由两种元素组成,其中一种元素是氧元素的化合物。
能和氧气反应产生的物质叫做氧化物。
根据化学性质不同,氧化物可分为酸性氧化物和碱性氧化物两大类。
酸性氧化物:能与水作用成酸或与碱作用成盐的氧化物。
例如三氧化硫、五氧化二磷、二氧化碳等,非金属氧化物大多数是酸性氧化物。
碱性氧化物:能跟酸起反应生成盐和水的氧化物,且生成物只能有盐和水,不可以有任何其它物质生成。
碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,如CaO、BaO和CrO、MnO。
无机酸一类在水溶液中能电离产生H 的化合物的总称,与碱相对。
盐酸、硫酸、硝酸在水溶液中电离时,产生的阴离子(酸根)虽各不相同,但产生的阳离子(H )却是相同的,因此它们在性质上有共同的地方,例如具有酸味;能溶解许多金属;能使蓝色石蕊试纸变红等。
狭义的定义:在水溶液中电离出的阳离子全部都是氢离子的化合物(比如硫酸)。
这类物质大部分易溶于水中,少部分,如:硅酸,难溶于水。
酸的水溶液一般可导电,部分酸在水中以分子的形式存在,不导电;部分酸在水中离解为正负离子,可导电。
【2020年高考化学】常见无机物的性质与用途
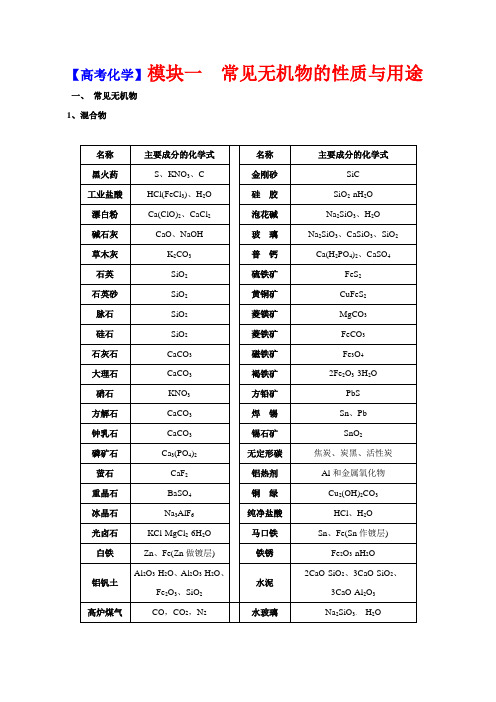
【高考化学】模块一常见无机物的性质与用途一、常见无机物1、混合物2、纯净物二、无机物质的特征性质1、常见物质的颜色全部颜色分类O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化的苯2酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色;Cu紫红色;*甲基橙在pH<3.1的溶液中显红色。
-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫红色4(碘酒褐色);充氩气的灯管蓝紫色;石蕊在pH5~8的溶液中呈紫色。
*甲基橙在pH3.3~4.4的溶液中呈橙色。
Fe(OH)2变成Fe(OH)3的中间产物灰绿色。
晶体棕黄色;FeCl3晶体棕红色。
2、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;*甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·5H2O;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱式碳酸铜绿色。
O褐色;溶解了溴的溴苯褐色;碘酒褐色。
22、物质的状态:常温下为液体的单质:Br2、Hg常温下的常见的无色液体:H2O H2O2常见的气体单质:H2、N2、O2、F2、Cl2、NH3、HF、HCl(HX)、H2S、CO、CO2、NO、NO2、SO2)[注:有机物中的气态烃CxHy(x≤4);有机化学中有许多液态物质,但是含氧有机化合物中只有HCHO常温下是气态]常见的固体单质:I2、At、S、P、C、Si、金属单质;白色胶状沉淀(Al(OH)3、H4SiO4)3、物质的气味:有臭鸡蛋气味的气体:H2S有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水4、物质的毒性:非金属单质有毒的:Cl2、Br2、I2、F2、S、P4常见的有毒气体化合物:CO、NO、NO2、SO2、H2S、能与血红蛋白结合的是CO和NO5、物质的溶解性:极易溶于水的气体:HX、NH3常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2S和P4不溶于水,微溶于酒精,易溶于二硫化碳。
常见无机物命名

常见无机物命名方法常用无机物质的命名Nomenclature Of Inorganic Chemicalselement compound一. 元素和单质的命名“元素”和“单质”的英文意思都是“element ”,有时为了区别,在强调“单质”时可用“free element”。
因此,单质的英文名称与元素的英文名称是一样的。
下面给出的既是元素的名称,同时又是单质的名称。
c二化合物的命名化合物的命名顺序都是根据化学式从左往右读,这与中文读法顺序是相反的。
表示原子个数时使用前缀: mono- di - tritetra penta- hexa- hepta- octa-,nona-,deca-, 但是在不会引起歧义时,这些前缀都尽可能被省去。
1.化合物正电荷部分的读法直呼其名,即读其元素名称。
如CO: carbon monoxide Al2O3: aluminium oxide N2O4 :Dinitrogen tetroxide (tetra-,mono-后缀中的a,o在后一o之前省去) 对于有变价的金属元素,除了可用前缀来表示以外,更多采用罗马数字来表示金属的氧化态,或用后缀-ous表示低价,-ic表示高价。
如 FeO: iron(II) oxide 或 ferrous oxide Fe2O3: iron (III) oxide或ferric oxideCu2O: copper(I) oxide 或cuprous oxide2.化合物负电荷部分的读法:2.1二元化合物2.2非金属氢化物2.3无氧酸2.4含氧酸与含氧酸根阴离子3.2.5盐2.1二元化合物常见的二元化合物有卤化物,氧化物,硫化物,氮化物,磷化物,碳化物,金属氢化物等,命名时需要使用后缀-ide,如:fluoride, chloride, bromide, iodide, oxide ,sulfide ,nitride, phosphide, carbide,hydride; OH -的名称也是用后缀-ide:hydroxide,非金属氢化物不用此后缀,而是将其看成其它二元化合物(见2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学命名法遵循IUPAC命名法。
此命名法参考了《无机化学命名原则(1980)》(中国化学会),NomenclatureofInorganicChemistry,1993(IUPAC),Nomenclature of Inorganic Chemistry,2005(IUPAC)。
还未统一中文命名的名称,以IUPAC英文命名标注,后加括号内有建议使用的中文名称。
中文名无机化学命名法
外文名IUPAC
参考《无机化学命名原则(1980)》
1、化学介词
化合物的系统名称是由其基本构成部分名称连缀而成的。
化学介词,在文法上就是连缀基本构成部分名称以形成化合物名称的连缀词。
化表示简单和化合。
如氯原子(Cl)与钠原子(Na)化合而成的NaCl就叫氯化钠氢氧基(HO—)与钾原子(K)化合而成的KOH就叫氢氧化钾合表示分子与分子或分子与离子相结合,如CaCl2·H2O叫一水合氯化钙,H3O+叫水合氢离子代表示取代了母体化合物中的氢原子,如ClCH2·COOH叫氯代乙酸NH2Cl叫氯代氨NHCl2叫二氯代氨表示硫(或硒、碲)取代氧,如如H2S2O3叫硫代硫酸HSeCN叫硒代氰酸聚表示两个以上同种的分子互相聚合,如(HF)2叫二聚氟化氢(HOCN)3叫三聚氰酸(NaPO3)6叫六聚偏磷酸钠。
2、基和根
基和根是指在化合物中存在的原子基团,若以共价键与其他组分结合者叫做基,以离子键与其他组分结合者叫做根。
一般的基名和根名基和根一般均从其母体化合物命名,称其为某基或某根。
例:
NH3:氨,NH2—:氨基H2SO4:硫酸,HSO4−:硫酸氢根,SO42−:硫酸根
H2SiF6:氟硅酸,SiF6−:氟硅酸根H2C2O4:草酸,C2O42−:草酸根[编辑]特定的基名
和根名基和根也可以联缀其所包括的元素名称来命名,价已满的元素名放在前面,未满的放在后面。
例如:
HO—:氢氧基HS—:氢硫基个别的基和酸,为了命名简便起见,给有特定名称。
无机化合物中常用的特定根、基名称不多,在这里全部列出如下:
羟基:HO—<也可以称作氢氧基,羟(音qiǎng)>
巯基:HS—<也可以称作氢硫基,巯(音qiú)>
羰基:OC=<羰(音tāng)>氰基:NC—<氰(音qíng)>
叠氮基:N3—铵根:NH4+<铵(音ǎn)>
酰基:含氧酸分子中去掉—OH基后剩下的基叫做醯基,酰(音xīan)。
某酸的全部—OH均已去掉时,就从酸名命名为某酰(基);如果只去掉m个—OH基,则称为某酸m酰(基),基字通常可以略去。
例如:
H3PO4:磷酸
H2PO3—:磷酸一酰(基)
HPO2=:磷酸二酰(基)
HPO≡:磷酰(基)
HNO3:硝酸
NO2—:硝酰
HNO2:亚硝酸
NO—:亚硝酰
H2C2O4:草酸
HC2O4—:草酸一酰
C2O2=:草酰(基)
3、离子
元素的离子元素的离子,根据元素名称及其氧化态来命名。
Cl−:氯离子I−:碘离子H+:氢离子Na+:钠离子Zn2+:锌离子Al3+:铝离子Fe3+:铁离子Fe2+:亚铁离子,带电原子团带电的原子团,已如上述成为某根,若需指明其为离子时则称为某离子或某根离子:NH4+:铵离子HSO4−:硫酸氢根离子SO42−:硫酸根离子SiF6−:氟硅酸根离子PO43−:磷酸根离子
特定的词头
亚:比常见的基少含一个氢原子而多一个化合价的基,用词头“亚”表示如:NH2—叫氨基;NH=叫亚氨基
过:—O—O—称为过氧基,—S—S—成为过硫基
4、元素
元素又称化学元素,指自然界中一百多种基本的金属和非金属物质,它们只由几种有共同特点的原子组成,其原子中的每一核子具有同样数量的质子,质子数来决定元素是由种类。
具有相同核电荷数(即质子数)的同一类原子总称为元素。
(在这里,离子是带电荷的原子或原子团)
到目前为止,人们在自然中发现的物质有3000多万余种,但组成他们的元素目前(2010年)只有118种.
所有化学物质都包含元素,即任何物质都包含元素,随着人工的核反应,更多的新元素将会被发现出来。
5、简单含氧酸和简单含氧酸盐
简单含氧酸
酸根中含有氧原子的酸。
皆含有X—O—H键,有的亦含有X—O键等。
根据酸中含氧与否,分为含氧酸和无氧酸。
含氧酸种类繁多,有正酸、原酸、偏酸、亚酸、次酸、高酸、连酸、过氧酸、同多酸、杂多酸、某代酸(代氧,如硫代硫酸)、某取代酸(取代羟基,如卤磺酸)
等。
含氧酸:H2SO4HNO3H3PO4等。
命名:一般命名为某酸
如H2SO4硫酸H3PO4磷酸
在含氧酸中,由同一元素生成的各种组成元素相同的酸,可按其中所含氧原子数多少按顺序冠以高、(正)、亚或次。
其中最常见的酸定名为(正)某酸,比它氧原子数多的冠以高字,比它少的冠以亚字,更少的冠以次字。
如HClO4高氯酸、HClO3氯酸、HClO2亚氯酸或HClO次氯酸
原酸
含氧酸根的化合价与其中氧原子数相同的酸,称为原酸。
命名为原某酸。
比如:H4SiO4原硅酸
偏酸
正酸缩去一水分子而成的酸,称为偏某酸。
例如:H2SiO3(偏)硅酸焦酸(重酸)
由两个简单含氧酸缩去一分子水。
通常命名为焦酸,也有称重酸。
如:2H2SO4-H2O=H2S2O7(焦硫酸)2H2CrO4-H2O=H2Cr2O7(重铬酸)
含氧酸的强弱
判断含氧酸的强弱的方法
将含氧酸改写成(OH)mXOn的形式
例如H2CO3改写成(OH)CO
根据n的值的判断含氧酸的强弱
如果n=0,则为极弱酸如HClO -----(OH)Cl
如果n=1,则为弱酸如H2SiO3 ----(OH)2SiO
如果n=2,则为强酸如H2SO4 ---- (OH)2SO2
如果n=3,则为超强酸如HClO4 ---- (OH)ClO3简单含氧酸盐
由简单含氧酸构成的盐,包括酸式盐碱式盐正盐比如硫化钠,碱式碳酸铜亚硫酸钠等
6、配位化合物
配位化合物(coordination compound)简称配合物,也叫错合物、络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
系统名称是按照《无机化学命名原则》(1980)命名的。
命名时,阴离子在前,阳离子在后。
对于中性和阳离子配合物,首先命名配体,词尾缀以“合”字与金属名称相连,在金属名称之后附加括号的罗马数字,标明氧化态。
有不同配体时,在配体名称之间以中圆点(·)分开。
配体的次序是负离子在前,中性分子在后;无机配体在前,有机配体在后。
相同配体多于一个时,前缀倍数词头二、三等标
明简单基团如氯、硝酸根、水等的数目;对于较复杂的配体如氨基乙酸根H2NCH2COO-、三苯基膦P(C6H5)3等的名称,倍数词头所标的配体加以括号,以免混淆。
阴离子配合物的命名规则相同,但在金属名称后面缀以“酸”字。
配合物中含有连接两个或两个以上金属原子的桥配体时,用前缀μ表示,例如:除系统命名外,配合物也有用俗名命名的,例如K4【Fe(CN)6】称为亚铁氰化钾。
许多普通离子,如CrO?、WO?、SO?、PO?等皆是配离子,因为它们既有中心原子的构型,也有一部分配位键,但它们一向是以普通化合物命名,故不采用系统命名。
又如,PF5和SiF4中没有配位键,为普通化合物,当P和Si与F-以配位键结合形成配离子【PF6】-和【SiF6】2-时,则应命名为六氟合磷酸根离子和六氟合硅酸根离子。
