医疗器械不良事件年度汇总报告表
医疗器械不良事件报告表填写要求

医疗器械不良事件报告表填写要求主要内容:第一部分:《可疑医疗器械不良事件报告表》第二部分:《医疗器械不良事件补充报告表》第三部分:《医疗器械不良事件年度汇总报告表》第四部分:《医疗器械突发性群体不良事件基本信息表》第一部分:《可疑医疗器械不良事件报告表》的填写要求一、法规依据《医疗器械不良事件监测和再评价管理办法(试行)》的第三章第十一条医疗器械生产企业、经营企业应当报告涉及其生产、经营的产品所发生的导致或者可能导致严重伤害或死亡的医疗器械不良事件。
医疗器械使用单位应当报告涉及其使用的医疗器械所发生的导致或者可能导致严重伤害或死亡的医疗器械不良事件。
报告医疗器械不良事件应当遵循可疑即报的原则。
第十二条医疗器械生产企业、经营企业和使用单位发现或者知悉应报告的医疗器械不良事件后,应当填写《可疑医疗器械不良事件报告表》(附件1)向所在地省、自治区、直辖市医疗器械不良事件监测技术机构报告。
其中,导致死亡的事件于发现或者知悉之日起5个工作日内,导致严重伤害、可能导致严重伤害或死亡的事件于发现或者知悉之日起15个工作日内报告。
(一)基本概念医疗器械不良事件是指获准上市的、质量合格的医疗器械在正常使用情况下发生的,导致或可能导致人体伤害的任何有害事件。
严重伤害是指有下列情况之一者:1、危及生命;2、导致机体功能的永久性伤害或者机体结构的永久性损伤;3、必须采取医疗措施才能避免上述永久性伤害或损伤。
(二)报告范围1、死亡事件;2、严重伤害事件;3、可能导致死亡或者严重伤害事件。
(三)报告原则1、基本原则造成患者、使用者或其他人员死亡、严重伤害的事件,可能与使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
医疗器械不良事件报告表

医疗器械不良事件报告表医疗器械不良事件报告表是医疗器械监督管理部门规定的一种重要文件,用于记录和上报医疗器械不良事件的相关信息。
医疗器械不良事件是指使用医疗器械过程中出现的意外事件、不良反应、事故等不良情况。
及时、准确地填写医疗器械不良事件报告表,对于及时发现和解决医疗器械不良事件具有重要意义,有助于保障患者的用药安全和医疗质量。
医疗器械不良事件报告表通常包括以下内容,医疗机构基本信息、不良事件基本信息、医疗器械信息、不良事件的描述和分析、不良事件的处理和结果、报告人信息等。
在填写医疗器械不良事件报告表时,应当尽可能提供详细、准确的信息,以便监管部门对不良事件进行及时、全面的分析和处理。
首先,医疗机构基本信息是医疗器械不良事件报告表的重要组成部分。
医疗机构应当如实填写医疗机构的名称、地址、联系方式等基本信息,以便监管部门能够及时了解并联系到医疗机构。
其次,不良事件基本信息是医疗器械不良事件报告表的核心内容之一。
不良事件基本信息包括不良事件的发生时间、地点、患者基本信息、事件的性质和严重程度等。
这些信息对于监管部门分析不良事件的原因和趋势具有重要意义,有助于采取有效的措施预防和减少类似事件的再次发生。
另外,医疗器械信息是医疗器械不良事件报告表的关键内容之一。
医疗器械信息包括不良事件涉及的医疗器械的名称、型号、规格、生产批号、有效期等。
这些信息对于监管部门对医疗器械的安全性和有效性进行评估和监测具有重要意义,有助于及时发现和召回存在安全隐患的医疗器械。
此外,不良事件的描述和分析是医疗器械不良事件报告表的重要部分。
医疗机构应当如实描述不良事件的经过和相关情况,并对不良事件进行全面、客观的分析。
这有助于发现不良事件的深层原因,为预防类似事件的再次发生提供重要参考。
最后,不良事件的处理和结果是医疗器械不良事件报告表的必要内容。
医疗机构应当如实记录不良事件的处理过程和结果,并根据实际情况采取相应的措施,保障患者的权益和安全。
医疗器械不良事件报告表

报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址:邮编:联系电话:
A.患者资料
1.姓名:
2.年龄:
3.性别男女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件ห้องสมุดไป่ตู้生日期:年月日
7.发现或者知悉时间:年月日
8.医疗器械实际使用场所:
医院诊所家庭其它(请注明):
22.事件初步处理情况:
23.事件报告状态:
已通知医院已通知生产企业
已通知经营企业已通知药检所
D.不良事件评价
24.医院检测机构意见陈述:
25.国家级检测机构意见陈述:
报告人签名:涿州市医院设备科
9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
10.事件陈述:(至少包括医疗设备使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、医疗设备联合使用情况)
报告人:医师技师护士其他
C.医疗设备情况
11.产品名称:
12.商品名称:
13.注册证号:
14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
产品批号:
16.操作人:专业人员非专业人员
患者其它(请注明):
17.有效期至:年月日
18.生产日期:年月日
19.停用日期:年月日
20.植入日期(若植入):年月日
21.事件发生初步原因分析:
医疗器械不良事件年度汇总报告表.doc

附件 3:
医疗器械不良作业年度汇总陈述表陈述时刻:年月日编码:
汇总时刻:年月日至年月日
A. 企业信息
1. 企业称谓 4. 传真
2. 企业地址 5. 邮编
3. 联络人 6. 电话
7.e-mail :
B.医疗器械信息
8. 出产医疗器械称谓、产品称谓、类别、分类代号、注册证号(可另附 A4纸阐明)医疗器械称谓产品称谓类别分类代号注册证号
9. 改动状况(产品注册证书、处理类别、阐明书、规范、使用范围等的改动)
10. 医疗器械不良作业有□无□
1
11. 本企业出产的医疗器械在境内呈现医疗器械不良作业的状况汇总剖析
(作业产生状况、陈述状况、作业描绘、作业究竟作用、企业对作业的剖析、企业对产品选用的办法、触及用户的联络材料,可另附 A4纸)
12. 境外不良作业产生状况
(产品在境外产生不良作业的数量、程度及触及人群材料等)
C.点评信息
13. 省级监测
技能组织定见
14. 国家监测
技能组织定见
陈述人 : 省级监测技能组织接纳日期:国家监测技能组织接纳日期:
出产企业 (签章)
国家食品药品监督处理局制
2。
医疗器械不良事件调查报告记录表

3.医疗器械产品标准;
4.医疗器械检测机构出具的检测报告;
5.产品标签;
6.使用说明书复印件;
7.产品年产量、销量;
8.用户分布及联系方式;
9.本企业生产同类产品名称、标识及临床应用情况。
D.监测机构评价意见
报告人:
省级监测机构பைடு நூலகம்收日期:
国家监测机构接收日期:
生产企业(签章)
医疗器械不良事件调查报告记录表
医疗器械不良事件调查、报告记录表
报告时间: 年 月 日
A. 企业信息
企业名称:
传真:
企业地址:
邮编:
联系人:
电话:
事件涉及产品:
B.事件跟踪信息(至少包括:患者资料、调查分析及控制措施)
C.产品信息
请依次粘贴或装订下列材料(要求采用A4纸张):
1.医疗器械生产许可证复印件(境内企业);
省级监测机构(签章)
医疗器械不良反应报告表

附件1:《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期:报告来源:联系地址:年月曰生产企业经营企业编码:使用单位单位名称:邮编:联系电话:A •患者资料1.姓名: 2 .年龄:3•性别男女4 •预期治疗疾病或作用:B .不良事件情况5 •事件主要表现:6•事件发生日期:年月曰7 •发现或者知悉时间:年月曰8.医疗器械实际使用场所:医疗机构家庭其他(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能结构永久性损伤;需要内、外科治疗避免上述永久损伤;其他(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、岀现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人:医师技师护士其他填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□ 口□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写XX子或XX女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1岁,应填写具体的月份或天数, 如6个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“口中划“/。
医疗器械不良事件企业汇总报告表
13.省级监测技术机构意见
14.国家监测技术机构意见
报告人:省级监测技术机构接收日(签章)
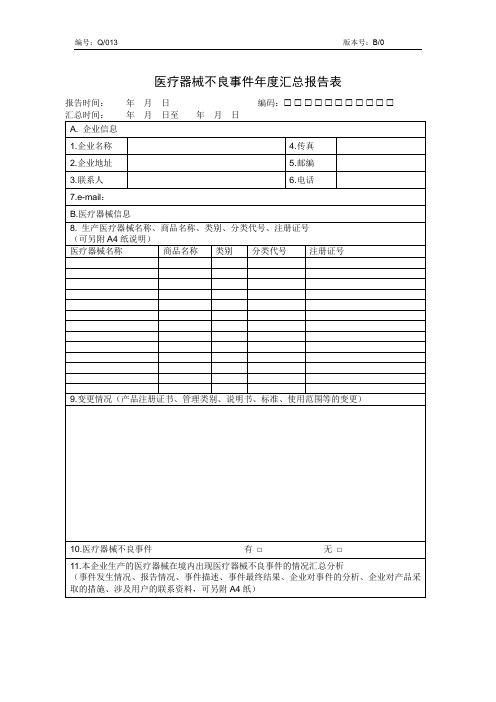
医疗器械不良事件年度汇总报告表
报告时间:年月日编码:
汇总时间:年月日至年月日
A.企业信息
1.企业名称
4.传真
2.企业地址
5.邮编
3.联系人
6.电话
7.e-mail:
B.医疗器械信息
8.生产医疗器械名称、商品名称、类别、分类代号、注册证号
(可另附A4纸说明)
医疗器械名称
商品名称
类别
分类代号
注册证号
9.变更情况(产品注册证书、管理类别、说明书、标准、使用范围等的变更)
10.医疗器械不良事件有□无□
11.本企业生产的医疗器械在境内出现医疗器械不良事件的情况汇总分析
(事件发生情况、报告情况、事件描述、事件最终结果、企业对事件的分析、企业对产品采取的措施、涉及用户的联系资料,可另附A4纸)
12.境外不良事件发生情况
(产品在境外发生不良事件的数量、程度及涉及人群资料等)
《医疗器械不良事件年度汇总报告表》填写要求

《医疗器械不良事件年度汇总报告表》 医疗器械不良事件年度汇总报告表》 填报要求?为什么进行汇总分析1.《医疗器械不良事件监测和再评价管理办法(试行) 1.《医疗器械不良事件监测和再评价管理办法(试行)》的要求第三章 第十六条第二类、第三类医疗器械生产企业应 当在每年1月底前对上一年度医疗器械不 良事件监测情况进行汇总分析,并填写 《医疗器械不良事件年度汇总报告表》, 报所在地省、自治区、直辖市医疗器械不 良事件监测技术机构。
医疗器械经营企业、使用单位 和第一类医疗器械生产企业应当在第三章 第十六条每年1月底之前对上一年度的医疗器 械不良事件监测工作进行总结,并 保存备查。
《办法》对汇总工作的要求 办法》汇总时间:每年汇总一次,每年的1月底前。
第二、三类医疗器械生产企业;汇总要求: 对上一年度医疗器械不良事件监测情况进行汇总分析 填写并报告《医疗器械不良事件年度汇总报告表》第一类医疗器械生产企业、医疗器械经营企业、使用单位汇总要求: 上一年度的医疗器械不良事件监测工作进行总结, 并保存备查。
?为什么进行汇总分析2.通过汇总分析, 2.通过汇总分析,发现问题 通过汇总分析安全用械 器械存在的 安全性问题 企业和产品发展的需要?《医疗器械不良事件年度汇总报告表》 医疗器械不良事件年度汇总报告表》 如何填报一、《汇总报告表》报告流程 汇总报告表》注意! 注意!汇总期内无可疑医疗器械不良事件发生,也 需填报《医疗器械不良事件年度汇总报告表》。
注册证已过期,但在有效期内的产品,发生 不良事件时,也需汇总。
二、《汇总报告表》的内容 汇总报告表》1.企业信息 企业信息第1项至第7项负责不良事件监测工作的具体联系人 及其联系方式 出现变更时,应及时更改2.医疗器械信息 医疗器械信息汇总期内,本企业生产、经营的全部医疗器械的信息第8项 项仔细填写 医疗器械的产品名称器械的商品名,如无商品名称, 请填写“无”。
如有英文名,可在按照《医疗器械分类目录》中的分类进行填写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(事件发生情况、报告情况、事件描述、事件最终结果、企业对事件的分析、企业对产品采 取的措施、涉及用户的联系资料,可另附A4纸)
12.境外不良事件发生情况
(产品在境外发生不良事件的数量、程度及涉及人群资料等)
C评价信息
13.省级监测技 术机构意见
14.国家监测技 术机构意见
报告人:省级监测技术机构接收日期:国家监测技术机构接收日期:
生产企业(签章)
国家食品品监督管理局制
附件
A.企业信息
1.企业名称
4.传真
2•企业地址
5.邮编
3.联系人
6.电话
7.e-mail:
B.医疗器械信息
8.生产医疗器械名称、商品名称、类别、分类代号、注册证号 (可另附A4纸说明)
医疗器械名称
商品名称
类别
分类代号
注册证号
9.变更情况(产品注册证书、管理类别、说明书、标准、使用范围等的变更)
10.医疗器械不良事件有口无口
