共沸精馏 曹新月
天津大学化工学院专业实验实验报告2 共沸精馏

0.724
1.000
1.170
表 5-2 原料及产品质量记录表
原料
塔顶回收液
乙醇/g
苯/g
80.0
39.1
富水相/g 9.0
富苯相/g 25.8
塔釜回收液/g 68.1
6
共沸精馏实验报告
表 5-3 塔釜气相色谱分析数据记录表
取样时间
峰序号
保留时间/min
峰面积
峰面积百分比/%
1
0.429
15:00
70.1
0.20
75.3
0.20
76.3
0.22
76.3
0.20
76.3
0.20
76.2
0.20
76.2
0.20
塔釜加热电 流/A 0.37 0.37 0.37 0.37 0.37 0.37 0.37 0.37
下段加热电 流/A 0.20 0.19 0.19 0.20 0.19 0.19 0.19 0.19
88.19856 11.80144
时间
14:12 14:53 15:13 15:33 15:53 16:13 16:33 16:53
塔顶温度 /℃ 30.2 62.7 63.2 63.2 63.4 63.3 63.4 63.4
表 5-6 电流-温度变化表
塔釜温度 /℃ 26.6
上段加热电 流/A 0.22
本实验要求的是由乙醇-水混合物制取纯乙醇,但由水-乙醇的汽液平衡相 图(图 2-1)可知,水-乙醇体系存在最低恒沸点,故无法通过一次蒸馏得到纯 乙醇。为此采用特殊精馏操作得到纯乙醇。
图 2-1 乙醇-水二元体系的 T-xy 图
1
共沸精馏实验报告
天津大学—共沸精馏实验报告

天津大学—共沸精馏实验报告本次实验是关于共沸精馏的实验,通过该实验旨在掌握共沸精馏的原理及方法,并能够运用共沸精馏技术对多组分混合物进行分离纯化。
实验仪器与试剂:1. 蒸馏装置:共沸精馏塔、比重计、冷却器、加热器、恒温水浴等。
2. 试剂:氧化铝、异丙醇、甲醇、正丁醇、苯醚等。
实验方法:1. 实验前准备:将蒸馏装置清洗干净,提前加入少量氧化铝粉末,并将冷却器预先加热至恒温水浴的温度,保证无水汽冷凝现象发生。
2. 实验操作步骤:① 将多组分混合物放入共沸精馏塔中,加热至大气压下的沸点。
比重较小的组分先挥发出来,通过冷凝器和收集瓶收集。
② 在比重较小的组分挥发完毕后,温度会上升。
当温度稳定时,表明混合物即将共沸。
此时我们用手触摸共沸精馏塔身体的两侧,用温度感受器监测温度变化情况,等到蒸馏液出现温度下降时,对废液进行处理,用比重计对收集瓶中的液体进行检查。
③ 重复步骤①、步骤②,直到所有组分均被收集。
实验结果:通过实验,我们将氧化铝、异丙醇、甲醇、正丁醇、苯醚等多个组分的混合物进行了共沸精馏。
结果表明,在温度约为78℃的时候,异丙醇和甲醇两个组分同时开始挥发,形成共沸。
在此温度下,我们从收集瓶中检测到挥发的物质的比重,发现仅为0.79,是两种组分的比重的平均值。
这说明,经过共沸精馏后,我们获得的是两种组分的混合物而非单一物质。
总结:通过本次实验,我们成功运用了共沸精馏技术,对多组分混合物进行了分离纯化。
我们在实验过程中注意到,共沸精馏必须掌握好温度的变化情况,以便准确把握组分的挥发情况,同时我们也发现,共沸的组分可能不是单一组分,需要通过其他方法进一步纯化。
在未来的实验中,我们还需进一步探究并掌握其他的分离方法以满足不同物质的分离需求。
天津大学—共沸精馏实验报告

—
0.20
61.8
75.7
1550
1600 44
—
峰的百分含量/%
水 乙醇 苯
——
—
2.14 79.5 740 546 1.95 97.1 409 784 1.71 98.2 286 8714 1.28 98.7 366 1634 0.95 99.0 919 4081
18.2 9793 0.86 7507 —
1
7.2 全塔物料衡算所需的实验数据.................................................11 7.3 三元共沸物组成的误差及其分析.............................................11
2
一、实验目的
1> 通过实验加深对共沸精馏过程的理解; 2> 熟悉精馏设备的构造,掌握精馏操作方法; 3> 能够对精馏过程做全塔物料衡算; 4> 学会使用气相色谱分析气、液两相组成;
75.7
1179
2059 04
—
0.56 99.4 934 3066
—
表 4 塔顶塔釜产物分析记录
物相名 质量/g
称
峰面积/µV*s
水
乙醇
苯
峰的百分含量/%
水
乙醇
苯
富水相 富苯相 塔釜液
3.1 装置............................................................................................... 4 3.2 流程............................................................................................... 4 3.3 试剂............................................................................................... 5 四、实验步骤............................................................................................................5 五、原始数据记录表..............................................................................................6 六、数据处理............................................................................................................8 6.1 全塔物料衡算及塔顶三元共沸物的组成分析.......................... 8
实验四 共沸精馏法制取无水乙醇 实验指导书
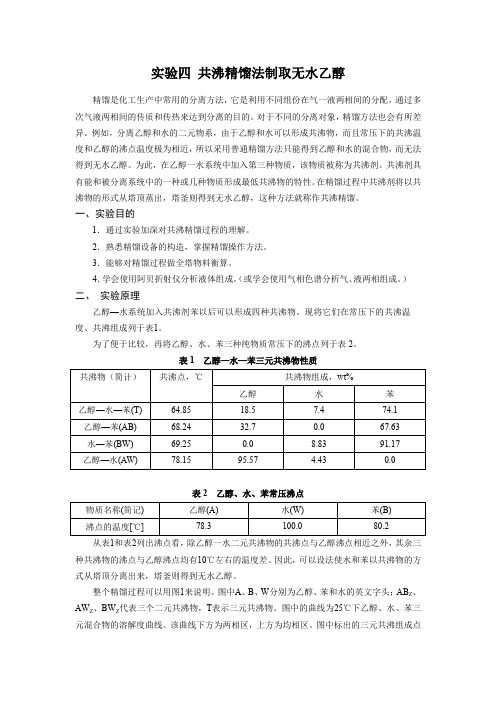
实验四共沸精馏法制取无水乙醇精馏是化工生产中常用的分离方法,它是利用不同组份在气一液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如,分离乙醇和水的二元物系,由于乙醇和水可以形成共沸物,而且常压下的共沸温度和乙醇的沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水的混合物,而无法得到无水乙醇。
为此,在乙醇一水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇,这种方法就称作共沸精馏。
一、实验目的1.通过实验加深对共沸精馏过程的理解。
2.熟悉精馏设备的构造,掌握精馏操作方法。
3.能够对精馏过程做全塔物料衡算。
4.学会使用阿贝折射仪分析液体组成。
(或学会使用气相色谱分析气、液两相组成。
)二、实验原理乙醇—水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表1。
为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
表1 乙醇—水—苯三元共沸物性质表2 乙醇、水、苯常压沸点从表1和表2列出沸点看,除乙醇一水二元共沸物的共沸点与乙醇沸点相近之外,其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。
因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
整个精馏过程可以用图1来说明。
图中A、B、W分别为乙醇、苯和水的英文字头;AB Z、AW Z、BW Z代表三个二元共沸物,T表示三元共沸物。
图中的曲线为25℃下乙醇、水、苯三元混合物的溶解度曲线。
该曲线下方为两相区,上方为均相区。
图中标出的三元共沸组成点T是处在两相区内。
以T为中心,连接三种纯物质A、B、W及三个二元共沸点组成点ABz、AWz、BWz,将该图分为六个小三角形。
如果原料液的组成点落在某个小三角形内,当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。
共沸精馏

化工专业实验报告实验名称:共沸精馏实验人员:徐继盛同组人:赵乐、陈思聪实验地点:天大化工技术试验中心624室实验时间:2014年5月21日年级 2011 ;专业化工;组号 10 ;学号 3011207115 指导教师:齐晓舟实验成绩:一、实验目的1.通过实验加深对共沸精馏过程的理解。
2.熟悉精馏设备的构造,掌握精馏操作方法。
3.能够对精馏过程做全塔物料衡算。
4. 学会使用气相色谱分析气、液两相组成。
二、实验原理1.过程原理精馏是利用不同组份在气一液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如,分离乙醇和水的二元物系。
由于乙醇和水可以形成共沸物,而且常压下的共沸温度和乙醇的沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水的混合物,而无法得到无水乙醇。
为此,在乙醇一水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。
这种方法就称作共沸精馏。
乙醇—水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表 1。
为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
从表1和表2列出沸点看,除乙醇一水二元共沸物的共沸点与乙醇沸点相近之外,其余三种共沸物的沸点与乙醇沸点均有10 ℃左右的温度差。
因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
整个精馏过程可以用图1来说明。
图中A、B、W分别为乙醇、苯和水的英文字头;ABZ 、AWZ、BWZ代表三个二元共沸物,T表示三元共沸物。
图中的曲线为25℃下乙醇、水、苯三元混合物的溶解度曲线。
该曲线下方为两相区,上方为均相区。
图中标出的三元共沸组成点T是处在两相区内。
以T为中心,连接三种纯物质A、B、W及三个二元共沸点组成点ABZ 、AWZ、BWZ,将该图分为六个小三角形。
多组分共沸混合物精馏工艺流程的研究

多组分共沸混合物精馏工艺流程的研究1、萃取精馏的原理在基本有机化工生产中,经常会遇到组分的相对挥发度比较接近,组分之间也存在形成共沸物的可能性。
若采用普通精馏的方法进行分离,将很困难,或者不可能。
对于这类物系,可以采用特殊精馏方法,向被分离物系中加入第三种组分,改变被分离组分的活度系数,增加组分之间的相对挥发度,达到分离的目的。
如果加入的溶剂与原系统中的一些轻组分形成最低共沸物,溶剂与轻组分将以共沸物形式从塔顶蒸出,塔底得到重组分,这种操作称为共沸精馏;如果加入的溶剂不与原系统中的任一组分形成共沸物,其沸点又较任一组分的沸点高,溶剂与重组分将随釜液离开精馏塔,塔顶得到轻组分,这种操作称为萃取精馏。
2、溶剂甄选原理由于萃取精馏混合物多为强非理想性的系统,所以工业生产中选择适宜溶剂时主要应考虑以下几点:(1)选择性:溶剂的加人必须使待拆分组分的相对溶解度提高明显,即为建议溶剂具备较低的选择性,以提升溶剂的利用率;2)溶解性:要求溶剂与原有组分间有较大的相互溶解度,以防止液体在塔内产生分层现象,但具有高选择性的溶剂往往伴有不互溶性或较低的溶解性,因此需要通过权衡选取合适的溶剂,使其既具有较好的选择性,又具有较高的溶解性;(3)沸点:溶剂的沸点应当低于原进料混合物的沸点,以避免构成溶剂与组分的共沸物。
但也无法过低,以防止导致溶剂回收塔釜梅过低。
目前提炼减压蒸馏溶剂甄选的方法存有实验法、数据库查阅法、经验值方法、计算机辅助分子设计法用实验法甄选溶剂就是目前应用领域最广泛的方法,可以获得较好的结果,但是实验花费很大,实验周期较长。
实验法存有轻易法、沸点仪法、色谱法、气论调等。
实际应用领域过程中往往须要几种方法融合采用,以延长吻合目标溶剂的时间。
溶剂甄选的通常过程为:经验分析、理论指导与计算机辅助设计、实验检验等。
若文献资料和数据不全系列,则只有实行最基本的实验方法,或者实行极具应用领域前景的计算机优化方法以谋求最佳溶剂。
什么是恒沸精馏(共沸精馏)

一、什么是恒沸精馏(共沸精馏)在被分离的物系中加入共沸剂(或者称共沸组分),该共沸剂必须能和物系中一个或几个组分形成具有最低沸点的恒沸物,以至于使需要分离的集中物质间的沸点差(或相对挥发度)增大。
在精馏时,共沸组分能以恒沸物的形式从精馏塔顶蒸出,工业上把这种操作称为恒沸精馏。
下面以制取无水酒精为例,说明恒沸精馏的过程,水和酒精能形成具有恒沸点的混合物,所以用普通的精馏方法不能获得纯度超过96%(体积)的乙醇,若在酒精和水的溶液中加入共沸组分-苯,则可构成各种恒沸混合物,但以酒精、苯和水所组成的三组分恒沸混合物的沸点为最低(64.84℃)。
当精馏温度在64.85℃时,酒精、苯和水的三元混合物首先被蒸出;温度升至68.25℃时,蒸出的是酒精与苯的二元恒沸混合物;随着温度继续上升,苯与水的二元恒沸混合物和酒精与水的二元恒沸混合物也先后蒸出,这些恒沸物把水从塔顶带出,在塔釜可以获得无水酒精。
工业上广泛地用于生产无水酒精的方法,就是根据此原理。
恒沸精馏的过程中,所加入的共沸组分必须从塔顶蒸出,而后冷凝分离,循环使用。
因而恒沸精馏消耗的能量(包括汽化共沸剂的热量和输送物料的电能)较多。
二、什么是萃取精馏?在被分离的混合物中加入萃取剂,萃取剂的存在能使被分离混合物的组分间的相对挥发度增大。
精馏时,其在各板上基本保持恒定的浓度,而且从精馏塔的塔釜排出,这样的操作称为萃取精馏。
例如,从烃类裂解气的碳四馏分费力丁二烯时,由于碳四馏分的各组分间沸点相近及相对挥发度相近的特点,而且丁二烯与正丁烷还能形成共沸物,采用普通的精馏方法是难以将丁二烯与其它组分加以分离的。
如果采用萃取精馏的方法,在碳四馏分中加入乙腈做萃取剂,则可增大组分间的相对挥发度,使得用精馏的方法能将沸点相近的丁二烯、丁烷和丁烯分离。
碳四馏分经过脱碳三、和碳五馏分后,进入丁二烯萃取剂精馏塔,在萃取剂乙腈的存在下,使丁二烯(包括少量的炔烯)、乙腈与其它组分分开,从塔釜采出并进入解析塔,在此塔中,丁二烯、炔烯从乙腈中解析出来,萃取剂循环使用。
共沸精馏分离生物醇-水混合物的模拟与优化

Abstract: Water in the isopropanol-butanol-ethanol-water ( IBE-H2 O) system is separated by azeotropic distillation process after liquid-liquid extraction. Aspen Plus is used to simulate the continuous azotropic distilation process.Efects of entrainer flow rate and outputquantity at the botom and feed location on the product purity and heat duty are analyzed to obtain the optimal
operationparameters.Simulationresultsindicatethatmethyl/er/-butylether (MTBE) canbeused as azeotropic entrainer.From the simulation results, it can be concluded that the optimum process
优选的共沸剂为甲基叔丁基瞇(MTBE);最佳精憎流程的共沸剂循环量为58 kmol/h,理论塔板总数为15&进料位
置在塔上部第3块塔板处;提纯得到混合醇产品中IBE的摩尔分数可达到99.6% ;且此时共沸精憎流程经济最优%
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
22437 103431 13804 38889 162020 24994
16.06428 74.05234 9.88338 17.21478 71.72136 11.06387
组分质量/g 乙醇:10.03g 水:1.99g 苯:2.08g
计算举例:
标准液中水浓度 =
水的峰面积*$%
(1)
水的峰面积*$%&乙醇的峰面积&苯的峰面积*$'
12 加料口; 13 出料口
图 2 共沸精馏实验装置
本实验所用的精馏塔为内径Ф20mm 的玻璃塔。内装三角螺旋高效散装填料。 填料层高度 1.2m。
塔釜为一只结构特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样; 下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜 底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制 加热温度,使塔釜的传热量基本保持不变。塔釜加热沸腾后产生的蒸汽经填料层 到达塔顶全凝器。为了满足各种不同操作方式的需要,在全凝器与回流管之间设 置了一个特殊构造的容器。在进行分相回流时,它可以用作分相器兼回流比调节 器;当进行混相回流时,它又可以单纯地作为回流比调节器使用。这样的设计既 实现了连续精馏操作,又可进行间歇精馏操作。
乙醇-苯(ABz)
68.24
32.70
0.0
67.63
苯-水(BWz)
69.25
0.0
8.83
91.17
乙醇-水(AWz)
78.15
95.57
4.43
0.0
物质名称(简记) 沸点温度/℃
表 2 乙醇、水、苯的常压沸点
乙醇(A)
水(W)
78.30
100.0
苯(B) 80.20
从表 1 和表 2 列出的沸点看,除乙醇——水二元共沸物的共沸点与乙醇沸点 相近之外,其余三种共沸物的沸点与乙醇沸点均有 10℃左右的温度差。因此,可 以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
釜热控 温/℃ 24.7 69.3 69.8 73.7 74.7
回流比 现象或操作
全回流 全回流 5:1 5:1 1:3
开始回流 调整回流比
出现溢流调 整回流比
15:21 15:45
0.10 0.10
组分
水 1
乙醇 水 0 0.10
60.4 60.3
74.8 74.8
=
m苯
m苯 + m水 + m醇
=
2.08 2.08 + 1.99 + 10.03
= 0.1475
两次色谱分析中水、醇、苯的平均峰面积百分含量分别为:
16.63953,72.88685,10.47363
������) = 0.1411 ∗ 10.47363 = 0.602131 ������* 0.1475 ∗ 16.63953
3750
1.15644
320538 98.84356
无苯
0.010052 0.989948
表 9 塔釜液气相色谱分析结果
组分
保留时间 峰面积
峰面积 校正后实际
/min
百分含量/% 百分含量
水 乙醇 水 乙醇
0.090 0.264 0.087 0.255
1240 128574 1519 157996
0.95533 99.04467 0.95257 99.04743
代入(1):标准液中水浓度 =
水的峰面积∗6%
(4)
水的峰面积∗6%&乙醇的峰面积&苯的峰面积∗6%/8.98*):)
代入数据解得
������) = 0.8679
������*
=
������) 0.602131
=
0.8679 0.602131
=
1.4414
组分 质量相对校正因子
表 4 质量相对校正因子表
整个精馏过程可以用图 1 来说明。图中 A、B、W 分别为乙醇、苯和水的英 文字头;ABZ、AWZ、BWZ 代表三个二元共沸物,T 表示三元共沸物。图中的曲 线为 25℃下乙醇、水、苯三元混合物的溶解度曲线。该曲线下方为两相区,上方 为均相区。图中标出的三元共沸组成点 T 是处在两相区内。
图 1 三元相图 以 T 为中心,连接三种纯物质 A、B、W 及三个二元共沸点组成点 ABZ、 AWZ、BWZ,将该图分为六个小三角形。如果原料液的组成点落在某个小三角形 内。当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代 表的物质。故要想得到无水乙醇,就应该保证原料液的组成落在包含顶点 A 的 小三角形内,即在ΔATABZ 或ΔATAWZ 内。从沸点看,乙醇——水的共沸点和 乙醇的沸点仅差 0.15℃,就本实验的技术条件无法将其分开。而乙醇——苯的共
标准液中苯浓度 =
苯的峰面积*$%
(2)
水的峰面积*$%&乙醇的峰面积&苯的峰面积*$'
(1)式与(2)式相除,整理得:$% = 标准液中水浓度*苯的峰面积
(3)
$' 标准液中苯浓度*水的峰面积
标准液中
w水
=
m苯
m水 + m水
+ m醇
=
1.99 2.08 + 1.99 + 10.03
=
0.1411
w水
2.34308
0.260
144039 88.49205
1.783
14918
9.16486
校正后实际 百分含量
0.035592 0.839164 0.125244 0.019603 0.853052 0.127345
样品 富水相
富苯相
表 11 塔顶馏出液气相色谱分析结果
分析次数 组分 保留时间 峰面积 峰面积
水
乙醇
0.8679
1.0000
苯 1.4414
下面以富水相中的水第一次色谱分析结果为例计算校正后的实际百分含量:
������水 ∗ ������水
0.8679 ∗ 37.2614
������水 =
=
= 0.321415
������> ∗ ������> 37.2614 ∗ 0.8679 + 50.1935 + 12.5449 ∗ 1.4414
此外,需要特别说明的是在进行分相回流时,分相器中会出现两层液体。上 层为富苯相、下层为富水相。实验中,富苯相由溢流口回流入塔,富水相则采出。 当间歇操作时,为了保证有足够高的溢流液位,富水相可在实验结束后取出。
2、试剂 实验试剂为:含水乙醇、苯。试剂中各组分的含量采用色谱分析得到。
四、 实验步骤
1、称取 59.51g 的含水乙醇和 29.37g 的苯,加入塔釜中,封口不要拧太紧, 并对原料乙醇进行色谱分析,确定其组成。
取样时间 15:34 15:44
分析次数 1 2
组分
水 乙醇 苯 水 乙醇 苯
表 8 塔釜气相色谱分析结果
保留时间 峰面积
峰面积 校正后实际
/min
百分含量/% 百分含量
0.087 0.231
4170
1.21002
3408487 98.78998
无苯
0.010519 0.989481
0.075 0.219
沸点与乙醇的沸点相差 10.06℃,很容易将它们分离开来。所以分析的最终结果 是将原料液的组成控制在 ΔATABZ 中。
图 1 中 F 代表未加共沸物时原料乙醇、水混合物的组成。随着共沸剂苯的加 入,原料液的总组成将沿着 FB 连线变化,并与 AT 线交于 H 点,这时共沸剂苯 的加入量称作理论共沸剂用量,它是达到分离目的所需最少的共沸剂量。
2、向全凝器中通入冷却水,并开启釜电加热系统,调节加热电流慢慢升至 0.4A(注意不要使电流过大,以免设备突然受热而损坏)。待釜液沸腾,开启塔 身保温电源,调节保温电流,上段为 0.1A,下段为 0.1A,以使填料层具有均匀 的温度梯度,保证全塔处在正常的操作范围内。
3、每隔 20min 记录一次加热电流、保温电流、塔顶温度、塔釜温度。 4、当塔头有液体出现,全回流 30min 稳定后,调节回流比进行混相回流操 作,回流比为 5:1。 5、称量 1.99g 水、10.03g 乙醇、2.08g 苯配制标准溶液,并对标准液进行色 谱分析,计算校正因子。
6、待分相器内液体开始溢流,并分成两相,上层为苯相,下层为水相,且 能观察到三元共沸物在苯相苯中以水珠形态穿过,溶于水相中,此时,调节回流 比为 1:3。
7、取塔釜气相样品分析组成。待塔釜中无苯存在时,停止加热,取出釜液, 称重、分析组成。
8、将塔顶馏出液用分液漏斗分离,分别称重,依次用气相色谱仪分析富水 相、富苯相组成。
/min
百分含量/%
1
水
0.087 50232 37.2614
乙醇 0.287 67666 50.1935
苯
1.780 16912 12.5449
2
水
0.090 79148 37.7265
乙醇 0.282 105209 50.1487
苯
1.737 25415 12.1140
1
水
0.056
4369
3.13947
乙醇——水体系加入共沸剂苯以后可以形成四种共沸物。现将它们在常压下 的共沸温度、共沸组成列于表 1。
为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表 2。
表 1 乙醇、水、苯形成的共沸物性质
共沸物(简记)
共沸点/℃
共沸物组成,t/%
乙醇
水
苯
乙醇-水-苯(T)
64.85
18.50
7.40
74.10
