化工分离过程-吸收
化工原理 第六章 吸收

不同的溶质在同一个溶剂中的溶解度不同,溶解度很大的
气体称为易溶气体,溶解度很小的气体称为难溶气体;同
一个物系,在相同温度下,分压越高,则溶解度越大;而
分压一定,温度越低,则溶解度越大。这表明较高的分压
和较低的温度有利于吸收操作。在实际吸收操作过程中,
溶质在气相中的组成是一定的,可以借助于提高操作压力
.
第二节 吸收中的气液相平衡
相平衡关系随物系的性质、温度和压力而异,通常由
实验确定。图6-3是由实验得到的SO2和NH3在水中的溶解度
曲线,也称为相平衡曲线。图中横坐标为溶质组分(SO2、
NH3)在液相中的摩尔分数
x
,纵坐标为溶质组分在气相中
A
的分压 p A 。从图中可见:在相同的温度和分压条件下,
体,该值很小。
2.2注意事项
①亨利定律只适用于稀溶液,如常压下难溶或少溶气体的吸收, 否则就有偏差;
②只适用于与溶剂不发生化学反应的气体的吸收;
③溶解度系数随温度升高而降低,即T↑,H↓;
④应用于较高压强时,如5atm以上,分压应以逸度代替;
⑤为了使用方便,亨利定律可以改写成以下形式:
pA ExA, yA mxA,
图6-4 吸收平衡线
.
第二节 吸收中的气液相平衡
2.相平衡线在吸收过程中的应用 2.1判断吸收能否进行。由于溶解平衡是吸收进行的极限,所以, 在一定温度下,吸收若能进行,则气相中溶质的实际组成 Y A 必须大 于 则与过液程相反中向溶进质行含,量为成解平吸衡操时作的。组图成6-4Y中A ,的即A点YA 为 Y实A。 际若操出作现点Y,A 若 AY 点A 时位, 于平衡线的上方,则 YA为吸Y A 收过程;若A点在平衡线上,YA=YA*,体 系达平衡,吸收过程停止;当A点位于平衡线的下方时,则YA<YA*,为解 吸过程。 2.2 确定吸收推动力。显然,YA>YA*是吸收进行的必要条件,而差 值 △YA=YA-YA* 则是吸收过程的推动力,差值△YA越大,则吸收速率必 然越大。 2.3同理,若以液相为研究对象,在一定条件下,要让吸收过程能进 行,则液相中溶质的实际组成XA必须小于与实际气相中溶质含量YA成平 衡时的液相组成XA*,即XA<XA*,差值△XA=XA* -XA即为吸收过程的推动力, 该值越大,吸收速率也就越大。否则,过程必为解吸操作。
化工分离工程第7章 吸附

FLGC
活性氧化铝和分子筛的脱水性能比较
活性氧化铝:在水蒸气分压高的范围内吸附容量较高 沸石分子筛:在低水蒸气分压下吸附容量较高 因此,若要求水蒸气的脱除程度高,应选用? 若吸附容量更为重要,则应选用? 也可混用,先用氧化铝脱除大部分水,之后用分子筛进 行深度干燥。
FLGC
其他吸附剂
反应性吸附剂:能与气相或液相混合物中多组分进行化学 反应而使之去除。适用于去除微量组分(反应不可逆,不 能现场再生;吸附负荷高时,吸附剂更换过于频繁,不经 济)。 生物吸着剂:利用微生物将吸附的有机物氧化分解成二氧 化碳和水等,如工业废水的生化处理
FLGC
分子筛
分子筛亦称沸石,是一种晶态的金属水合铝硅酸盐晶体。
化学通式:Mex/n[(AlO2)x(SiO2)y]mH2O,其中Me阳离子,n 为原子价数,m为结晶水分子数 每一种分子筛由高度规则的笼和孔组成,它具有高度选择 性吸附性能,是由于其结构形成许多与外部相通的均一微 孔。
FLGC
根据原料配比、组成和制造方法不同可以制成各种孔 径和形状的分子筛。见课本表7-3。 强极性吸附剂,对极性分子如H2O、CO2、H2S等有 很强的亲和力,对氨氮的吸附效果好,而对有机物的 亲和力较弱。 分子筛主要用于气态物的分离和有机溶剂痕量水的去 除。
工业吸附剂可以是球形、圆柱形、片状或粉末状 粒度范围从50μm至1.2cm,比表面积从300至1200m2/g, 颗粒的孔隙度30%—85%, 平均孔径1-20nm 孔径:按纯化学和应用化学国际协会的定义,微孔孔径 小于2nm,中孔为2~50nm,大孔大于50nm
FLGC
1.密度
1)填充密度B(又称体积密度): 是指单位填充体积的吸 附剂质量。通常将烘干的吸附剂装入量筒中,摇实至体积 不变,此时吸附剂的质量与该吸附剂所占的体积比称为填 充密度。
化工分离技术-吸收与解析

化工分离技术吸收与解吸操作院系:化工学院班级:晋开订单班指导老师:陈宇组长:李鸿图时间:2015.10吸收与解吸一、吸收解吸原理吸收解吸是石油化工生产过程中较常用的重要单元操作过程。
吸收过程是利用气体混合物中各个组分在液体(吸收剂)中的溶解度不同,来分离气体混合物。
被溶解的组分称为溶质或吸收质,含有溶质的气体称为富气,不被溶解的气体称为贫气或惰性气体。
溶解在吸收剂中的溶质和在气相中的溶质存在溶解平衡,当溶质在吸收剂中达到溶解平衡时,溶质在气相中的分压称为该组分在该吸收剂中的饱和蒸汽压。
当溶质在气相中的分压大于该组分的饱和蒸汽压时,溶质就从气相溶入溶质中,称为吸收过程。
当溶质在气相中的分压小于该组分的饱和蒸汽压时,溶质就从液相逸出到气相中,称为解吸过程。
二、吸收过程的分类由于处理的气体混合物性质不同,所采用的设备不同,吸收可分为许多类。
1.按组分的相对溶解度的大小分类2.按吸收过程有无化学反应分类3.按吸收过程温度变化是否显著分类4.按吸收量的多少分类5.按气、液两相接触方式和采用的设备型式分类。
四、吸收剂的选择吸收操作是气液两相之间的接触传质过程,吸收操作的成功与否在很大程度上决定于吸收剂的性质,特别是吸收剂与气体混合物之间的相平衡关系根据物理化学中有关相平衡的知识可知,评价吸收剂优劣的主要依据应包括以下几点:1.溶解度要大2.选择性要高3.蒸汽压要低4.吸收剂易于再生五、吸收与解吸的应用1.用液体吸收气体获得半成品或成品2.气体混合物的分离3.气体的净化和精制4.废气治理5.多组分解吸5.吸收剂应有较高的化学稳定性6.吸收剂应有较低的粘性7.吸收剂应满足价廉、易得、无毒、不易燃烧等经济和安全条件。
六、吸收与精馏的区别吸收和精馏的主要区别在于:吸收是利用混合物中各组份在吸收剂中溶解度不同而将其分离;精馏是利用混合物中各组份挥发度的不同而进行分离的.精馏过程是不平衡的汽液两相双向传质过程,而吸收则可看做是单方向的扩散过程。
化工分离过程__第3章第一讲设计变量的确定

能量交换数: 1
+)
3C+7
Q V L
NDe = Nve-Nce
= C+4
NCe
物料衡算式: C
能量衡算式: 1
相平衡关系式: C+2
化学反应平衡式: 0 内在关系式: 0 2C+3
Nx = 进料+压力 =(C+2)+1=C+3
Na = ND-Nx =(C+4)-(C+3)=1
+)
33
精馏塔(塔内无压降)
相平衡关系式: C(P-1)+2=C+2
化学反应平衡式: 0 内在关系式: 0
Nc = 2C+3
V
L1
Q
L2
NDe = Nve-Nce
= C+4
Байду номын сангаас
14
V Q
L1
产物为两相的全凝器
L2
固定设计变量Nx = 进料+压力=(C+2)+1 可调设计变量Na = ND-Nx=(C+4)-(C+3)=1
如单元温度或引入的冷量
21
例1. 简单精馏塔(塔内无压降)
Nxu
进料变量数: C+2
F Q
压力等级数: 1
+)
C+3
Nau
分配器数: 0
侧线采出: 0
传热单元: 1
串级数: 2
+)
3
22
例2. 有侧采的精馏塔 Nxu
进料变量数: C+2 压力等级数: 1
C+3
Nau
分配器数: 1 侧线采出: 1 传热单元: 2
化工基础 第五章 传质过程及塔设备(吸收)

① 气相在液层中鼓泡,气泡破裂,将雾沫弹溅至上一层塔板;
② 气相运动是喷射状,将液体分散并可携带一部分液沫流动。 说明:开始发生液泛时的气速称之为液泛气速 。
② 降液管液泛
当塔内气、液两相流量较大,导致降液管内阻力及塔板阻力增
大时,均会引起降液管液层升高,当降液管内液层高度难以维 持塔板上液相畅通时,降液管内液层迅速上升,以致达到上一 层塔板,逐渐充满塔板空间,即发生液泛。并称之为降液管内 液泛。
Ⅰ
促进两相传质。
Ⅱ
α= 50
Ⅲ Ⅰ三面切口舌片; Ⅱ拱形舌片; Ⅲ50×50mm定向舌片的尺寸和倾角
d.筛孔塔板 结构简单、造 价低廉、气体
压降小、生产
能力较大;缺 舌形塔板
点是操作弹性
范围较窄,小 孔筛板易堵塞。 e.导向筛板 如图
(导向筛板)
应用:用于减压塔的低阻力、高效率塔板。 斜台:抵消液面落差的影响。 导向孔:使气、液流向一致,减小液面落差。
沸点低的组分气化,达到分离的目的。 增湿是将干燥的空气与液相接触,水分蒸发进入气相。
②液相一液相 在均相液体混合物中加入具有选择性
的溶剂,系统形成两个液相。
(2)流一固相间的传质过程
①气相一固相 含有水分或其它溶剂的固体,与比较干燥的热 气体相接触,被加热的湿分气化而离开固体进入气 相,从而将湿分除去,这就是固体的干燥。 气体吸附的相间传递方向恰与固体干燥相反,它 是气相某个或某些组分从气相向固相的传递过程。
填料分类
球形 丝网波纹
波纹型
规整填料 孔板波纹
隔栅型 格利希隔栅
拉西环
勒辛环
鲍尔环
阶梯环
弧鞍环
金属环矩鞍
规整填料
混堆填料
化工原理吸收
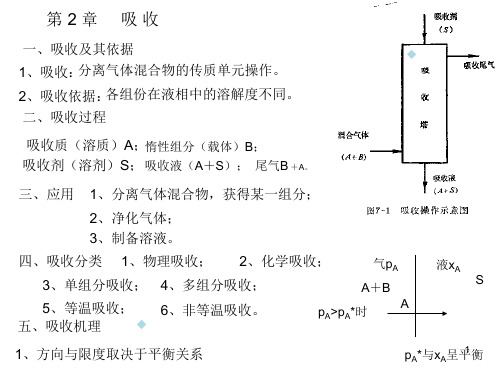
(-2 27
液相: N Az D L ' cC sm (ic-c )作k业L(:ic-复c习)所讲(2 。-218 4 )
2.2.6 吸收过程的机理
1、双膜理论
(1)目的:建立传质速率方程。
(2)双膜理论 ①传质过程
②双膜理论基本论点:
1)相界面,滞流膜层,分子扩散;
2)相界面处达于平衡;
3)流体主体为湍流, dc A 0,膜层内存在 dc A 。
式中: D — 分子扩散系数,m2/s;
(2 -26)
DE一 涡流扩散系数,m2/s;
dcA/dz 一 沿z方向的浓度梯度,kmol/m4;
J — 扩散通量,kmol/(m2·s)。
DE不是物性,与湍动程度有关。
气相: N AR D G T p P B z( m- p p i)k G (- p p i)
NA不涉及传递形式。
推导NA计算式:
NA=JA
-D
dCA dZ
- D dpA RT dZ
(2-15)
稳定过程,NA为常数。因而
dp A dZ
NA
Z
D
dZ-
pA2dpA
0
RTpA1 dZ
也是常数, 故pA~Z为直线关系。
N AR DT (A P Z -1P A)2
(2 -16
9
二、一组分通过另一停滞组分的扩散
平衡分压
p*
一、亨利(Henry)定律
P总不高,T一定, p*=E x (2-1)
x
实际浓度
说明:1、 p*、x 、E(亨利系数,压强单位 )
推导:1m3:
2、适用于 t 一定,理想溶液。E为该 t 下纯溶质p°;
化工分离工程吸收的简洁法计算

4、计算内容
• 已知: V , y , T , x , T , p N 1 N 1 N 1 0 0 和关键组分的分离要求。 • 求:V 。 ,y ,L ,x ,L ,N 1 1 N N 0 • 详细计算为 Tn , Ln ,Vn 。 吸收塔板数的计算也是先求出完成预定分离 要求所需的理论板数,然后再由板效率确定 实际的吸收塔板数
四、平均吸收因子简捷计算法
• 该法假设各板的吸收因子是相同的,则 Horton—Franklin方程
v v A A A N 1 1 1A N 2A N N v A A A 1 N 1 1A N 2A N N
l A A A 1 0 2A N 3A N N AA v A A A 1 N 1 N 1 N 2 N
三、吸收因子法的基本方程
对于多组分混合物的吸引,虽然采用了选择 性较好的吸收剂,但就吸收目的组分的同时, 总是程度不同地吸收了一些其它的组分。因 此针对每个组分可通过A值,再借助于相平 衡,物料衡算式,热量平衡的逐板关联来确 定吸收它的端点条件和流率分布,从而对吸 收塔进行具体的计算。(计算的依据仍然 是MESH方程)
( A A A 1 ) v A A l 1 2 2 4 1 2 0 v 3 A A A A A A 1 1 2 3 2 3 3
( A A ┉ A A ┉ A ┉ A 1 ) v A A ┉ A l 1 2 N 1 2 N 1 N 1 N 1 1 2 N 1 0 n N v N A ┉ A A ┉ A ┉ A 1 1 N 2 N 在每一块理论板上,气液两相充分接触,离 开板的气体混合物与离开板的吸收液达到相 平衡,即 y 。 K i ix i • 溶解量的多少由每个组分的平衡常数来决定, 未被吸收的气体(干气或惰性气体)由塔顶 排出,摩尔流率为V,而吸收了溶质的吸收 剂即吸收液以的流率从塔釜排出,每板上的 气相流率,液相流率都在变化。
化工原理第二章 吸收.

2.2.1平衡溶解度
⑴溶解度曲线 对 单组 分 物 理 吸收 的 物 系 ,根 据 相 律 ,自 由 度 数 F 为 F=CΦ +2=3-2+2=3(C=3,溶质A,惰性组分B,溶剂S,Φ =2,气、液两 相),即在温度 t ,总压 p ,气、液相组成共4个变量中,由3个自 变量(独立变量),另1个是它们的函数,故可将平衡时溶质在气 相中的分压 pe 表达为温度 t ,总压 p 和溶解度 x 的函数:
2.1概述
①溶剂应对被分离组分(溶质)有较大的溶解度,或者说在 一定的温度与浓度下,溶质的平衡分压要低。这样,从平衡角度 来说,处理一定量混合气体所需溶剂量较少,气体中溶质的极限 残余浓度亦可降低;就过程数率而言,溶质平衡分压↓,过程推 动力大,传质数率快,所需设备尺寸小。 ②溶剂对混合气体中其他组分的溶解度要小,即溶剂应具备 较高的选择性。若溶剂的选择性不高,将同时吸收混合物中的其 他组分,只能实现组分间某种程度的增浓而不能实现较为完全的 分离。 ③溶质在溶剂中的溶解度应对温度的变化比较敏感,即不仅 在低温下溶解度要大,平衡分压要小,而且随着温度升高,溶解 度应迅速下降,平衡分压应迅速上升。这样,被吸收的气体容易 解吸,溶剂再生方便。
2.1概述
④溶剂的蒸汽压要低,不易挥发。一方面是为了减少溶剂在 吸收和再生过程的损失,另一方面也是避免在气体中引入新的杂质。 ⑤溶剂应有较好的化学稳定性,以免使用过程中发生变质; ⑥溶剂应有较低的粘度,不易产生泡沫,以实现吸收塔内良 好的气液接触和塔顶的气液分离。 ⑦溶剂应尽可能满足价廉、易得、无毒、不易燃烧等经济和 安全条件。 实际上很难找到一个理想得溶剂能够满足上述所有要求,应 对可供选择得溶剂做全面得评价,以便作出经济、合理得选择。 ⑹吸收操作得经济性 吸收总费用=设备(塔、换热器等)折旧费+操作费(占比重大)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1/ a
∵(CA) 物> (CA)化,∴ (PA)物 > (PA)化
TSHY
3.3.2 伴有化学反应的吸收相平衡
1. 被吸收组分与溶剂相互作用
(1)溶质A与溶剂B反应生成M
若其反应关系为:
A(g) HA A(L)+ B(L) Ka M(L)
溶液中A组分的初始浓度 c 0 可写成: c 0 c A cM A A
ˆ f i L 2440 kP a) (
TSHY
解例 3-1
④计算相平衡常数
对于理想溶液, i 1
,则相平衡常数为:
Hale Waihona Puke ˆ yi f i L i 2440 mi G 1.49 ˆ xi 1640 fi
TSHY
3.3.2 伴有化学反应的吸收相平衡
亨利定律不适用化学吸收的相平衡,化 学吸收的气液平衡,既要服从溶解时的 相平衡又要服从化学反应时的相平衡关 系.
吸收是一个分离过程,且分离的是气体混合物,分离的介质是某一 吸收是一个从气相往液相的传质过程。 被吸收的气体通过适当的方法与吸收液分离的过程称为解吸过程, 应用:常用于获得产品、分离气体混合物、净化原料气以及脱除尾气
种液体溶剂称之为吸收剂,被吸收的气体混合物称为溶质。
对吸收液而言,则成为再生。
式中,x0 是在溶液中吸收剂的摩尔分率,x0=1-xi ;Hi 为亨利系数, kPa;A是与温度和压力有关的一个常数。
ˆ fi A 2 ln ln H i (1 x0 ) xi RT
(3-11)
此式适合于任何浓度的电解质溶液和很低浓度的非电解质溶液。
TSHY
3.3.1 物理溶解时的相平衡
对比温度: 293 对比压强: 2000 查图3-8得: ˆ 0.41 0.96 i 0.82
350.1
4900
逸度计算:
ˆ ˆ f iG p i 2000 0.82 1640 kPa) (
②计算293K下乙烷饱和蒸汽压的逸度
对比温度: 293 0.96 对比压强: 3900 0.79 查图3-8得:ˆ 0.67 i
(4) 贫液和回流液的温度
(5) 各种换热器的热负荷 (6) 吸收塔和再生塔的高 度
TSHY
3.2.2 吸收过程对生产工艺的适应性
(1) 操作压强 压力高利于吸收,但操作费用将增加,通常选择气体来时的 压力。特殊情况可考虑增压操作。
(2) 溶质的气相浓度
关键是控制吸收塔出口气中的溶质指标。 (3) 毒性
3. 气体净化
用吸收剂将气体中的有害组分吸收以达到气体净化目的。如天然气 的脱硫,生产尾气的SO2脱除。 4. 回收有价值组分 为防止有价值组分从气相流失,用吸收剂将其吸收下来达到回收的 目的。如一些易挥发溶剂的回收。
TSHY
3.2 吸收过程的设计变量 和对生产工艺的适应性
吸收过程的重要因素
(1) 设备条件
而反应平衡常数为:
cM c0 cA K A c Ac B c Ac B
则:
cA c0 A 1 K c B
(3-26)
总平衡又服从物理溶解时的亨利定律,因此:
pA
H c0 A A 1 K c B
TSHY
3.3.2 伴有化学反应的吸收相平衡
H 0 A pA cA 1 k c B
ˆ ˆ f iG f i L
TSHY
3.3.1 物理溶解时的相平衡
(1) 气液平衡常数mi
ˆ 式中, i 、 i 分别为i组分在气相的逸度系数和在液相的活度系数;p 为气相总压,f i L 为纯i组分液相在体系温度和压力下的逸度。
(2) 二元组分溶解的气液平衡关系
yi f iL i mi ˆ xi pi
aA
HA aA+bB
Ka
mM+nN
TSHY
3.3.2 伴有化学反应的吸收相平衡
则反应平衡常数为:
m n m n m n m n M N cM c N M N cM c N K a a b a b a b a b K A B c Ac B A B c Ac B
TSHY
3 吸 收
4、吸收过程的特点
吸收与精馏操作的相同点: ☆ 平衡分离过程
☆ 热、质同传过程,由MESH方程求解
吸收与精馏的不同点: ①原理不同: 吸收是根据各组分溶解度不同进行分离的。
精馏利用组分间相对挥发度不同使组分分离。
②塔式不同 ③传质形式不同 吸收过程:单向传质,气相传质到液相,需外加吸收剂; 精馏过程:双向传质,液相传质到汽相,汽相传质到液相,不需加 质量分离剂。
TSHY
3 吸 收
3.1 吸收过程在化学工业中的应用 3.3 气液相平衡 √ √
3.2 吸收过程的设计变量和对工艺生产的适应性√ 3.4 传质理论
3.5 传质速率和传质系数 3.10 塔高 √
TSHY
3 吸 收
1、吸收的基本原理
吸收是利用液体处理气体混合物,根据气体混合物中各组分在液体
中溶解度的不同,而达到分离目的传质过程。
pA
K1cM
(3-29) (3-30)
K1 K c B 1 K c B
(2c 0 K a ) K a (4c 0 K a ) A A cA 2(1 K c B )
K a ( 4c 0 K a ) A
H cA A
H A [(2c 0 K a ) A 2(1 K c B )
TSHY
3.3.2 伴有化学反应的吸收相平衡
(2)生成物M发生离解 若反应生成物发生离解:
M K1 K + + A-
此时,气液平衡不按反应平衡计算而按离解平衡计算。 cK cA 离解平衡常数为: K1 cM 若忽略水的离解,则有:cK cA- ,因此: cK 而溶液中A的初始浓度可表示为: c 0 c A cM c A A 联立求解以上方程,得: 其中, K a 所以:
典型实例:硫酸吸收SO3吸收制硫酸
TSHY
3.1.1 吸收装置的工业流程
2. 吸收剂需要解吸的吸收装置
使用对象:气体的净化或回收; 流程特点:至少有两个塔(多了一个再生过程)。
减压冷再生:通过改变P,改变相平衡,使溶质解吸。
适用:高压下化学吸收液的初脱。 气提冷再生:用惰性气体降低溶质在气相的分压促使解吸;
350.1
4900
ˆG ˆ 逸度计算: f is pis i 3900 0.67 2610 kPa) (
TSHY
解例 3-1
③计算液相乙烷的逸度
ˆL 对于温度为T,饱和蒸汽压为 p s 的纯液体组分的逸度 f is 应等于饱和 i ˆ G 。而当压强为p时,液相逸度可近似用下式计算: 蒸汽的逸度 f
ln H i
i
RT
Ci
式中的Ci、φi是常数,与物系有关。
TSHY
3.3.1 物理溶解时的相平衡
当系统压力较大时,体系偏离理想状态较远,按上述方法计算的偏
差较大。考虑到液体体积通常随压力变化不大,此时,可用以下式子
ˆ 来计算气相逸度 f iG 。
ˆ f iG V ln ln H i i ( p pi ) xi RT
中的有毒有害物质。
TSHY
3 吸 收
2、流程图
TSHY
3 吸 收
3、吸收操作的分类
依据吸收的机理可分成 物理吸收(甲醇-CO2) 化学吸收(K2CO3- CO2) ★ 物理吸收的特点: 所溶组分与吸收剂不起化学反应 极限:溶解平衡= f (T,P) ★ 化学吸收的特点: 所溶组分与吸收剂起化学反应 极限:相平衡= f (T,P,反应组分B)
is
ˆ f i L Vi ln G ( p pis ) ˆ RT f is
M
式中,Vi为在一定p和T时,组分i的摩尔体积:
计算: 所以:
Vi
30 0.0857 m3 / mol) ( 350
ˆ fiL 0.0857 ln (2000 3900) 0.067 2610 8.314 293
TSHY
3.1.1 吸收装置的工业流程
(4)间接蒸汽热再生流程 典型实例:热钾碱法脱碳流程
TSHY
3.1.2 吸收过程的应用
1. 获得产品 将气体中的有效成分用吸收剂吸收下来得到产品。如硫酸吸收SO3 制浓硫酸,水吸收HCl制盐酸。
2. 气体混合物的分离
吸收剂选择性吸收气体中的某一组分达到分离目的。如用有机溶剂 吸收煤气中的苯,用丙酮吸收天然气裂解气中的乙炔。
设备形式、尺寸、内部构件等,都与传质效率有关。 同等处理规模下,效率越高,设备投资越少。
(2) 吸收剂 选择性是关键,解吸条件也非常重要。 (3) 操作条件 温度:温度越高,越不利于吸收; 压力:压力越高,越有利于吸收。
TSHY
3.2.1 设计关键参数分析
(1) 吸收塔的直径
(2) 再生塔的直径
(3) 再生塔的压强
aA HA aA+bB Ka mM+nN
理想溶液时,Kγ=1,则:
m n Ka cM c N K a b K c AcB
(3-21)
因为溶解平衡关系服从亨利定律:
pA H cA A
用(3-21)解出CA,带入上式得:
pA
H A
m cM
n cN b K c B
知 乙 烷 的 临 界 温 度 tc=305.1K , 临 界 压 力
pc=4900kPa , 饱 和 蒸 汽 压 pis=3900kPa( 在 293K 时 ) , 以 及 在 3900kPa 下 的 密 度 ρ=350kg/m3。
